




- 3.1《铁及其化合物 》课件+教案 课件 45 次下载
- 3.2《金属材料 》课件+教案 课件 42 次下载
- 4.2《原子结构与元素的性质》课件+教案 课件 39 次下载
- 4.4《化学键》课件+教案 课件 41 次下载
- 4.3《元素周期律》课件+教案 课件 39 次下载
高中人教版 (2019)第一节 原子结构优质课课件ppt
展开人教版化学科高一年必修一
《原子结构》教学设计
课题 | 原子结构 | 课型 | 新授课 |
教学目标 | 1了解原子结构发展史。 | ||
2了解认识原子结构及其重要关系式 | |||
3了解元素周期表结构及其核素概念。 | |||
教学重难点 | 重点:元素周期表结构、核素概念 | ||
难点:元素周期表结构、核素概念 | |||
教学环节 | 教学过程 | ||
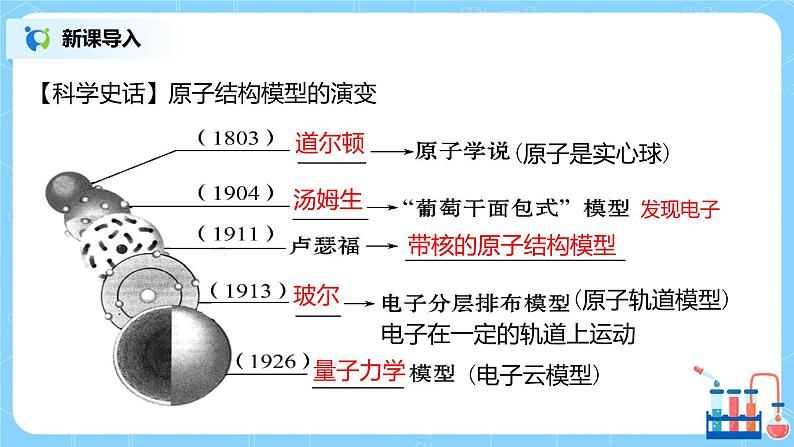
课堂导入 | 【新课导入】科学史话:原子结构模型的演变 | ||
课程 学习
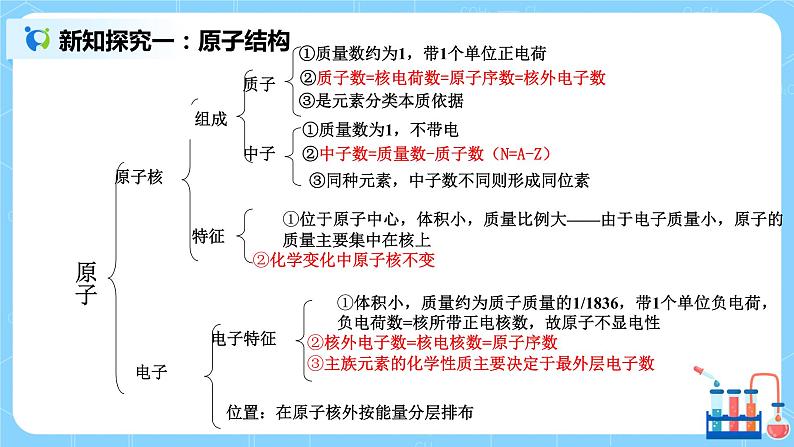
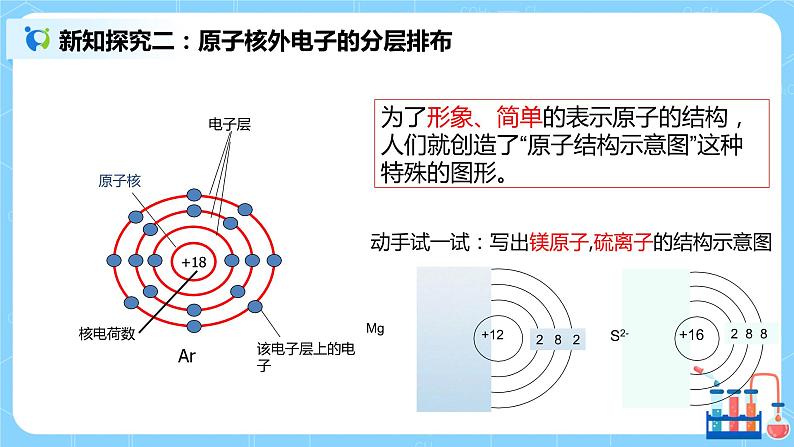
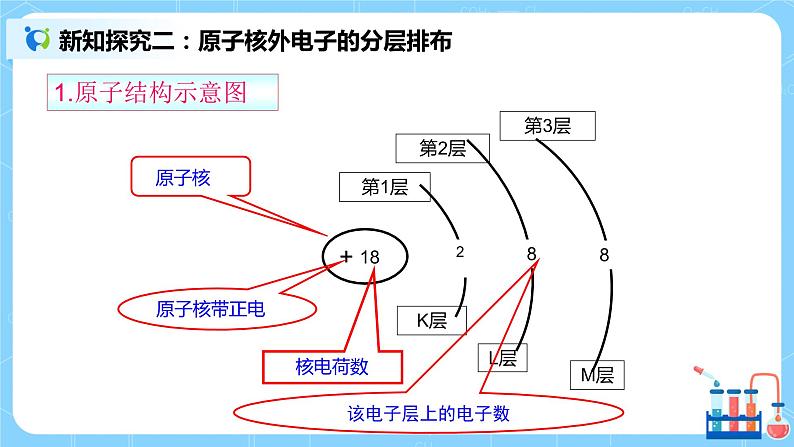
| 一、原子结构 重要关系式: 核电荷数=核内质子数=核外电子数=原子序数 质量数(A)=质子数(Z)+中子数(N) 质量数(A)≈该同位素的相对原子质量 离子:原子得到或失去电子所形成的带电微粒,所以: 离子电荷=质子数-核外电子数 或表示为: 质子数(Z)=阳离子的核外电子数+阳离子的电荷数 质子数(Z)=阴离子的核外电子数-阴离子的电荷数 二、原子核外电子的分层排布 1.原子结构示意图:为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。 呈现:1-18号元素的核外电子排布-----原子结构示意图 2. 原子核外电子排布规律:(分层排布) 结论: (1)能量最低原理:电子排满能量低的电子层后才会排能量高的电子层(K、L、M.....) (2)每个电子层最多容纳的电子数为2n2(n表示电子层数) (3)第一层最多不超过2个电子,第二层最多不超过8个电子,最外层最多不超过8个电子,次外层最多不超过18个电子,倒数第三层最多不超过32个电子。 (4)稀有气体最外层的电子数为2个或8个,达到了稳定结构。 上述规律相互制约,相互联系。 三、元素周期表的结构 1.周期 :3短3长1不全 2.族:7A、7B、零族、第Ⅷ族(8,9,10三个纵行) 周期序数 = 电子层数 主族序数=最外层电子数=价电子数=最高正价总数(O、F除外) 3. 四、核素 “三素”比较: 核素——具有一定质子数和一定中子数的一种原子。核素即原子,其种类由质子数和中子数决定。绝大多数元素都存在不同种核素。 同位素——质子数相同,中子数(或质量数)不同的原子的互称。 五、课堂练习 1. 下列说法正确的是 ( ) A.原子是不可再分的粒子 B.相对原子质量就是原子的实际质量 C.分子是保持物质性质的最小粒子 D.与元素化学性质关系密切的是原子的最外层电子数 2.某微粒R的核外电子排布如图所示(x代表核内质子数)。 下列说法正确的是( ) A.若R为离子,则R应为非金属元素 B.若R为阳离子,则R原子的核外电子排布应为3层 C.若R为阴离子,则H2与R元素形成的氢化物的化学式应为HR D.若x为8,则R原子的核外电子数应为10 3有A、B、C、D 4种元素,其中A元素的焰色反应呈黄色,它与C元素组成的化合物是人们常用的调味品,B元素原子比A元素原子多一个电子,D元素与C元素的电子层数相同,在与活泼金属反应时通常显-2价。 (1)写出A、B、C、D的元素符号, A______,B_______,C_______,D_____。 (2)试从原子结构角度分析,哪两种元素的原子最容易结合?并说明理由: | ||
课堂 小结 | 一、原子结构模型的演变 二、原子核外电子的分层排布 三、元素周期表结构 四、核素 | ||
板书设计 | 一、原子结构模型的演变 二、原子核外电子的分层排布 1.原子结构示意图 2.原子核外电子排布一般规律 三、元素周期表结构 四、核素 | ||
教学反思 | 对于原子结构的教学,应正确发挥模型的作用,因为: 1、物质的结构与性质模块,利用科学史的素材,是建立模型认识 的很好的方式。 2、可以进一步挖掘科学史中的科学方法的价值 3、可以让学生参与模型建构的活动。 | ||
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表获奖ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表获奖ppt课件,共23页。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表优质课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表优质课件ppt,共31页。PPT课件主要包含了教学重点,教学难点,碱金属元素,教学内容,化合态,碱金属的化学性质,碱的物理性质,难点突破,2递变性,最外层电子数等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表公开课课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第一节 原子结构与元素周期表公开课课件ppt,共36页。PPT课件主要包含了原子书法,人类对原子结构的认识,原子结构的探索之路,实验室中的卢瑟福,战争狂人美梦灭,H2O,认识质量数,认识核素,同位素分离器,还有什么疑问等内容,欢迎下载使用。














