












九年级下册第八章 常见的酸、碱、盐8.4 常用的盐教学课件ppt
展开1、培养学生独立思考能力。2、扩宽学生课外知识面。3、让学生具备通过课堂学习,进行分析,并且领悟书本上隐含的更深层次的含义。
[问题一] 生活中的盐常指的是哪种物质?
食盐(NaCl)。
[问题二] 食盐是盐,盐就是食盐。 你认为是否正确?请说出理由。
食盐是盐,是正确的。因为食盐是由Na+ 和Cl- 构成的化合物;盐就是食盐,这种说法是错误的。因为盐是由金属离子和酸根离子构成的一类化合物。 例如:Na2CO3、KCl等都是盐。
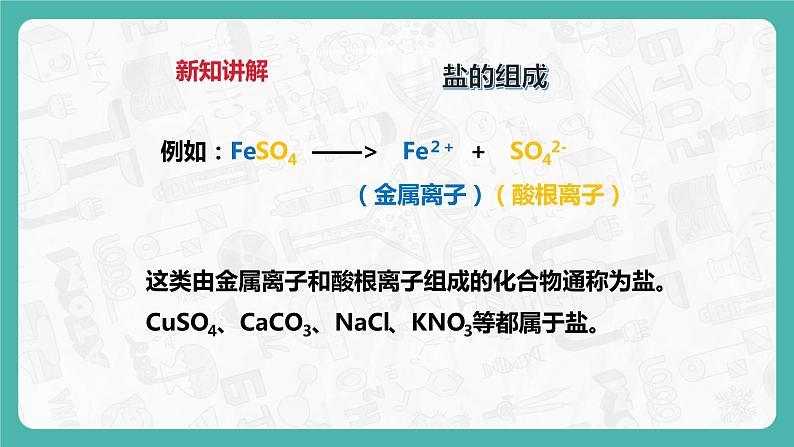
盐是由金属阳离子(或铵根离子NH4+)和酸根离子构成的一类化合物
这类由金属离子和酸根离子组成的化合物通称为盐。CuSO4、CaCO3、NaCl、KNO3等都属于盐。
例如:FeSO4 ——> Fe2+ + SO42-
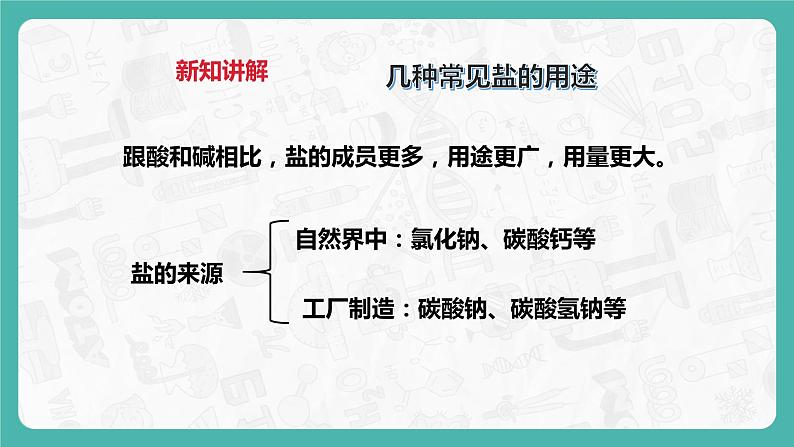
自然界中:氯化钠、碳酸钙等
工厂制造:碳酸钠、碳酸氢钠等
跟酸和碱相比,盐的成员更多,用途更广,用量更大。
氯化钠(食盐的主要成分)
白色晶体,易溶于水,有咸味,溶液呈中性。
制盐酸、氯气等化工原料
碳酸钙 (石灰石、大理石主要成分) CaCO3
多为灰白色矿物,纯净物为白色粉末,不溶于水,能溶于酸。
建筑装饰材料、制熟石灰材料
碳酸钠(俗称: 纯碱、苏打) Na2CO3
白色晶体、风化成粉末,易溶于水,水溶液呈碱性。
碳酸氢钠 (俗称: 小苏打) NaHCO3
白色粉末,能溶于水,水溶液有弱的碱性,较易分解。
辨析食盐和盐、纯碱和碱
食盐的主要成分是NaCl,而盐是化合物的一种分类; 纯碱是Na2CO3的俗称,另一俗称是苏打,水溶液呈碱性,但纯碱不是碱而是盐。
A、NaOH 氢氧化钠 烧碱 B、CaO 氢氧化钙 生石灰 C、Na2CO3 碳酸钠 纯碱D、NaCl 氯化钠 食盐
(1)下列有关物质的化学式、名称、俗名不完全对应的是( )
A、添加大量的亚硝酸钠来保鲜食物B、硝酸钾在农业上可以用作复合肥C、农业上多用硫酸铜配制波尔多液D、用纯碱除去面粉发酵时生成的酸
(2)盐在日常生活中是用途十分广泛的一类物质,下列说法中不正确的是( )
纯碱用途广泛。在过去,其生产技术长期把持在西方发达国家手中。生于福建农民家庭的侯德榜 (1890~1974) 1921年从美国获博士学位后回国创业。1926年他主持生产出高纯度的“红三角牌”纯碱,获当年美国费城万国博览会金奖。
抗日战争时期,在艰苦条件下,侯德榜成功摸索和改进西方制碱方法,发明将制碱与制氨结合起来的联合制碱法。此法提高了原料利用率,降低了成本。被世界上公认,称之为“侯氏联合制碱法”。
NH3+H2O+CO2=NH4HCO3NH4HCO3+NaCl=NaHCO3+NH4Cl2NaHCO3=Na2CO3+H2O+CO2↑
盐的组成有什么特点?
由金属离子和酸根离子组成的化合物通称为盐。
Na2SO4K2CO3Mg(NO3)2FeCl3
它们的阳离子都是_____离子
它们的阴离子都是_____离子
根据阳离子不同,盐可分为钠盐、钾盐、镁盐、铁盐等; 根据阴离子不同,盐可分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等; 由铵根离子(NH4+)和酸根离子组成的化合物也属于盐类,称为铵盐。例如NH4NO3、(NH4)2SO4等。
带K+、NH4+、Na+离子的盐都溶于水; 带NO3+根离子的盐都溶于水; 带Cl-离子的盐中只有AgCl不溶; 带SO42-离子的盐中只有BaSO4、CaSO4、Ag2SO4不溶; 带CO32-离子的盐中只有K2CO3、Na2CO3、(NH4)2CO3溶于水。
口诀:钾钠铵盐硝酸盐,完全溶解不困难氯化亚汞氯化银,硫酸钡和硫酸铅,生成沉淀记心间氢硫酸盐和碱类,碳酸磷酸硝酸盐,可溶只有钾钠铵
A、氯化铵 B、硝酸银 C、硫酸钡 D、硫酸铜
下列物质是不溶物的是( )
不同的盐可以由酸与碱发生中和反应得到, 你知道下列各种盐可以由什么相关的酸和碱反应得到吗?
例子:H2SO4+2NaOH->Na2SO4+2H2O
1、由金属离子和酸根离子组成的化合物通称为盐;CuSO4、CaCO3、NaCl、KNO3等都属于盐。 2、生活中常见的盐有氯化钠、碳酸钙、碳酸钠、碳酸氢钠 3、钾钠铵盐硝酸盐,完全溶解不困难;氯化亚汞氯化银,硫酸钡和硫酸铅,生成沉淀记心间;氢硫酸盐和碱类,碳酸磷酸硝酸盐,可溶只有钾钠铵。
化学课题1 生活中常见的盐优质ppt课件: 这是一份化学课题1 生活中常见的盐优质ppt课件,文件包含111-1生活中常见的盐第1课时教学课件pptx、111-1教学设计生活中常见的盐第1课时docx、111-1练习·能力提升生活中常见的盐第1课时docx、111-1练习·基础巩固生活中常见的盐第1课时docx、111-1预习导学生活中常见的盐第1课时docx、111-1练习·素能拓展生活中常见的盐第1课时docx等6份课件配套教学资源,其中PPT共18页, 欢迎下载使用。
化学人教版第十一单元 盐 化肥课题1 生活中常见的盐精品ppt课件: 这是一份化学人教版第十一单元 盐 化肥课题1 生活中常见的盐精品ppt课件,文件包含第1课时常见的盐课件pptx、第1课时几种常见的盐导学案doc、第1课时几种常见的盐教案doc、亚硝酸盐wmv、碳酸钠碳酸氢钠分别与稀盐酸的反应wmv、碳酸钠溶液与澄清石灰水反应wmv、食盐wmv等7份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
初中化学人教版九年级下册第十一单元 盐 化肥课题1 生活中常见的盐精品课件ppt: 这是一份初中化学人教版九年级下册第十一单元 盐 化肥课题1 生活中常见的盐精品课件ppt,文件包含第3课时盐的化学性质pptx、第3课时盐的化学性质docx、第3课时盐的化学性质docx、第3课时盐的化学性质学用docx等4份课件配套教学资源,其中PPT共14页, 欢迎下载使用。













