



- 2021_2022学年新教材高中化学专题3水溶液中的离子反应3.2影响盐类水解的因素及盐类水解的应用课件苏教版选择性必修1 课件 0 次下载
- 2021_2022学年新教材高中化学专题3水溶液中的离子反应2.1溶液的酸碱性与pH课件苏教版选择性必修1 课件 0 次下载
- 2021_2022学年新教材高中化学专题3水溶液中的离子反应1弱电解质的电离平衡课件苏教版选择性必修1 课件 0 次下载
- 2021_2022学年新教材高中化学专题3水溶液中的离子反应章末共享专题课件苏教版选择性必修1 课件 0 次下载
- 2021_2022学年新教材高中化学专题3水溶液中的离子反应2.2酸碱中和滴定课件苏教版选择性必修1 课件 0 次下载
苏教版 (2019)选择性必修1第三单元 盐类的水解多媒体教学ppt课件
展开课程目标1.了解盐类水解的原理。2.掌握盐类水解方程式的书写。3.了解盐类水解的类型和规律。
NH4Cl、AlCl3、Fe2(SO4)3
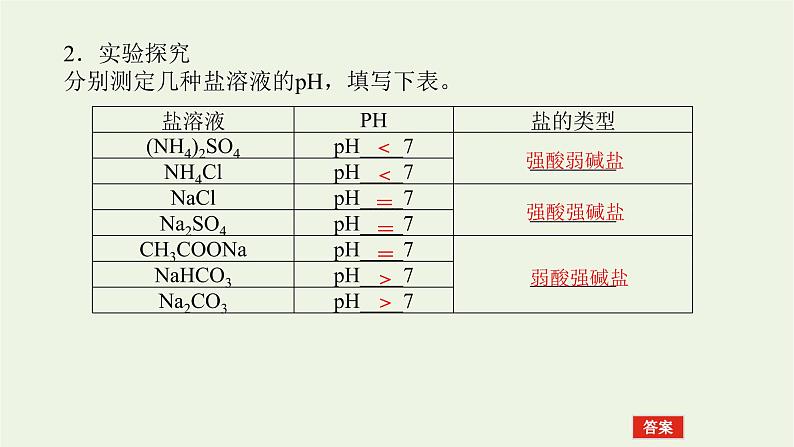
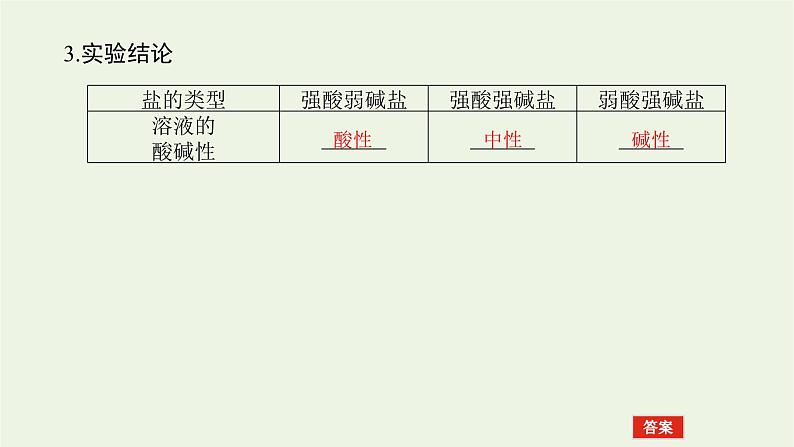
2.实验探究分别测定几种盐溶液的pH,填写下表。
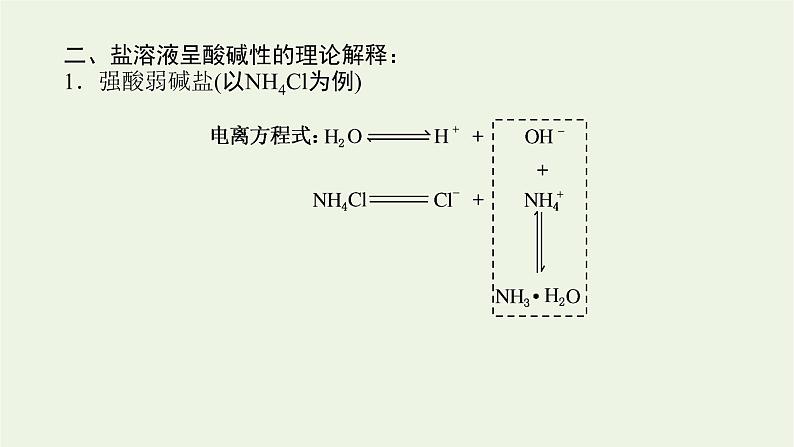
二、盐溶液呈酸碱性的理论解释:1.强酸弱碱盐(以NH4Cl为例)
2.弱酸强碱盐(以CH3COONa为例)
3.强酸强碱盐(以NaCl为例)H2O⇌OH-+H+,NaCl===Na++Cl-,盐电离出的离子Na+和Cl-不能与H2O电离出的H+或OH-生成________,c(H+)=c(OH-),该盐溶液呈中性。
三、盐类的水解1.定义:盐在水溶液中电离出的离子与水电离出的_________结合生成________的反应。2.实质:盐与水发生化学反应,生成________,从而使水的电离平衡向________方向移动,可以看成酸碱中和反应的逆过程。3.表示方法:(1)用化学方程式表示:盐+水⇌酸+碱。如AlCl3的水解:______________________。(2)用离子方程式表示:盐的离子+水⇌酸(或碱)+OH-(或H+)。如AlCl3的水解:______________________。
AlCl3+3H2O⇌Al(OH)3+3HCl
Al3++3H2O⇌Al(OH)3+3H+
[即时性自测]1.判断正误,正确的打“√”,错误的打“×”(1)盐类水解时,弱碱阳离子与水电离出的OH-结合生成弱碱,弱酸根阴离子与水电离出的H+结合生成弱酸或弱酸酸式酸根离子。( )(2)盐类的水解反应是吸热反应。( )(3)正盐的水溶液的pH均为7。( )(4)在Na2S溶液中c(Na+)与c(S2-)的比值是2。( )(5)强酸强碱盐的水溶液一定显中性。( )
5.盐是一类常见的电解质,事实表明盐溶液不一定呈中性。(1)CH3COONa、NH4Cl、KNO3的水溶液分别呈________性、________性、________性。(2)盐中阴、阳离子的水解使盐溶液呈现的酸碱性不同,盐水解的离子方程式也不相同,如CH3COONa和NH4Cl水解的离子方程式分别为______________________________、_________________________。(3)氯化铝水溶液呈_____性,原因是________________________(用离子方程式表示)。
CH3COO-+H2O⇌CH3COOH+OH-
提升点一 盐类水解的类型与规律[例1] 已知甲、乙、丙、丁四种溶液分别为CH3COONa、NH3·H2O、CH3COOH、Na2SO4中的一种,相同温度下,甲与乙两种溶液的pH相同,甲与丙两种溶液中水的电离程度相同,则丙为( )A.NH3·H2O B.CH3COONaC.CH3COOH D.Na2SO4
解析:CH3COONa为强碱弱酸盐,水解呈碱性;NH3·H2O为弱碱,CH3COOH为弱酸,Na2SO4为强酸强碱盐不水解呈中性,根据溶液的酸碱性,相同温度下,甲与乙两种溶液的pH相同,甲与乙一定是CH3COONa、NH3·H2O中的一种,因为它们都呈碱性,甲与丙两种溶液中的水的电离程度相同,NH3·H2O、CH3COOH、碱和酸抑制水的电离,所以甲与丙一定是NH3·H2O、CH3COOH中的一种,则甲为NH3·H2O、乙为CH3COONa、丙为CH3COOH,C正确。
状元随笔 思路点拨:将物质分类分析:①酸碱都对水的电离有抑制作用。②可水解的盐对水的电离有促进作用。③强酸强碱盐对水的电离无影响。
[提升1] 室温下,物质的量浓度相同的下列溶液,按pH由小到大的顺序排列的是( )A.Na2CO3、NaHCO3、NaCl、NH4ClB.Na2CO3、NaHCO3、NH4Cl、NaClC.(NH4)2SO4、NH4Cl、NaNO3、Na2SD.NH4Cl、(NH4)2SO4、Na2S、NaNO3
状元随笔 比较同浓度溶液pH大小的方法:(1)总体pH大小规律:碱>盐>酸(2)同类物质的pH大小规律:①碱:二元强碱>一元强碱>一元弱碱②酸:一元弱酸>一元强酸>二元强酸③盐:强碱弱酸盐>强酸强碱盐>强酸弱碱盐
[关键能力]盐的水解类型和规律1.盐类的水解类型
2.盐类的水解规律水解看组成,有弱才水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性,规律要记清。(1)“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。(2)“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。
状元随笔 离子水解时符合“阴生阴、阳生阳”即阴离子水解生成OH-,阳离子水解生成H+。特别注意酸式酸根的电离与水解方程式的区别:H+也可写成H3O+。如:HS-+H2O⇌H2S+OH-(水解)HS-+H2O⇌S2-+H3O+(电离)
[提升2] (1)写出下列物质发生水解反应的离子方程式,并指出水溶液的酸碱性。①Na2S________________________________________________;②CuSO4_______________________________________________;③NH4Cl_______________________________________________;④NaHCO3______________________________________________。(2)写出下列各组盐溶液混合后发生反应的离子方程式。①AlCl3和Na2S__________________________________________;②Al2(SO4)3和NaHCO3____________________________________。
S2-+H2O⇌HS-+OH-、HS-+H2O⇌H2S+OH-(碱性)
Cu2++2H2O⇌Cu(OH)2+2H+(酸性)
2Al3++3S2-+6H2O===2Al(OH)3↓+3H2S↑
状元随笔 多元弱酸根水解要分步;能够相互促进且水解较为彻底的,书写时可用“=”“↓”“↑”。
[关键能力]1.一般模式及特点阴(阳)离子+H2O⇌弱酸(或弱碱)+OH-(或H+)。(1)一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,因此盐类水解的离子方程式中不标“↓”或“↑”,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。(2)盐类水解是可逆反应,是中和反应的逆反应,而中和反应是趋于完全的反应,所以盐的水解反应是微弱的,盐类水解的离子方程式一般不写“===”而写“⇌”。
状元随笔 能够相互促进水解且水解较为彻底时,一般都有沉淀生成。
1.下列溶液因水解而呈酸性的是( )A.CH3COOH溶液 B.KHSO4溶液C.AlCl3溶液 D.NaF溶液
解析:CH3COOH、KHSO4均可电离出H+而使溶液呈酸性,A、B项不符合题意。Al3+可发生水解反应Al3++3H2O⇌Al(OH)3+3H+,使溶液呈酸性,C项符合题意。F-可发生水解反应F-+H2O⇌HF+OH-,使溶液呈碱性,D项不符合题意。
2.下列说法错误的是( )A.盐溶液呈酸性或碱性的原因是盐的水解破坏了水的电离平衡B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)C.在CH3COONa溶液中,由水电离出的c水(OH-)≠c水(H+)D.水中的H+(或OH-)与盐电离出的弱酸阴离子(或弱碱阳离子)结合生成弱电解质、导致盐溶液呈碱性(或酸性)
解析:盐溶液呈酸性或碱性的原因是盐的水解破坏了水的电离平衡,使溶液中c(H+)≠c(OH-),A项正确;溶液呈酸性则一定有c(H+)>c(OH-),B项正确;根据水的电离方程式H2O⇌H++OH-可知,在任何溶液中由水电离出的c水(OH-)=c水(H+),C项错误;水中的H+(或OH-)与盐电离出的弱酸阴离子(或弱碱阳离子)结合生成弱电解质,是导致盐溶液呈碱性(或酸性)的原因,D项正确。
4.对水的电离平衡不产生影响的粒子是( )
解析:由于H2O⇌H++OH-,A项,加入HCl,c(H+)增大,抑制水的电离;B项为Mg2+,Mg2+能发生水解,促进水的电离;C项为Cl-,Cl-不会发生水解,对水的电离无影响;D项,CH3COOH为弱酸,CH3COO-能发生水解,促进水的电离。
5.对于常温下pH均为4的氯化铵溶液与醋酸溶液,下列叙述正确的是( )A.溶液中c(H+)相等B.水电离的c(H+)相等C.两溶液中水的电离程度相等D.两溶液导电能力相同
7.等物质的量浓度的下列物质的溶液,其pH由小到大的顺序排列正确的是( )①CH3COONa ②NaOH ③NaNO3 ④HCl ⑤Al2(SO4)3A.①②③④⑤ B.⑤④③②①C.④⑤③①② D.④⑤②①③
解析:①为强碱弱酸盐,溶液pH略大于7;②为强碱,溶液pH大于7,且pH:①<②;③为强酸强碱盐,溶液pH等于7;④为强酸,溶液pH小于7;⑤为强酸弱碱盐,溶液pH小于7,且pH:④<⑤<③;综合上述分析C项正确。
9.现有室温下浓度均为1×10-3 ml·L-1的几种溶液:①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH溶液。回答下列问题:(1)上述6种溶液中,水电离出的c(H+)最大的是________,最小的是________。(2)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③________(填“>”“<”或“=”)⑥。(3)将等体积的①、⑤混合,则溶液的pH________(填“>”“<”或“=”)7,用离子方程式说明其原因:________________________。
(4)向相同体积的①、②、③溶液中分别加入相同且足量的锌粒,反应的初始速率由快到慢的顺序为________,最终产生H2总量的关系为________。(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①________(填“>”“<”或“=”,下同)③。(6)将等体积的⑤、⑥溶液加热至相同温度后,溶液的pH大小关系为⑤________⑥。
解析:(4)由于起始时c(H+):②>①>③,c(H+)越大,反应速率越快。由于酸提供的H+总量n(H+):②>①=③,由此可知产生H2的总量关系为②>①=③。(5)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,混合后,溶液可以看成“分别向醋酸中加入等体积等浓度的①氯化钠和③醋酸钠”,由于NaCl不影响CH3COOH的电离,而醋酸根抑制了CH3COOH的电离。故答案是“<”。(6)虽然加热能促进氯水的电离,但仍不可能完全电离,而且由于温度升高,NH3会挥发,因此溶液的pH:⑤<⑥。
高中化学第三单元 盐类的水解图片课件ppt: 这是一份高中化学第三单元 盐类的水解图片课件ppt,共17页。
高中化学苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第三单元 盐类的水解作业课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第三单元 盐类的水解作业课件ppt,共19页。
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解评课ppt课件: 这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解评课ppt课件,共24页。PPT课件主要包含了课程目标,基础•初探,☂名师点拨,课堂•专练,2实质,盐类水解的规律等内容,欢迎下载使用。













