





2020-2021学年课题1 常见的酸和碱课文内容ppt课件
展开1.知道稀盐酸和稀硫酸能使指示剂变色。
3.知道稀酸与金属氧化物反应。
2.知道金属与稀盐酸、稀硫酸反应。
在不借用试剂的前提下,你可以使紫色的石蕊变成红色吗?
紫色石蕊试液为什么变色?
除了碳酸,还有其他物质能使紫色石蕊试液变红吗?
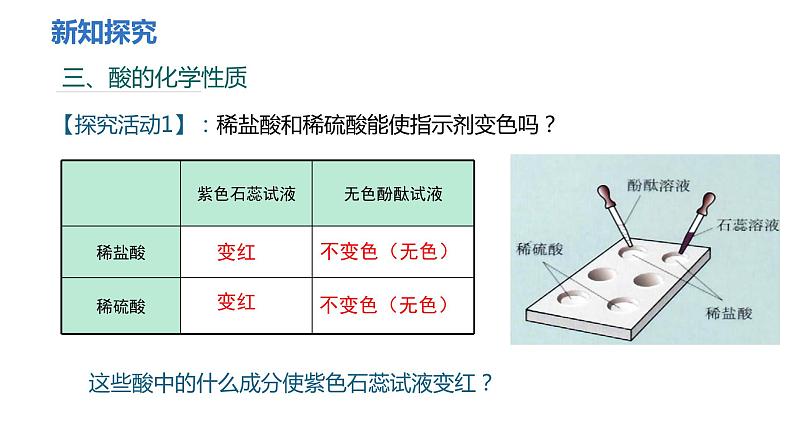
【探究活动1】:稀盐酸和稀硫酸能使指示剂变色吗?
这些酸中的什么成分使紫色石蕊试液变红?
思考:现有两瓶未贴标签的稀盐酸和氯化钠溶液,如何区分?
小结: NaCl溶液中有Cl-,而NaCl溶液不能使石蕊溶液变红,那么也不是Cl-的作用;应该是酸中的H+使石蕊溶液变红。
【提示】:氯化钠溶液呈中性
你能否将这种方法推广一下,区别稀硫酸和硫酸钠溶液,为什么?
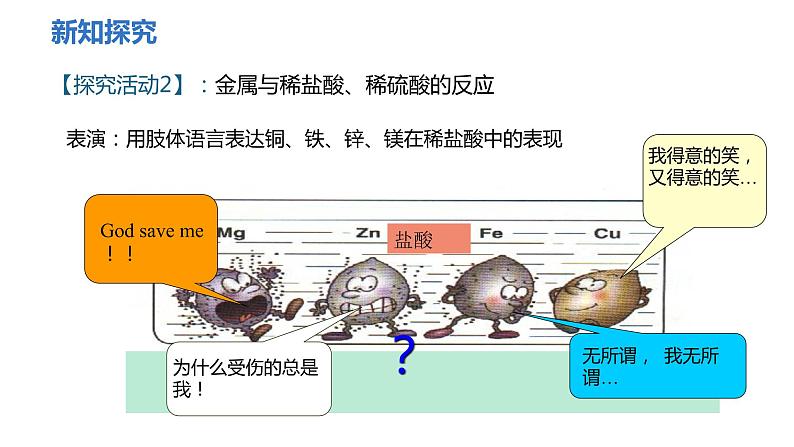
【探究活动2】:金属与稀盐酸、稀硫酸的反应
表演:用肢体语言表达铜、铁、锌、镁在稀盐酸中的表现
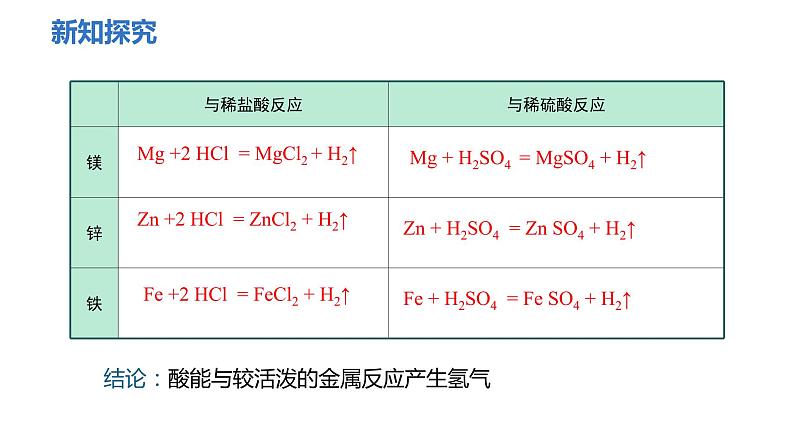
结论:酸能与较活泼的金属反应产生氢气
Mg +2 HCl = MgCl2 + H2↑
Zn +2 HCl = ZnCl2 + H2↑
Zn + H2SO4 = Zn SO4 + H2↑
Mg + H2SO4 = MgSO4 + H2↑
Fe + H2SO4 = Fe SO4 + H2↑
Fe +2 HCl = FeCl2 + H2↑
思考: 硫酸厂有一辆运输过浓硫酸的铁罐车(常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应),某新上岗的工人违反操作规定,边吸烟边用水冲洗该铁罐车,结果发生了爆炸事故。请以该厂技术员的身份分析一下发生爆炸的原因。
如何用化学方法清除铁锈?
【探究活动3】:稀酸与金属氧化物反应
温馨提示:应当实事求是的汇报实验现象,即是实验失败,也可以从失败的实验中得到教训。
小结:当酸不足或适量时,铁锈与酸反应;当酸过量时,与铁锈反应剩余的酸就会继续与铁反应。
从实验、观察、汇报及大家讨论中,你得到什么启示?
稀酸与金属氧化物的反应
Fe2O3+6HCl=2FeCl3+3H2O
铁钉表面的铁锈被除去,溶液变为黄色
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
结论: 酸能与金属氧化物反应
思考:利用酸清除铁锈时,能否将金属制品长时间浸泡在酸中,为什么?
盐酸和硫酸为什么有这些相似的化学性质?
HCl=H++Cl-
H2SO4=2H+ + SO4 2-
HNO3=H++NO3-
电离产生的阳离子均为氢离子(H+)
③稀硫酸、盐酸都能与金属氧化物反应,并生成水
①稀硫酸、稀盐酸都能与指示剂作用
②稀硫酸、稀盐酸都能与活动性较强的金属发生置换反应,放出氢气
1.下列关于酸的说法错误的是( ) A.浓硫酸具有吸水性,浓盐酸具有挥发性 B.稀盐酸和稀硫酸都可用于金属除锈 C.稀盐酸能够使紫色石蕊溶液和无色酚酞溶液都变红色 D.稀硫酸能够与活泼金属反应制取氢气 2.下列物质中,不能用金属跟稀酸反应直接制得的是( ) A.硫酸锌 B.氯化镁 C.氯化铜 D.硫酸铝
3.2.3 g铁和M的混合物与足量盐酸反应,生成0.2 g氢气,则M可能是( ) A.镁 B.铝 C.碳 D.钠4.酸具有相似的化学性质:①能使酸碱指示剂变色;②稀酸能与活泼金属发生_______反应,生成_______,如Mg+_____HCl===_______+______;Zn+H2SO4===________+________;③稀酸能与金属氧化物发生反应,分别写出用稀盐酸、稀硫酸除铁锈的反应的化学方程式: _____________________________________________________________。
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
人教版九年级下册课题1 常见的酸和碱完美版ppt课件: 这是一份人教版九年级下册课题1 常见的酸和碱完美版ppt课件,文件包含第2课时酸的化学性质课件pptx、第2课时酸的化学性质导学案doc、第2课时酸的化学性质教案doc等3份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
人教版九年级下册课题1 常见的酸和碱习题ppt课件: 这是一份人教版九年级下册课题1 常见的酸和碱习题ppt课件,共25页。PPT课件主要包含了不变色,金属化合物,H2↑,H2O,石蕊溶液,Fe2O3等内容,欢迎下载使用。
初中人教版课题1 常见的酸和碱优质习题ppt课件: 这是一份初中人教版课题1 常见的酸和碱优质习题ppt课件,文件包含化学人教版九年级下册第十单元课题1第2课时《酸的化学性质》课件pptx、化学人教版九年级下册第十单元课题1第2课时《酸的化学性质》同步练习docx、化学人教版九年级下册第十单元课题1第2课时《酸的化学性质》教案docx等3份课件配套教学资源,其中PPT共21页, 欢迎下载使用。













