
人教版 (2019)选择性必修1第三节 金属的腐蚀与防护导学案
展开第四章化学反应与电能
第三节金属的腐蚀与防护
1.了解金属发生电化学腐蚀的本质,知道金属腐蚀的危害。
2.了解防止金属腐蚀的措施。
1.通过实验科学探究金属腐蚀的本质及其原因,培养科学探究与创新意识。
2.通过认识金属腐蚀产生的危害和影响,培养科学态度和社会责任意识。
一.金属的电化学腐蚀
1.金属腐蚀:
金属原子失去电子变成金属阳离子,金属发生氧化反应。
2.化学腐蚀和电化学腐蚀:
类型 | 化学腐蚀 | 电化学腐蚀 |
条件 | 金属与接触到的物质直接反应 | 不纯金属接触到电解质溶液发生原电池反应 |
本质 | M-ne-===Mn+ | M-ne-===Mn+ |
现象 | 金属被腐蚀 | 较活泼金属被腐蚀 |
区别 | 无电流产生 | 有微弱电流产生 |
联系 | 电化学腐蚀比化学腐蚀普遍得多,腐蚀速率更快,危害也更严重 | |
3.钢铁的电化学腐蚀:
(1)实质
在钢铁表面形成无数微小原电池
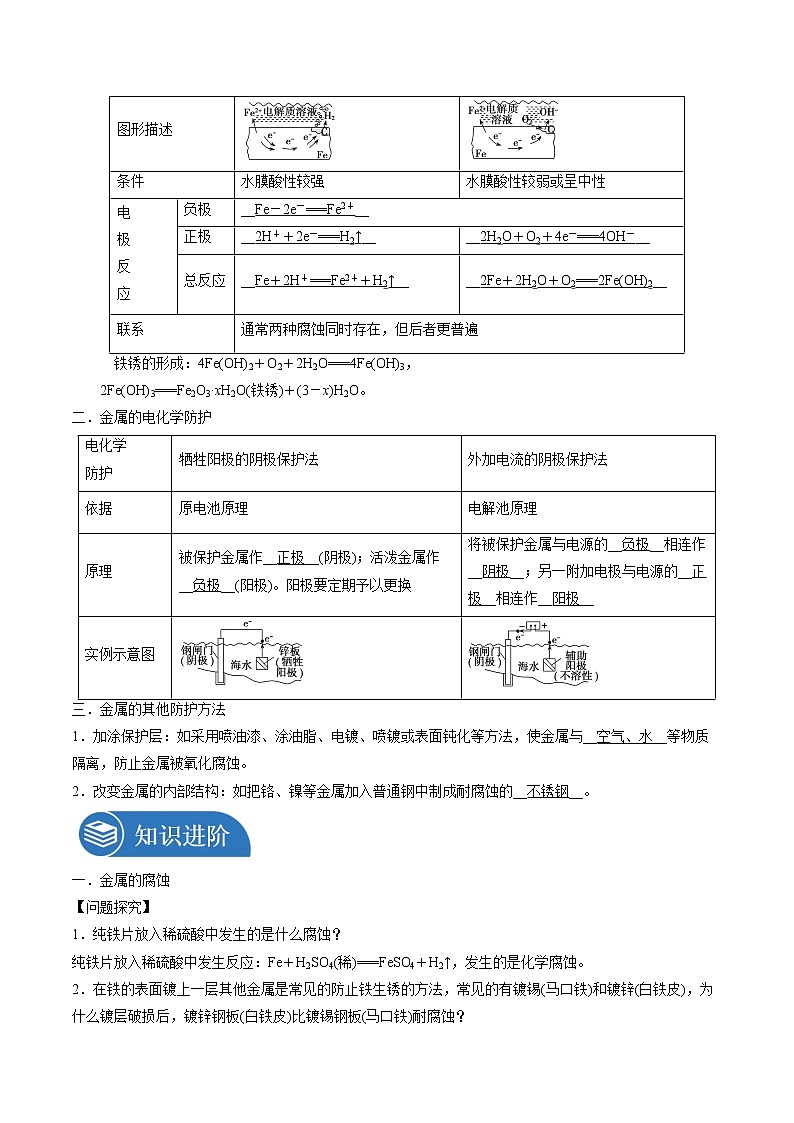
(2)析氢腐蚀和吸氧腐蚀
类别 项目 | 析氢腐蚀 | 吸氧腐蚀 | |
图形描述 | |||
条件 | 水膜酸性较强 | 水膜酸性较弱或呈中性 | |
电 极 反 应 | 负极 | __Fe-2e-===Fe2+__ | |
正极 | __2H++2e-===H2↑__ | __2H2O+O2+4e-===4OH-__ | |
总反应 | __Fe+2H+===Fe2++H2↑__ | __2Fe+2H2O+O2===2Fe(OH)2__ | |
联系 | 通常两种腐蚀同时存在,但后者更普遍 | ||
铁锈的形成:4Fe(OH)2+O2+2H2O===4Fe(OH)3,
2Fe(OH)3===Fe2O3·xH2O(铁锈)+(3-x)H2O。
二.金属的电化学防护
电化学 防护 | 牺牲阳极的阴极保护法 | 外加电流的阴极保护法 |
依据 | 原电池原理 | 电解池原理 |
原理 | 被保护金属作__正极__(阴极);活泼金属作__负极__(阳极)。阳极要定期予以更换 | 将被保护金属与电源的__负极__相连作__阴极__;另一附加电极与电源的__正极__相连作__阳极__ |
实例示意图 |
三.金属的其他防护方法
1.加涂保护层:如采用喷油漆、涂油脂、电镀、喷镀或表面钝化等方法,使金属与__空气、水__等物质隔离,防止金属被氧化腐蚀。
2.改变金属的内部结构:如把铬、镍等金属加入普通钢中制成耐腐蚀的__不锈钢__。
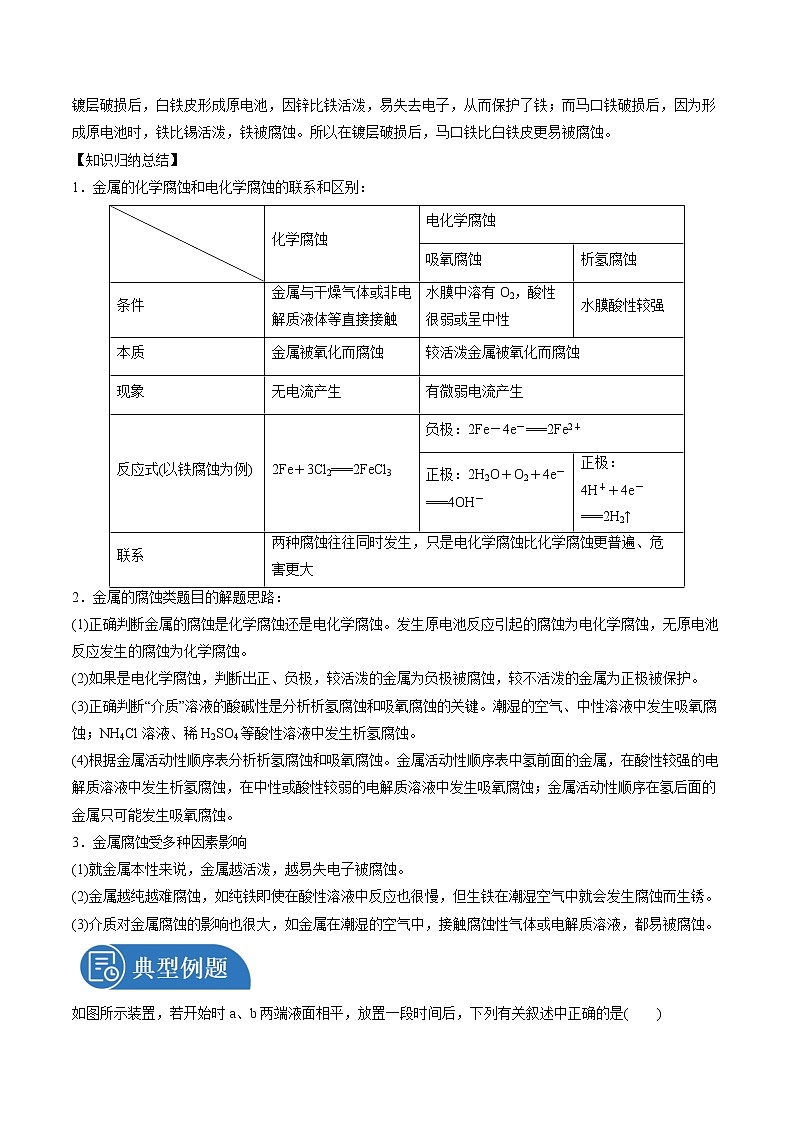
一.金属的腐蚀
【问题探究】
1.纯铁片放入稀硫酸中发生的是什么腐蚀?
纯铁片放入稀硫酸中发生反应:Fe+H2SO4(稀)===FeSO4+H2↑,发生的是化学腐蚀。
2.在铁的表面镀上一层其他金属是常见的防止铁生锈的方法,常见的有镀锡(马口铁)和镀锌(白铁皮),为什么镀层破损后,镀锌钢板(白铁皮)比镀锡钢板(马口铁)耐腐蚀?
镀层破损后,白铁皮形成原电池,因锌比铁活泼,易失去电子,从而保护了铁;而马口铁破损后,因为形成原电池时,铁比锡活泼,铁被腐蚀。所以在镀层破损后,马口铁比白铁皮更易被腐蚀。
【知识归纳总结】
1.金属的化学腐蚀和电化学腐蚀的联系和区别:
| 化学腐蚀 | 电化学腐蚀 | |
吸氧腐蚀 | 析氢腐蚀 | ||
条件 | 金属与干燥气体或非电解质液体等直接接触 | 水膜中溶有O2,酸性很弱或呈中性 | 水膜酸性较强 |
本质 | 金属被氧化而腐蚀 | 较活泼金属被氧化而腐蚀 | |
现象 | 无电流产生 | 有微弱电流产生 | |
反应式(以铁腐蚀为例) | 2Fe+3Cl2===2FeCl3 | 负极:2Fe-4e-===2Fe2+ | |
正极:2H2O+O2+4e-===4OH- | 正极: 4H++4e-===2H2↑ | ||
联系 | 两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀更普遍、危害更大 | ||
2.金属的腐蚀类题目的解题思路:
(1)正确判断金属的腐蚀是化学腐蚀还是电化学腐蚀。发生原电池反应引起的腐蚀为电化学腐蚀,无原电池反应发生的腐蚀为化学腐蚀。
(2)如果是电化学腐蚀,判断出正、负极,较活泼的金属为负极被腐蚀,较不活泼的金属为正极被保护。
(3)正确判断“介质”溶液的酸碱性是分析析氢腐蚀和吸氧腐蚀的关键。潮湿的空气、中性溶液中发生吸氧腐蚀;NH4Cl溶液、稀H2SO4等酸性溶液中发生析氢腐蚀。
(4)根据金属活动性顺序表分析析氢腐蚀和吸氧腐蚀。金属活动性顺序表中氢前面的金属,在酸性较强的电解质溶液中发生析氢腐蚀,在中性或酸性较弱的电解质溶液中发生吸氧腐蚀;金属活动性顺序在氢后面的金属只可能发生吸氧腐蚀。
3.金属腐蚀受多种因素影响
(1)就金属本性来说,金属越活泼,越易失电子被腐蚀。
(2)金属越纯越难腐蚀,如纯铁即使在酸性溶液中反应也很慢,但生铁在潮湿空气中就会发生腐蚀而生锈。
(3)介质对金属腐蚀的影响也很大,如金属在潮湿的空气中,接触腐蚀性气体或电解质溶液,都易被腐蚀。
如图所示装置,若开始时a、b两端液面相平,放置一段时间后,下列有关叙述中正确的是( )
A.铁丝在两处的腐蚀速率:a>b
B.a、b两端相同的电极反应式为Fe-3e-===Fe3+
C.一段时间后,a端液面高于b端液面
D.a处总反应为Fe+2H2O===Fe(OH)2+H2↑
【答案】C
【解析】左边试管中,生铁发生吸氧腐蚀,右边试管中,生铁发生析氢腐蚀。A项,生铁发生析氢腐蚀的速率比吸氧腐蚀的速率大,错误;B项,a处负极上铁失电子,正极上氧气得电子,b处负极上铁失电子,正极上氢离子得电子,所以a、b两处相同的电极反应式为Fe-2e-===Fe2+,错误;C项,a处发生吸氧腐蚀,b处发生析氢腐蚀,一段时间后,a处气体压强减小,b处气体压强增大,导致溶液从b处向a处移动,所以a处液面高于b处液面,正确;D项,a处发生吸氧腐蚀,其总反应为2Fe+O2+2H2O===2Fe(OH)2,错误。
〔变式训练1〕下列说法不正确的是( )
A.钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B.原电池反应是导致金属腐蚀的主要原因,但人们可以利用原电池原理来减缓金属的腐蚀
C.钢铁电化学腐蚀两种类型主要区别在于水膜的酸性不同,正极反应不同
D.无论哪种类型的腐蚀,其实质都是金属被氧化
【答案】A
【解析】不锈钢和铝合金等耐腐蚀,A项错误;金属作原电池正极时被保护,B项正确;水膜酸性较强时,铁主要发生析氢腐蚀,水膜中性或弱酸性时发生吸氧腐蚀,C项正确;金属被腐蚀的实质是金属失电子,被氧化,D项正确。
二.金属的防护
【问题探究】
1.为保护地下钢管不被腐蚀,可采取的电化学保护措施有哪些?
将钢管与锌板相连,或将钢管与直流电源负极相连。
2.铁制品在潮湿的环境中和在干燥环境中哪种环境更易生锈?其原因是什么?
潮湿环境中更易生锈;铁制品中含有杂质碳,在潮湿环境下的电解质溶液中构成原电池,加快了铁被氧化的反应速率。
【知识归纳总结】
1.常见金属的防护措施:
2.金属腐蚀快慢的判断方法:
(1)对同一种金属来说,腐蚀的快慢:强电解质溶液>弱电解质溶液>非电解质溶液。
(2)活动性不同的两金属:活动性差别越大,活动性强的金属腐蚀越快。
(3)对同一种电解质溶液来说:电解质溶液浓度越大,腐蚀越快,且氧化剂的浓度越高,氧化性越强,腐蚀越快。
(4)不同原理引起的腐蚀的速率:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀。
(5)从防腐措施方面分析腐蚀的快慢:外加电流的保护法防腐<牺牲阳极的保护法防腐<有一般防护条件的防腐<无防护条件的防腐。
【易错提醒】 不要因为“阳极”“阴极”而把牺牲阳极的保护法的工作原理当作电解原理。
下列说法不正确的是( )
A.一般来说,不纯的金属与电解质溶液接触时,会发生原电池反应
B.溶液中Fe2+可以用K3[Fe(CN)6]溶液来检测
C.铁锈覆盖在钢铁表面,阻止钢铁继续腐蚀
D.在船身上装锌块来避免船体遭受腐蚀
【答案】C
【解析】不纯的金属,杂质和金属构成原电池的两个电极,与电解质溶液接触时,会发生原电池反应,故A正确;溶液中Fe2+遇到K3[Fe(CN)6]溶液可以产生蓝色沉淀,故B正确;铁锈的结构比较疏松,无法隔绝空气中的水分和氧气,所以无法阻止钢铁继续腐蚀,故C错误;在船身上装锌块,锌比较活泼,先被腐蚀,是利用原电池原理来避免船体遭受腐蚀,故D正确。
据最近报道,中国生产的首艘国产航母已经下水。为保护航母、延长服役寿命可采用两种电化学方法。方法1:舰体镶嵌一些金属块;方法2:航母舰体与电源相连。下列有关说法正确的是( D )
A.方法1叫外加电流的保护法
B.方法2叫牺牲阳极的保护法
C.方法1中金属块可能是锌、锡和铜
D.方法2中舰体连接电源的负极
【答案】D
【解析】舰体上镶嵌活泼性比铁强的金属,如锌,该方法为牺牲阳极保护法,A、C错误;舰体与直流电源的负极相连,该法为外加电流保护法,B错,D正确,故选D。
1.(2021·贵州·高二学业考试)下列不能有效防止钢铁锈蚀的措施是
A.将钢铁与锌板相连 B.将钢铁置于潮湿的空气中
C.在钢铁表面喷油漆 D.将钢铁与直流电源负极相连
【答案】B
【解析】A.由于金属活动性Zn>Fe,所以在钢铁中加入铬制成不锈钢,首先被腐蚀的是活动性强的Zn,Fe就得到了保护,所以能有效防止钢铁腐蚀,A不符合题意;B.钢铁只与潮湿空气中,会加速钢铁生锈,不能有效防止钢铁腐蚀,B符合题意;C.在钢铁表面喷涂油漆,起到隔绝空气和水作用,能有效防止钢铁腐蚀,C不符合题意;D.钢铁与电源的负极相连,钢铁为阴极,外加电流的阴极保护法,钢铁受到保护,D不符合题意;故选B。
2.(2021·云南省玉溪第一中学高二期中)2017年4月26日,中国第一艘国产001A型航母顺利建成下水,有盐分的海水和空气会对船体造成腐蚀,因此船体的防腐处理非常重要。下列关于金属腐蚀和防腐的说法不正确的是
A.可以在船舶外壳装上锌块,用牺牲阳极的阴极保护法防止金属腐蚀
B.海上舰艇的腐蚀主要为金属的析氢腐蚀
C.刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀
D.外加电流,将需要保护的金属做阴极,可以起到保护金属的作用
【答案】B
【解析】A.锌比铁活泼,在船舶外壳装上锌块,形成原电池,锌为负极被氧化,该方法为牺牲阳极的阴极保护法防止金属腐蚀,A正确;B.海水显弱碱性,主要发生吸氧腐蚀,B错误;C.金属被腐蚀的过程即金属被氧气氧化的过程,且有水存在时易发生电化学腐蚀,所以刷防锈漆,使金属与空气、水等物质隔离,可防止金属被腐蚀,C正确;D.电解池中阴极得电子被还原,外加电流,将需要保护的金属做阴极,可以防止金属被氧化,起到保护金属的作用,D正确;综上所述答案为B。
3.(2021·河南南阳·高二期中)将金属M连接在钢铁设施表面构成原电池,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是
A.钢铁设施上的电极反应式为 B.电子流向:金属M→水体→钢铁设施表面
C.M的金属性比Fe的金属性强 D.钢铁设施在河水中的腐蚀速率比在海水中的快
【答案】C
【解析】A.由分析可知,钢铁设施中的铁做正极,水中的氧气在正极发生还原反应,电极反应式为O2+4e—+2H2O=4OH—,故A错误;B.原电池工作时,电子流向为:金属M→导线→钢铁设施表面,故B错误;C.由分析可知,金属M的金属性强于铁,故C正确;D.海水中电解质的浓度高于河水,导电性强于河水,则钢铁设施在海水中的腐蚀速率比在河水中的快,故D错误;故选C。
4.(2021·福建省将乐县第一中学高二月考)如图各容器中均盛有海水,铁在其中被腐蚀时由快到慢的顺序是
A.③②④① B.④②①③ C.②①③④ D.④②③①
【答案】B
【解析】根据图知,②、③装置是原电池,在②中,金属铁做负极,③中金属铁作正极被保护,做负极的腐蚀速率快,所以②>③,④装置是电解池,其中金属铁为阳极,加快腐蚀,腐蚀最快,所以腐蚀速率是:④>②>①>③。故选B。
5.(2021·河南南阳·高二期中)下列与金属腐蚀有关的说法正确的是
A.图a插入海水中的铁棒(含碳量为10.8%)越靠近烧杯底部发生电化学腐蚀就越严重
B.图b开关由N改置于M时,金属铁的腐蚀速率减小
C.图c为牺牲阳极的阴极保护法,钢闸门应与外接电源的负极相连
D.图d在反应过程中能产生氢气
【答案】D
【解析】A.插入海水中的铁棒发生吸氧腐蚀时,接近水面部分氧气的浓度大,腐蚀程度就越严重,故A错误;B.当开关由N改置于M时,金属性强的铁做原电池的负极,腐蚀速率增大,故B错误;C.由图可知,该装置为外加直流电源的保护法,钢闸门应与外接电源的负极相连,故C错误;D.由图可知,铁丝开始阶段铁丝发生吸氧腐蚀,使左侧氧气物质的量减少,压强减小导致液面升高,铁丝与稀硫酸接触后发生析氢腐蚀,会有氢气生成,故D正确;故选D。
6.(2021·山东·菏泽一中高二期中)下列事实不能用原电池原理解释的是
A.白铁(镀锌)制品比一般铁器耐腐蚀
B.铁片、铝片在冷的浓硫酸中钝化
C.工程施工队在铁制水管外刷一层“银粉”
D.纯锌与稀硫酸反应时,滴入少量溶液后反应速率加快
【答案】B
【解析】A.白铁中铁和锌组成原电池,由金属活泼性Zn>Fe,则Fe做正极被保护,所以白铁(镀锌)制品比一般铁器耐腐蚀,A不选;B.铁、铝常温下与冷的浓硫酸反应生成致密的氧化膜而钝化,不能用原电池原理解释,B选;C.铁外刷一层“银粉”,阻止与氧气接触,破坏了原电池的构成条件,保护铁不被腐蚀,C不选;D.锌与少量溶液反应置换单质Cu,形成Zn-Cu原电池,可加快反应速率,D不选;故选:B。
7.(2021·山东·胶州市教育体育局教学研究室高二期中)深埋在潮湿土壤中的铁管道,在硫酸盐还原菌(一种厌氧微生物,适宜pH为7~8)的作用下,能被硫酸根离子腐蚀,原理如图。下列有关说法正确的是
A.腐蚀过程中,土壤酸性逐渐增强
B.输送暖气铁管道温度越高,越易发生此类腐蚀
C.正极反应为
D.管道壁镶嵌锌块或锡块都可保护管道不易被腐蚀
【答案】C
【解析】铁管道腐蚀过程中铁做负极,电极反应式为:Fe-2e-=Fe2+,正极是硫酸根离子发生还原反应,由题意可知为碱性环境,故正极电极反应式为:;【解析】A.由分析知,正极反应生成OH-,土壤酸性逐渐减弱,故A错误;B.正极的腐蚀需要硫酸盐还原菌这种微生物,若温度过高,使微生物失活,则腐蚀程度会减弱,故B错误;C.正极是硫酸根离子发生还原反应,生成硫氢根离子,所以电极反应式为:,故C正确;D.铁比锡活泼,管道壁镶嵌锡块,铁做负极,加快管道腐蚀,故D错误;故选:C。
8.钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)如图装置中,U形管内为红墨水,a、b试管内分别盛有氯化铵溶液(显酸性)和食盐水,各加入生铁块,放置一段时间均被腐蚀。
①红墨水柱两边的液面变为左低右高,则_______(填“a”或“b”)试管内盛有食盐水。
②a试管中铁发生的是_______(填“析氢”或“吸氧”)腐蚀,生铁中碳上发生的电极反应式为_______。
(2)如图两个图都是金属防护的例子。
①为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用_______(填字母),此方法叫做_______保护法。
A.铜B.钠C.锌D.石墨
②图乙方案也可以降低铁闸门腐蚀的速率,其中铁闸门应该连接在直流电源的_______(填“正”或“负”)极。
③以上两种方法中,_______填“甲”或“乙”)方法能使铁闸门保护得更好。
【答案】
(1)b析氢
(2)C牺牲阳极的阴极负乙
【解析】
(1)①红墨水柱两边的液面变为左低右高,则a发生析氢腐蚀,a中盛有氯化铵溶液,b发生吸氧腐蚀,b中盛有食盐水,故答案为b。
②a试管中铁发生的是析氢腐蚀,生铁中碳为正极,正极上发生还原反应,故发生的电极反应式为。b试管中铁发生的是吸氧腐蚀,生铁中碳为正极,发生的电极反应式O2+2H2O+4e-=4OH-;铁为负极,电极反应式为:Fe-2e-=Fe2+。
(2)①为了降低某水库的铁闸门被腐蚀的速率,可以让金属铁做原电池的正极,其中焊接在铁闸门上的固体材料R可以是比金属铁的活泼性强的金属,钠能够与水反应,不能做电极材料,所以选锌,此方法叫做牺牲阳极的阴极保护法,故答案为C;牺牲阳极的阴极;②电解池的阴极上的金属被保护,为降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的负极,故答案为负。
③因为电解池的保护比原电池保护更好,所以方法乙能使铁闸门保护得更好;故答案为乙。
化学人教版 (2019)第三节 金属的腐蚀与防护精品导学案及答案: 这是一份化学人教版 (2019)<a href="/hx/tb_c4002436_t4/?tag_id=42" target="_blank">第三节 金属的腐蚀与防护精品导学案及答案</a>,共2页。学案主要包含了金属的腐蚀,金属的防护等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三节 金属的腐蚀与防护导学案及答案: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002436_t4/?tag_id=42" target="_blank">第三节 金属的腐蚀与防护导学案及答案</a>,共4页。学案主要包含了学习目标,重点难点,学习过程,实验目的,实验用品,实验方案,实验现象,实验结论等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护导学案: 这是一份高中化学人教版 (2019)选择性必修1第四章 化学反应与电能第三节 金属的腐蚀与防护导学案,文件包含思维导图人教版高中化学选修一《43金属的腐蚀与防护》同步学习思维导图+学练解析版docx、思维导图人教版高中化学选修一《43金属的腐蚀与防护》同步学习思维导图+学练学生版docx等2份学案配套教学资源,其中学案共15页, 欢迎下载使用。













