





化学人教版 (2019)第三节 盐类的水解集体备课课件ppt
展开某日上午10点左右,家住某市区的李阿伯与邻居到附近的山上采草药时,不慎被蜜蜂蜇伤,当时他并未在意。回家后李阿伯感到伤处疼痛加重、呼吸困难、意识不清,家人急忙拨打急救电话,经医生对症处理,李阿伯已脱离危险。请问这次险情是什么原因造成的呢?当黄蜂或蜜蜂叮咬后应如何利用家庭常用的物质加以处理?你知道纯碱水溶液为什么显碱性吗?
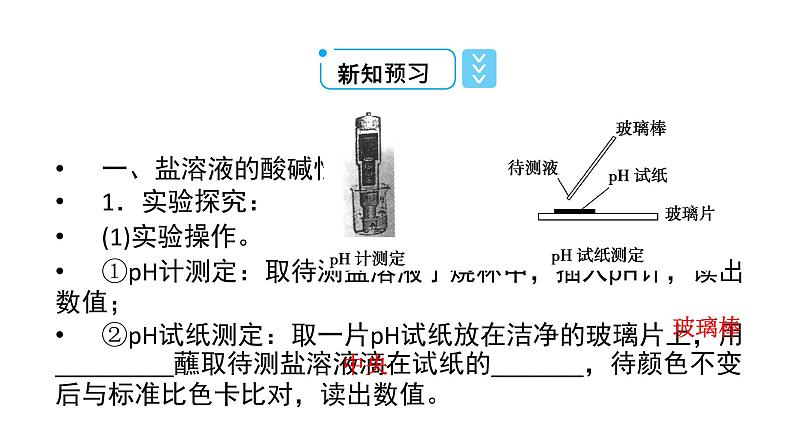
一、盐溶液的酸碱性1.实验探究:(1)实验操作。①pH计测定:取待测盐溶液于烧杯中,插入pH计,读出数值;②pH试纸测定:取一片pH试纸放在洁净的玻璃片上,用_________蘸取待测盐溶液滴在试纸的_______,待颜色不变后与标准比色卡比对,读出数值。
2.实验结论:(1)强酸强碱盐的水溶液显中性;(2)强碱弱酸盐的水溶液显_____性;(3)强酸弱碱盐的水溶液显_____性。
3.盐溶液呈现不同酸碱性的原因:(1)以NH4Cl溶液为例:
CH3COO-+Na+
4.结论(1)当强酸弱碱盐溶于水时,盐电离产生的_____离子与水电离出的_______结合生成_______,使溶液中的c(H+)_____c(OH-),溶液呈_____性。(2)当强碱弱酸盐溶于水时,盐电离产生的_____离子与水电离出的______结合生成_______,使溶液中的c(OH-)_____c(H+),溶液呈_____性。(3)当强酸强碱盐溶于水时,盐电离产生的阴离子、阳离子都不能与水电离出的H+或OH-结合生成弱电解质,即强酸强碱盐_________,溶液中的c(OH-)_____c(H+),溶液呈_____性。
二、盐类水解1.概念:在水溶液中盐电离产生的_______与水电离产生的_____离子或_________离子结合生成弱电解质的反应。2.条件(1)盐必须溶于水中。(2)盐中必须有弱酸根阴离子或弱碱阳离子(有弱才水解,都强不水解)。
4.水解规律:(1)强酸弱碱盐:电离产生的_____离子发生水解,使c(H+) _____c(OH-),溶液显_____性。(2)强碱弱酸盐:电离产生的_____离子发生水解,使c(H+) _____c(OH-),溶液显_____性。
4.纯碱和小苏打是日常生活中的必需品,是食品制作中的必需添加剂。两者的溶液都显碱性。25 ℃时,浓度均为0.2 ml·L-1的NaHCO3与Na2CO3溶液中,下列判断不正确的是( )A.均存在电离平衡和水解平衡B.存在的粒子种类相同C.c(OH-)前者大于后者D.Na2CO3溶液中水的电离程度更大
问题探究:1.pH均为4的H2SO4溶液和NH4Cl溶液中,水电离出的c(H+)相等吗?2.某盐溶液显中性,该盐一定是强酸强碱盐吗?3.等浓度的醋酸钠的pH小于次氯酸钠溶液的pH,由此能否确定醋酸与次氯酸的酸性强弱?
探究提示:1.不相等。H2SO4抑制水的电离,NH4Cl能水解,促进水的电离,所以NH4Cl溶液中水的电离程度大。2.不一定。也可能是弱酸弱碱盐,如CH3COONH4溶液显中性。3.由“越弱越水解”可知,等浓度的醋酸钠的水解程度小于次氯酸钠溶液的水解程度,由此确定醋酸的酸性大于次氯酸。
3.盐类水解的规律:(1)“有弱才水解,无弱不水解”——盐中有弱酸阴离子或弱碱阳离子才水解,若没有,则是强酸强碱盐,不发生水解反应。
(2)“越弱越水解”——弱酸阴离子对应的酸越弱,水解程度越大;弱碱阳离子对应的碱越弱,其水解程度越大。如:碳酸的酸性大于次氯酸,则相同浓度的NaHCO3溶液的水解程度小于NaClO溶液。(3)“都弱都水解”——弱酸弱碱盐电离出的弱酸阴离子和弱碱阳离子都发生水解,且相互促进。(4)“谁强显谁性”——当盐中的阴离子对应的酸比阳离子对应的碱更容易电离时,水解后盐溶液呈酸性,反之,呈碱性,即强酸弱碱盐显酸性,强碱弱酸盐显碱性。如:碳酸的电离常数Ka1小于NH3·H2O的电离常数Kb,故NH4HCO3溶液显碱性。
(5)“同强显中性”——①强酸强碱盐溶液显中性;②盐中的阳离子对应的碱的电离常数Kb与盐中的阴离子对应的酸的电离常数Ka相等时,盐溶液显中性。如Kb(NH3·H2O)=Ka(CH3COOH),故CH3COONH4溶液显中性。
25 ℃时浓度都是1 ml·L-1的四种正盐溶液:AX、BX、AY、BY;AX的溶液pH=7且溶液中c(X-)=1 ml·L-1,BX的溶液pH=4,BY的溶液pH=6。下列说法正确的是( )A.电离平衡常数K(BOH)小于K(HY)B.AY溶液的pH小于BY溶液的pHC.稀释相同倍数,溶液pH变化BX等于BYD.将浓度均为1 ml·L-1的HX和HY溶液分别稀释10倍后,HX溶液的pH大于HY
解析:A项,根据BY溶液的pH=6,B+比Y-更易水解,则BOH比HY更难电离,因此电离平衡常数K(BOH)小于K(HY);B项,根据AX、BX、BY溶液的pH,则AX为强酸强碱盐,BX为强酸弱碱盐,BY为弱酸弱碱盐,则AY为弱酸强碱盐,溶液的pH>7,故AY溶液的pH大于BY溶液的pH;C项,稀释相同倍数,BX、BY溶液的pH均增大,且BX溶液的pH变化大于BY溶液;D项,HX为强酸,HY为弱酸,浓度相同时,稀释10倍后,HY的电离程度增大,但仍不可能全部电离,故HX溶液的酸性强,pH小。
〔变式训练1〕盐MN溶于水存在如下过程:下列有关说法中不正确的是( )A.MN是强电解质B.总反应离子方程式为N-+H2O══OH-+HNC.该过程使溶液中的c(OH-)>c(H+)D.MOH为强碱
知识归纳总结:1.盐类水解离子方程式的书写:
如何计算醋酸溶液中的c(H+)和c(OH-)在CH3COOH溶液中同时存在水的电离平衡,其中醋酸的电离能力远强于水的电离能力。醋酸电离出较多的H+,促使水的电离平衡向结合成水分子的方向移动,抑制了水的电离,因此CH3COOH溶液中绝大部分的H+是由醋酸电离产生的,由水电离产生的H+极少。当然,溶液中还存在着极少量由水电离产生的OH-。
高中化学人教版 (2019)选择性必修1第三节 盐类的水解课前预习ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解课前预习ppt课件,共35页。
化学选择性必修1第三节 盐类的水解精品课件ppt: 这是一份化学选择性必修1第三节 盐类的水解精品课件ppt,共15页。PPT课件主要包含了CH3COOH,溶液显碱性,离子方程式,理论分析,NH3·H2O,溶液显酸性,盐类的水解,促进水的电离,生成弱电解质,NH4Cl等内容,欢迎下载使用。
化学选择性必修1第三节 盐类的水解多媒体教学ppt课件: 这是一份化学选择性必修1第三节 盐类的水解多媒体教学ppt课件,文件包含选择性必修1第三章第三节第1课时盐类的水解-教学课件pptx、选择性必修1第三章第三节第1课时盐类的水解-教学设计docx、选择性必修1第三章第三节第1课时盐类的水解-学案docx、选择性必修1第三章第三节第1课时盐类的水解-作业设计docx等4份课件配套教学资源,其中PPT共18页, 欢迎下载使用。













