



高中人教版 (2019)第二节 元素周期律说课ppt课件
展开碱金属元素:化学性质非常活泼的金属。
大家知道什么是金属性,什么是非金属性么?
金属性:元素的原子失去电子的能力;非金属性:元素的原子得电子的能力。
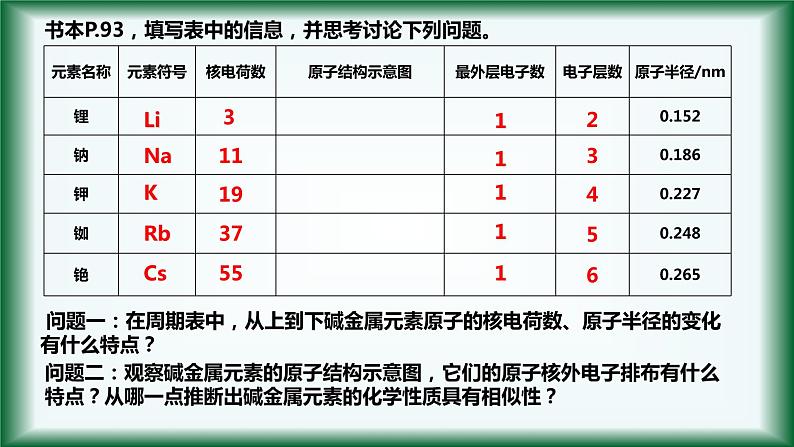
问题一:在周期表中,从上到下碱金属元素原子的核电荷数、原子半径的变化有什么特点?
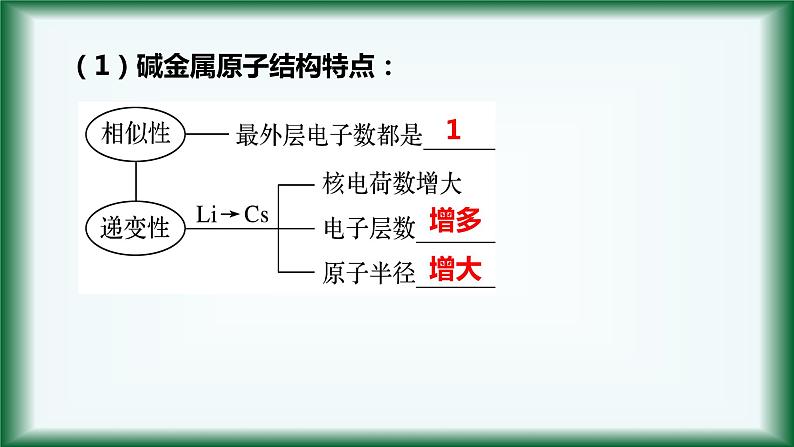
(1)碱金属原子结构特点:
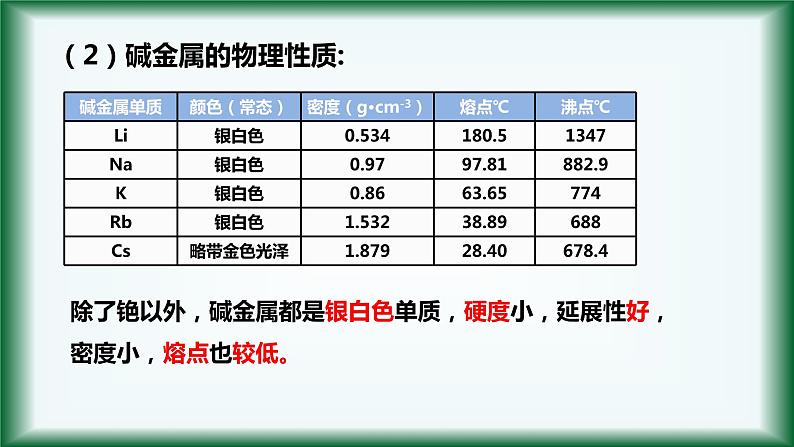
(2)碱金属的物理性质:
除了铯以外,碱金属都是银白色单质,硬度小,延展性好,密度小,熔点也较低。
⑶碱金属单质的化学性质
实验现象:都能在空气中燃烧,钠产生黄色火焰,钾产生紫色火焰,钾燃烧更剧烈反应
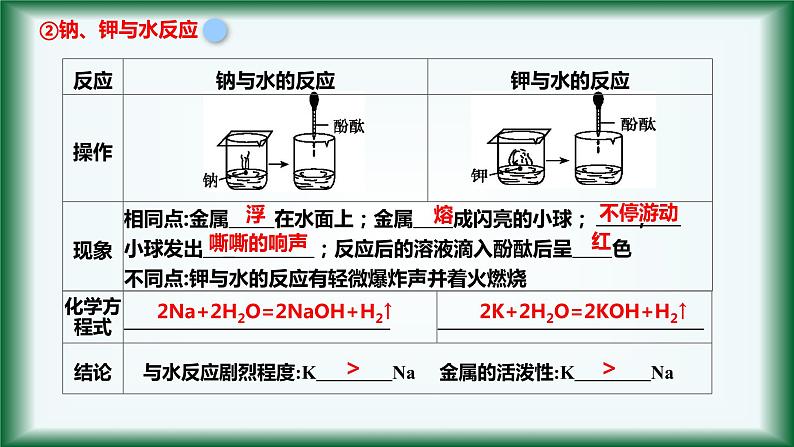
化学方程式:实验结论:金属的活泼性K>Na
2Na+2H2O=2NaOH+H2↑
2K+2H2O=2KOH+H2↑
碱金属化学性质的相似性与递变性:
K、Rb等碱金属与O2反应,会生成超氧化物。Rb、Cs在室温时,遇到空气会立即燃烧。
小结:从Li→Cs,与氧气反应越来越剧烈。
小结:从Li→Cs,与H2O(或酸)反应越来越剧烈。
按照锂、钠、钾、铷、铯的顺序从上到下:核电荷数电子层数原子半径原子失去电子能力 元素的金属性
从碱金属与水反应的现象来看,你认为ⅠA族元素(氢元素除外)金属性强弱变化有什么规律?
金 属 性 逐 渐 增 强
⑴认识卤族元素原子的结构
⑵卤族元素单质的物理性质
卤素原子,随着相对分子质量的增大,单质颜色变深,熔点、沸点、密度依次递增。
①卤素单质与氢气的反应
随着核电荷数的增多,与氢气反应越来越困难
氢化物的稳定性越来越弱
①与氢气反应的难易程度:
②生成的氢化物的稳定性:
③卤素的非金属性强弱:
非金属性的强弱判断依据
表5-7 探究卤素非金属性的强弱
静置后,液体分层,上层接近无色,下层呈______色
Cl2+2NaBr=== 2NaCl+Br2
Cl2+2KI=== 2KCl+I2
Br2+2KI=== 2KBr+I2
卤素单质的氧化性强弱顺序:卤素非金属性强弱变化规律:
因为F2能与H2O发生反应(2F2+2H2O===4HF+O2),所以F2不能从其他卤化物的盐溶液中置换出卤素单质。
非金 属 性 逐 渐 减弱
金非属金性属逐性渐逐增渐强减 弱
→ 最外层电子数相同,电子层数增多
→ 失电子能力逐渐增强
→ 元素的金属性逐渐增强
同周期、同主族元素的递变规律
金属性减弱非金属性增强
还原性减弱,氧化性增强
非金属性减弱金属性增强
氧化性减弱,还原性增强
元素周期表中元素金属性和非金属性的递变
元素周期表是元素周期律的具体表现形式。通过元素在周期表中的相对位置,判断元素的性质特点,为化学研究提供方便。
金属性最强的元素(不包括放射性元素)是 ;最活泼的非金属元素是 ;最高价氧化物对应水化物的酸性最强的元素是 最高价氧化物对应水化物的碱性最强的元素(不包括放射性元素)是 。
1.元素周期表的左下方是金属性最强的元素(钫),右上方是非金属性最强的元素(氟)。碱性最强的是FrOH,酸性最强的含氧酸是HClO4。2.由于元素的金属性和非金属性之间没有严格的界线,因此,位于分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性。
1.根据同周期、同主族元素性质的递变规律判断元素性质的______。2.元素“ — — ”的推断,推测原子结构,预测元素性质3.寻找新材料和稀有矿产4.制备特定性质的新物质(1)在金属与非金属分界线附近寻找 材料。(2)研究 附近元素,制造新农药。(3)在 中寻找催化剂和耐高温、耐腐蚀的合金材料。
元素“位—构—性”的关系及应用
1.下列各组顺序排列不正确的是( ) A.酸性强弱:H2SiO3<H3PO4<H2SO4 B.热稳定性:HCl>H2S>PH3 C.原子半径:Na<Mg<Al D.碱性强弱:NaOH>Mg(OH)2>Al(OH)3
2.下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题。(1)10种元素中,化学性质最不活泼的元素是 (填元素符号,下同),金属性最强的元素是______________(2)元素③、 ⑧分别形成的气态氢化物的稳定性:③_______⑧ (用“>”或“<”表示)
(3)④⑤⑥三种元素的原子半径由大到小的顺序为_______________(4)10种元素中,有一种元素的最高价氧化物的水化物呈两性,写出其最高价氧化物的水化物的化学式_________________(5)⑧和⑨元素的最高价氧化物对应的水化物中,酸性由强到弱的顺序排列为 (填化学式)
HClO4>H2SiO3
3. X、Y、Z均为短周期主族元素,在元素周期表中它们的相对位置如下图。已知3种元素的原子序数之和为34。下列有关叙述中,正确的是 A.X元素为O B.原子半径大小为Z>Y>X C.Y的氧化物具有两性 D.Z的最高价氧化物对应水化物是一种强酸
a + 6 + a + 7 + a = 34
X:N Y:Al Z:Si
化学第二节 元素周期律图文课件ppt: 这是一份化学第二节 元素周期律图文课件ppt,共11页。PPT课件主要包含了浅黄绿,Cl2Br2I2,I-Br-Cl-,ClBrI,不变色,不反应,白色沉淀,Mg2++2OH-,══MgOH2↓,非金属性等内容,欢迎下载使用。
高中化学第二节 元素周期律教课内容课件ppt: 这是一份高中化学第二节 元素周期律教课内容课件ppt,共45页。PPT课件主要包含了新课情境呈现,课前素能奠基,铝Al,硅Si,第三周期第ⅣA族,元素周期表,元素周期律,内在联系,非金属,金属性等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 元素周期律课文课件ppt: 这是一份高中化学人教版 (2019)必修 第一册第二节 元素周期律课文课件ppt,共58页。PPT课件主要包含了新课情境呈现,课前素能奠基,ClBrI,Na2O,Na2O2,点燃或光照,失去电子,金属性,得到电子,非金属性等内容,欢迎下载使用。













