








高中化学第五章 化工生产中的重要非金属元素第二节 氮及其化合物授课课件ppt
展开玻尔巧藏诺贝尔金质奖章 玻尔是丹麦的物理学家,曾获得诺贝尔奖。二战中,玻尔被迫离开祖国,他决定将诺贝尔金质奖章溶解在一种溶液里,装于玻璃瓶中。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。新铸成的奖章---它凝聚着玻尔对祖国无限的热爱和无穷的智慧。
这种溶液是什么????
①纯硝酸是无色、易挥发、有刺激性气味的液体。
②能以任意比溶于水;③密度比水大,(1.5027g/cm3);④沸点低:83℃;⑤常用浓硝酸的浓度为69%,98%的浓硝酸叫作“发烟硝酸”。
问题一:久置的浓硝酸为何呈黄色?
问题二:如何保存硝酸?
盛放在棕色试剂瓶里,并贮放在黑暗且温度低的地方
硝酸分解生成的NO2溶于硝酸中
硝酸具有强氧化性,对皮肤、衣物等有腐蚀作用,使用时应注意安全。
(3)硝酸具有强的氧化性 几乎可以使所有金属(金、铂 除外)氧化而生成硝酸盐。当HNO3与金属反应时,HNO3被还原的程度(即氮元素化合价降低的程度)取决于硝酸的浓度和金属单质还原性的强弱。
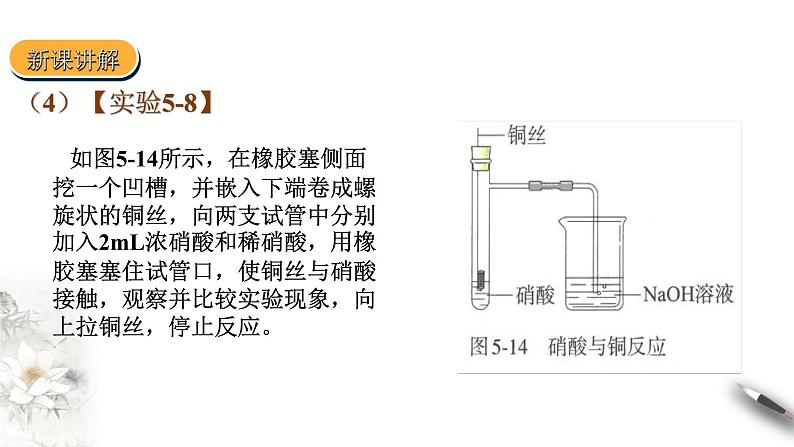
如图5-14所示,在橡胶塞侧面挖一个凹槽,并嵌入下端卷成螺旋状的铜丝,向两支试管中分别加入2mL浓硝酸和稀硝酸,用橡胶塞塞住试管口,使铜丝与硝酸接触,观察并比较实验现象,向上拉铜丝,停止反应。
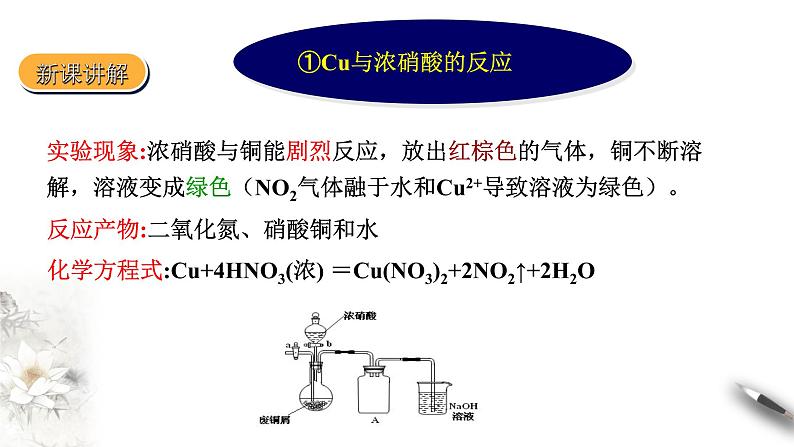
实验现象:浓硝酸与铜能剧烈反应,放出红棕色的气体,铜不断溶解,溶液变成绿色(NO2气体融于水和Cu2+导致溶液为绿色)。
反应产物:二氧化氮、硝酸铜和水
化学方程式:Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O
实验现象:铜与稀硝酸反应较缓慢,溶液 变成蓝色(Cu2+),生成无色的气体,遇空气变为红棕色。
反应产物:硝酸铜、一氧化氮、水
化学方程式:3Cu+8HNO3(稀)= 3Cu(NO3)2+ 2NO↑+4H2O
①在上述的两个反应中硝酸都表现出哪些性质。
②上述两反应中,若有1mlCu消耗,则被还原的硝酸的物质的量分别是多少?
③写出上述两反应的离子反应方程式
Cu+4H++2NO3- =Cu2++2NO2↑+2H2O
3Cu+8H++2NO3-= 3Cu2++ 2NO↑+4H2O
① 常温下,浓硝酸使铁、铝等金属钝化(加热时也会发生反应)
②硝酸与金属反应不放出氢气。
③氧化性:浓硝酸>稀硝酸(均比浓硫酸强)
④一般反应规律为: 金属 + HNO3(浓) → 硝酸盐 + NO2↑ + H2O 金属 + HNO3(稀) → 硝酸盐 + NO↑ + H2O较活泼的金属(如Mg、Zn等) + HNO3(极稀) → 硝酸盐 + H2O + N2O↑(或NH3或铵盐等)
⑤变价金属与硝酸反应时3Fe(过量)+8HNO3(稀)=3Fe(NO3)2+2NO↑+4H2OFe(不足)+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O
⑥浓HNO3与浓盐酸按体积比1∶3配制而成的混合液叫王水。王水溶解金属的能力更强,能溶解金属Pt、Au。记忆方法 :“三言(盐)一笑(硝)”
⑦NO3_的检验:晶体或浓溶液与浓硫酸、Cu共热时,若产生红棕色气体则含有NO3_ ;若为稀溶液则先浓缩后再检验。
将一块红热的木炭投入浓硝酸中
现象:剧烈反应,产生红棕色气体
硝酸:是一元酸、强酸、氧化性酸、低沸点酸、不稳定 性酸、易溶性酸。
硝酸是重要的化工原料,用于制话费、农药、炸药、燃料等。工业上制硝酸的原理是将氨经过一系列反应得到硝酸,如下图所示:
(1)写出每一步反应的化学方程式。
(2)请分析上述反应中的物质类别和氮元素化合价的变化情况,以 及每一步反应中含氮物质发生的是氧化反应还是还原反应。
1.硝酸的工业制法-氨的催化氧化法
(2)氨氧化生成一氧化氮------氧化炉
(1)N2和H2反应生成氨气
(3) 一氧化氮的氧化和硝酸的生成-----吸收塔
2NO + O2 = 2NO2(循环使用)N的化合价由+2变为+4,发生氧化反应
(4)NO2和水反应生成硝酸
3NO2+H2O=2HNO3+NO 氮的化合价由+4变为+5和+2价,既发生氧化反应也发生还原反应。
想一想:尾气包括哪些气体?怎样处理?写出有关反应的化学方程式。
NO2 + NO+ 2NaOH = 2NaNO2 + H2O
尾气中包含NO2和NO气体,所以需要用氢氧化钠溶液来吸收尾气
思考1:温度如何控制?
温度不能太高,否则硝酸会分解。故生成物是NaHSO4 。
思考2:能否采用制氯化氢的装置制硝酸?
如图,不能,因硝酸蒸汽腐蚀橡胶塞和胶管。
(3)HNO3实验室制法
煤、石油和金属矿物以及机动车在使用过程中,会生成SO2和氮氧化物。他们会引起呼吸道疾病,危害人体健康,甚至致人死亡。
SO2以及氮氧化物在大气中会形成酸雨,正常雨水由于溶解了CO2,pH约为5.6,酸雨的pH小于5.6
酸雨危害很大,能直接损伤农作物,破坏森林和草原,使土壤、湖泊算话,加速建筑物、桥梁、手工业设备、运输工具和电缆的腐蚀。
SO2和NO2都是有用的化工原料,但当他们分散在大气中时,就形成了难以处理的污染物。因此,工业废气排放到大气中之前,必须进行适当处理,防治有害物质污染大气,并充分利用原料。
四、阅读课本的研究与实践--------测定雨水的pH
研究目的:酸雨对环境危害巨大,人们已经采取多种措施来防治酸雨。通过以下活动了解测定雨水pH的方法,认识酸雨的危害,激发保护环境的紧迫感。
研究任务:收集资料并测定雨水的pH.
【结果与讨论】(1)通过测定数据判断降雨是否为酸雨。若是酸雨,分析形成原因,并提出减轻酸雨危害的建议。(2)本次实践活动及结果对你有什么启发?撰写研究报告,并与同学讨论。
1.下列关于N2的叙述错误的是( )
A.N2既可作氧化剂又可作还原剂B.在雷雨天,空气中的N2和O2可反映生成NOC.氮的固定是将N2转化成含氮的化合物D.1mlN2可与3mlH2完全反应生成2mlNH3
解析:N2和H2生成氨气的反应时可逆反应,不能完全转化
2.在NO2与水的反应中( )
A.氮元素的化合价不发生变化 B.NO2只是氧化剂C.NO2只是还原剂 D.NO2既是氧化剂,有事还原剂
解析:3NO2+H2O=2HNO3+NO,反应中NO2的化合价由+4价变为+5和+2价既是氧化剂又是还原剂。
3.只用一种试剂可将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区别开来的是( ) A. NaOH溶液 B. AgNO3溶液 C. BaCl2溶液 D. Ba(OH)2溶液
A.氯化铵、硫酸铵均与NaOH反应生成氨气,氯化钠、硫酸钠均与NaOH不反应,不能鉴别;B.均与硝酸银反应生成白色沉淀,不能鉴别;C.硫酸铵、硫酸钠均与氯化钡反应生成白色沉淀,氯化铵、氯化钠均与氯化钡不反应,不能鉴别;D.氯化铵、硫酸铵、氯化钠、硫酸钠四种溶液分别与Ba(OH)2溶液反应的现象为:刺激性气体、白色沉淀和刺激性气体、无现象、白色沉淀,现象不同,可鉴别;
4.根据图5-11“氨溶于水的喷泉实验装置”,下列叙述不正确的是( ) A.该实验说明氨气极易溶于水 B.烧瓶充满氯气,交投滴管和烧瓶中充满浓碱也可能形成喷泉 C.红色喷泉说明氨水有碱性 D.烧杯中换成其他液体无法形成喷泉
解析:喷泉反应的原理是可以快速溶解或者反应形成压强差,所以换成其他液体也可以。
5.工业上用废铜屑作原料制备硝酸铜,下列四种方法中,适宜采用的是哪一种,请从节约原料和污染保护的角度说明原因。A.Cu + HNO3(浓) → Cu(NO3)2B.Cu +HNO3(稀) → Cu(NO3)2C.Cu → CuO → Cu(NO3)2D.Cu → CuSO4 → Cu(NO3)2
浓H2SO4 △
解析:根据反应的方程式可知,选项ABD中都能产生大气污染物NO2、NO、SO2,C中没有污染物产生,且原料利用率高,所以正确的答案选C
6.利用图5-14进行铜与硝酸反应的实验
(1)硝酸一般成放在棕色试剂瓶中,请用化学方程式说明其原因______。
(2)使用稀硝酸进行实验:反应开始后,铜丝逐渐变细,有气泡产生,溶液变蓝。 ①铜与稀硝酸反应的离子方程式为__________________。 ②实验中观察到试管中的气体略有红棕色,其原因是________(用化学方程式表示)
(2)①3Cu+8H++2NO3-= 3Cu2++ 2NO↑+4H2O②2NO + O2 = 2NO2
(3)使用浓硝酸进行实验:反应剧烈进行,铜丝逐渐变细,溶液标绿,试管上方出现红棕色气体。①铜与浓硝酸反应的化学方程式为_____________________.②某同学推测反应后溶液呈绿色的原因是NO2在溶液中达到饱和,NO2的饱和溶液呈黄色,硝酸铜溶液呈蓝色,两者混合后呈绿色。他取少量该绿色溶液,向其中加入适量水后溶液为蓝色,可能原因是______________________(用化学方程式表示)。
(3)①Cu+4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O ②3NO2+H2O=2HNO3+NO
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优秀课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优秀课件ppt,共60页。PPT课件主要包含了第二节氮及其化合物,第3课时硝酸,硝酸的性质,酸雨及防治,微判断,尝试解答,微训练,研习1硝酸的性质,课时作业六硝酸等内容,欢迎下载使用。
化学必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物完整版课件ppt: 这是一份化学必修 第二册第五章 化工生产中的重要非金属元素第二节 氮及其化合物完整版课件ppt,共60页。PPT课件主要包含了第二节氮及其化合物,第2课时氨和铵盐等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优秀课件ppt: 这是一份高中化学人教版 (2019)必修 第二册第二节 氮及其化合物优秀课件ppt,共60页。PPT课件主要包含了第二节氮及其化合物,氮气与氮的固定,微判断,尝试解答,微训练等内容,欢迎下载使用。













