




人教版九年级下册实验活动8 粗盐中难溶性杂质的去除一等奖ppt课件
展开技巧点拨:除杂的原则是“不增、不减、易分离”。即:除杂试剂与杂质反应后不能生成新的杂质,且除杂试剂不能与被提纯物反应;加入的除杂试剂应适量,若过量,则在后续实验操作中应将过量的除杂试剂除去。
【师生活动】请完成下列除杂的操作方法和反应的化学方程式(括号内的为杂质)NaOH溶液(Na2CO3): Cu(CuO):
加入适量的Ca(OH)2溶液、过滤
加入足量稀盐酸或稀硫酸、过滤
■考点一 物质的除杂
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
CuO+H2SO4=CuSO4+H2↑
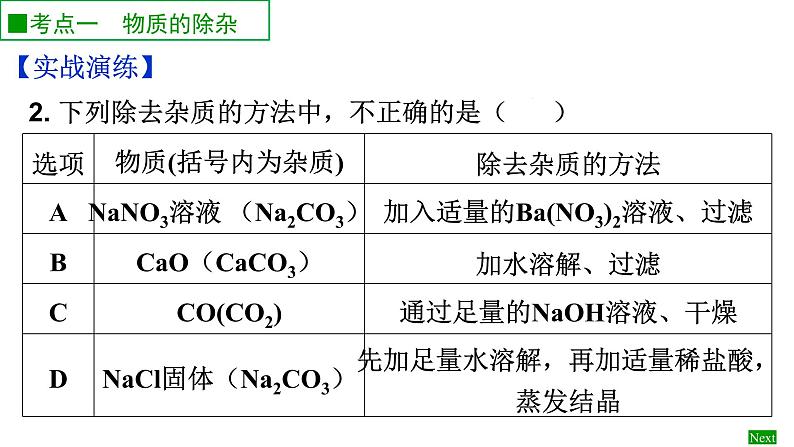
【实战演练】1.除去下列物质中的杂质(括号内为杂质),所选用的试剂与方法正确的是( )A.NaCl(MgCl2):加入过量的氢氧化钠溶液 B.CO2(HCl):通过饱和NaHCO3溶液洗气C.NaCl固体((沙子):溶于水、过滤、洗涤、干燥 D.KNO3溶液(K2SO4)加入适量的Ba(NO3)2溶液,过滤
K2SO4 + Ba(NO3)2= 2KNO3+ BaSO4↓
2. 下列除去杂质的方法中,不正确的是( )
【活动与探究】 粗盐提纯
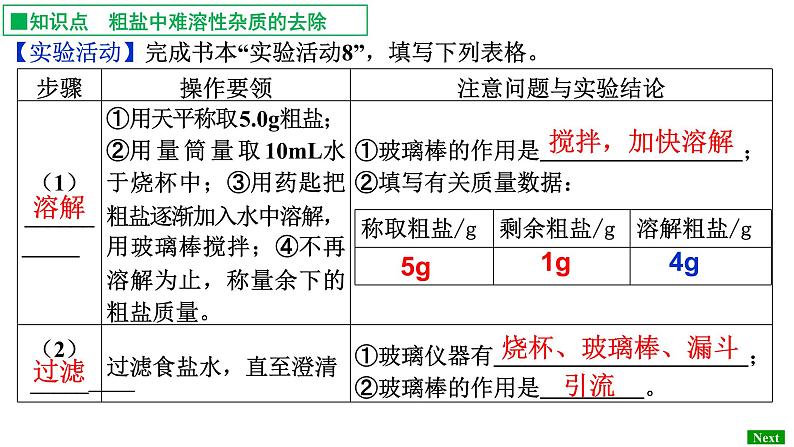
1、讨论: ① 粗盐中含有较多的不溶性杂质(泥沙等)和可溶性杂质(MgCl2、CaCl2等)。可通过哪些步骤可除去不溶性杂质?
溶解、过滤、蒸发、计算产率
② 过滤器准备和过滤操作应注意哪些问题?
本实验用到的主要仪器有哪些?
溶解:天平、烧杯、量筒、玻璃棒过滤:漏斗、烧杯、铁架台、玻璃棒蒸发:蒸发皿、铁架台、酒精灯、玻璃棒
注意:总共有3次用到玻璃棒,它们的作用分别是?
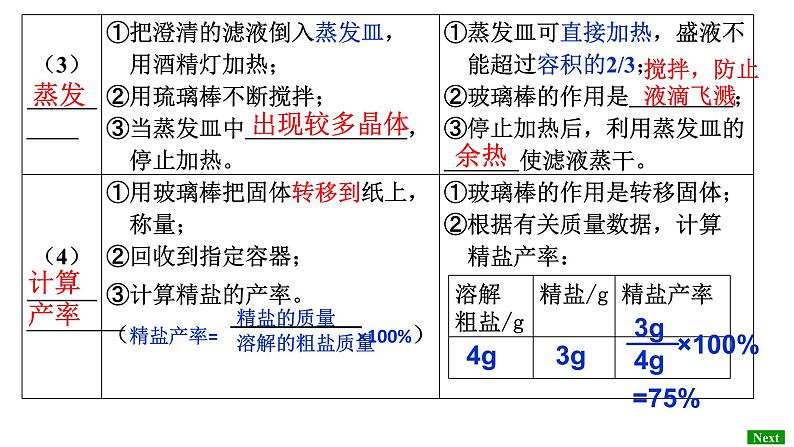
【实验活动】完成书本“实验活动8”,填写下列表格。
■知识点 粗盐中难溶性杂质的去除
【问题讨论】在进行粗盐提纯实验时,影响产率的原因分析正确的是(填序号): 导致产率偏低的原因分析 ; 导致产率偏高的原因分析 。 ①加水溶解时,粗盐没有都溶解 ②溶解含泥沙的粗盐时,加入的水量多 ③过滤时滤纸有破损 ④过滤时没用玻璃棒引流,有滤液溢出 ⑤转移精盐时,蒸发皿中有残留的固体 ⑥蒸发后,精盐中有较多的水分 ⑦蒸发时有固体溅出 ⑧蒸发皿、玻璃棒上等残留精盐
◆实战演练◆1.如图是同学们做的除去粗盐中难溶性杂质的实验操作示意图。
(1)操作③中用玻璃棒搅拌的作用是 ;溶解粗盐时 所加水的质量不宜过多,也不宜过少,过少会造成精盐的产率 (填“偏高”或“偏低”)。(2)操作⑤中托盘两边各放一张大小相同的纸片,其作用是 ;在放置粗盐到托盘上后,发现天平指针 偏右,接着的操作是 。(3)操作⑥中的错误是 。
向左盘中继续加粗盐,直至天平平衡
(4)粗盐提纯实验的操作顺序为 (填操作序号), 称量精盐并计算产率。步骤⑤中称取5.0g粗盐,将该粗盐逐渐加入 盛有10mL水的烧杯中,边加边用玻璃棒搅拌,直到粗盐不再溶解 为止,称得剩余粗盐为0.5g,最终得到NaCl晶体3.6g,该实验精盐 的产率是 。
① ⑤ ② ③ ⑥ ④
同学们,经过刚刚溶解、过滤、蒸发之后得到的盐是纯净物吗?
■知识点 粗盐中可溶性杂质的去除
如果不是纯净物,还有哪些杂质呢?那如何将这些杂质除去呢?
例题:某食盐样品中含有少量泥沙、CaCl2和MgCl2,以下是除去该样品中沙土、CaCl2和MgCl2的实验流程:
(1)操作Ⅰ、Ⅱ、Ⅲ的名称是 ,该步骤要使用到的玻璃仪器 是:烧杯、玻璃棒、 。(2)加入过量的NaOH溶液的目的是 ,加入过量的Na2CO3 溶液的目的是 ,加入适量稀盐酸目的是 。 (3)写出NaOH与杂质反应化学方程式 。 (4)沉淀Ⅱ的化学式是 ,滤液Ⅱ中溶质化学式 。(5)最终得到的精盐中NaCl的质量 原食盐样品中NaCl的质量。 (填“大于”或“小于”或等于,假设实验过程没有NaCl损失)
除尽过量的NaOH和Na2CO3
2NaOH+MgCl2=Mg(OH)2↓+2NaCl
NaCl、CaCl2、NaOH
例题、从海水中可以得到粗盐。粗盐中含有少量不溶性杂质和少量可溶性杂质(例如:Na2SO4、CaCl2、MgCl2),现以粗盐为原料制取精盐,生产过 程如图所示。
(1)请写出实验步骤 Ⅰ 中所涉及的化学方程式 。(2)加入的试剂的顺序是否可以改为:过量的NaOH溶液、过量的 Na2CO3溶液、过量的BaCl2溶液 (填“可以”或“不可以”), 理由是 。(3)检验步骤Ⅲ中Na2CO3溶液已过量的方法是____________________ 。
BaCl2+Na2SO4=BaSO4↓+2NaCl
最后加入的过量的BaCl2无法除去
取少量上层清液,加入足量稀盐酸,若产生气泡,则Na2CO3溶液已过量
NaClNa2SO4CaCl2MgCl2
NaClCaCl2MgCl2BaCl2
NaClCaCl2BaCl2NaOH
CaCO3 ↓BaCO3 ↓
NaClNaOHNa2CO3
NaCl(Na2SO4,MgCl2,CaCl2) 1.先加过量的BaCl2除去SO42- 2.再加过量的NaOH除去Mg2+ 3.加过量的Na2CO3除去Ca2+ ,和步骤1过量的Ba2+ 4.这时滤液中含有NaCl和NaOH,Na2CO3,再加适量的稀盐酸,除过NaOH,Na2CO3 5.蒸发结晶(其中BaCl2必须要加在Na2CO3前面)
小结正确的滴加顺序:BaCl2、NaOH、Na2CO3 或NaOH、BaCl2、Na2CO3
【师生活动一】写出下列转化的化学方程式
■考点二 物质的转化
Na2CO3→NaOH ;Na2SO4→NaNO3 ;CaCO3→CaCl2 。
Na2CO3 + Ca(OH)2= 2NaOH+ CaCO3↓
Na2SO4 + Ba(NO3)2= 2NaNO3+ BaSO4↓
CaCO3 + 2HCl= CaCl2 + H2O+CO2↑
1.下列物质之间的转化,经过一步反应不能实现的是( ) A.CuCl2→KCl B.KNO3→K2SO4 C.Fe(OH)3→Fe2(SO4)3 D.BaCl2→BaCO32.下列物质的变化,必须是只通过加入盐的溶液才能一步实现的是( ) A.MgO→MgCl2 B.K2CO3→KCl C.CaCO3→CaCl2 D.K2SO4→KCl
总结:KNO3、NaNO3永远不能发生复分解反应,只能做复分解反应的生成物。
1.下列试剂能将稀硫酸、氯化钠溶液、澄清石灰水三种溶液一步鉴别出来的是( )A.稀盐酸 B.碳酸钠溶液 C.二氧化碳 D.无色酚酞溶液2.下列各组物质的稀溶液中,不另加试剂就能鉴别出来的是( )A.FeCl3、NaOH、KOH B.H2SO4、NaOH、NaClC.Na2CO3、H2SO4、Ba(NO3)2 D.Na2CO3、CaCl2、HCl
■考点三 物质的鉴别
【实战演练二】1.鉴别盐酸和氯化钠方法错误的是( )A.硝酸银溶液 B.氧化铜 C.碳酸钙 D.紫色石蕊试液 2. 下列各组物质,仅用水无法鉴别的是( )A.CuSO4、Na2SO4 B.KCl、NaCl C.CaCO3、Na2CO3 D.NH4NO3、NaOH3.不用其他试剂鉴别,下列四种物质的溶液①MgCl2、②CuSO4、③NaOH、④NaCl,依次被鉴别出的顺序是( )A.②①③④B.②③①④C.①③②④D.①②③④
【知识拓展】关于Cl- 和SO42- 的检验:(1)鉴别含 Cl- 的化合物的方法:对比分析:盐酸和硝酸银溶液反应和氯化钠和硝酸银溶液反应的化学方程式,得出其反应的本质是(离子反应表达式): 。得出鉴别含Cl- 的化合物的方法:①试剂: 。②操作: 。③现象及结论: 。
Cl- + Ag+ = AgCl↓
AgNO3溶液、稀HNO3
向待检验的溶液中加少量AgNO3溶液,再加稀HNO3
产生白色沉淀,加硝酸后沉淀不溶解。
(2)鉴别含SO4 2- 的化合物的方法: 对比分析:对比硫酸和硝酸钡溶液反应和硫酸钠和硝酸钡溶液反应的化学方程式,得出其反应的本质是(离子反应表达式): 。 得出鉴别含SO4 2- 的化合物的方法: ①试剂: 。 ②操作: 。 ③现象及结论: 。 归纳关键点:检验含Cl- 或SO42-的化合物中滴加稀硝酸的目的是: 。
SO42- + Ba2+ = BaSO4↓
Ba(NO3)2溶液、稀HNO3
向待检验的溶液中加少量Ba(NO3)2溶液,再加稀HNO3
除去CO32-等离子的干扰
补充:也可以用BaCl2或Ba(OH)2溶液鉴别,但Ba(NO3)2溶液最好,大家 视情况而定。
◆实战演练◆ 某固体物质可能含有Na2SO4、Na2CO3、CaCl2、CuSO4、KCl和KOH中的一种或几种。为探究其组成,流程和现象记录如下(设过程中所有发生的反应均恰好完全进行):
(1)由步骤①得出固体物质中一定不含 (填化学式,下同);由无色溶液B的pH=7,可得出该固体物质中一定不含 ;白色固体C是 。
人教版九年级下册实验活动8 粗盐中难溶性杂质的去除教学ppt课件: 这是一份人教版九年级下册实验活动8 粗盐中难溶性杂质的去除教学ppt课件,共12页。PPT课件主要包含了见习题,答案显示,②①③④,没有用玻璃棒引流,滤纸破损合理即可,较多固体,BaCl2,NaOH,Na2CO3,复分解等内容,欢迎下载使用。
初中化学人教版九年级下册实验活动8 粗盐中难溶性杂质的去除图片ppt课件: 这是一份初中化学人教版九年级下册实验活动8 粗盐中难溶性杂质的去除图片ppt课件,共29页。PPT课件主要包含了见习题,答案显示,滤纸破损合理即可,④①②③,酒精灯,较多固体,答案A,托盘天平,搅拌加快溶解速率,蒸发皿中出现较多固体等内容,欢迎下载使用。
人教版九年级下册实验活动8 粗盐中难溶性杂质的去除课文内容ppt课件: 这是一份人教版九年级下册实验活动8 粗盐中难溶性杂质的去除课文内容ppt课件,文件包含人教版九年级化学下册第十一单元实验活动8粗盐中难溶性杂质的去除课件pptx、人教版九年级化学下册第十一单元实验活动8粗盐中难溶性杂质的去除教案docx等2份课件配套教学资源,其中PPT共11页, 欢迎下载使用。













