





初中化学人教版九年级下册课题1 生活中常见的盐教学演示ppt课件
展开古罗马货币 在古罗马表示贫穷与富有不是看拥有多少黄金,而是比藏有盐粒的数量,被历史上称为食盐货币时代。 我国的西藏过去也用过盐巴货币。为了换取生活必需的一小块盐,需要付出昂贵的代价。贵州解放前只有少数人家才吃得起吊盐(吃完饭后在吊着的盐块上舔一下)可见食盐的重要性。
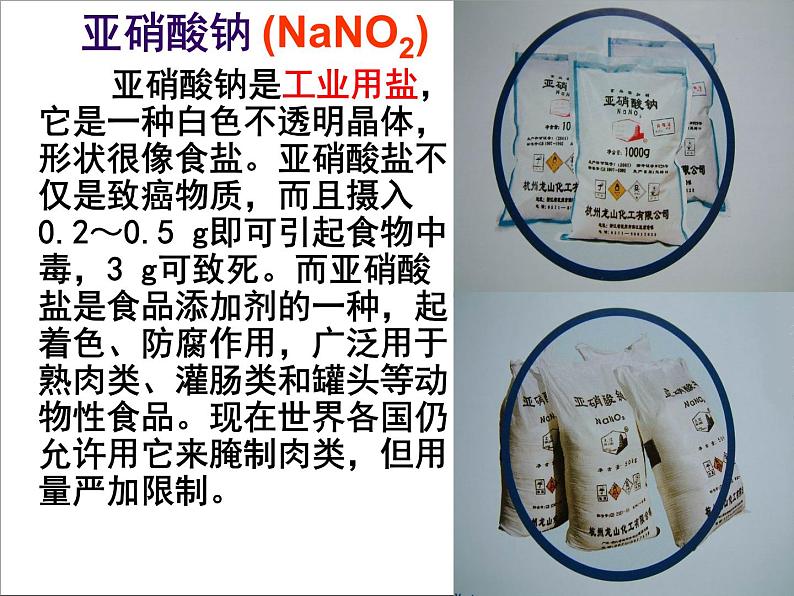
亚硝酸钠
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
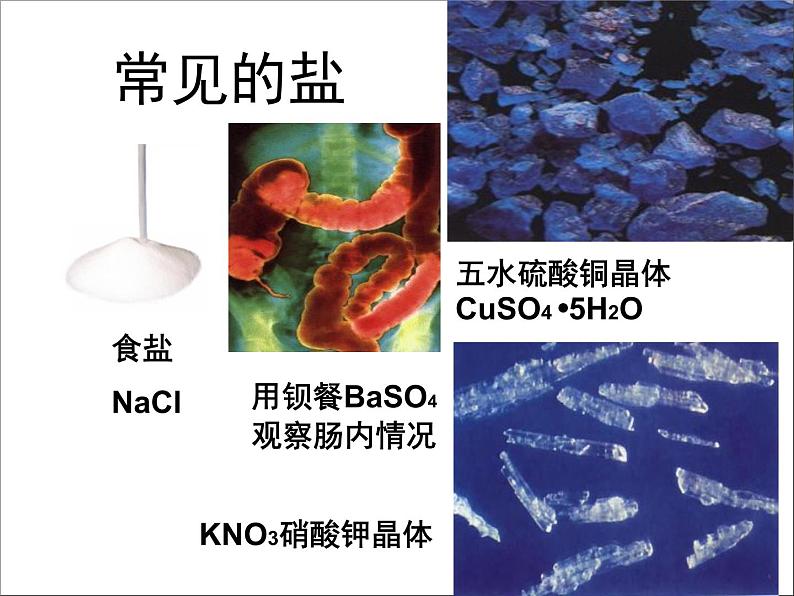
用钡餐BaSO4观察肠内情况
五水硫酸铜晶体CuSO4 5H2O
氯化钠日常生活用于调味和腌菜、肉,医药上的生理盐水0.9%的氯化钠溶液,工业上是化工原料,制取氯气、盐酸、纯碱。
如运动过度,出汗太多时,体内的Na+、Cl- 和K+大为降低,就会使肌肉和神经反应受到影响,导致恶心、呕吐、衰竭和肌肉痉挛等现象。因此,运动员在训练或比赛前后,需喝特别配制的饮料,以补充失去的盐分。
3)用盐水漱口防治口腔炎症
用10%——16%的食盐溶液来选种
用食盐腌制蔬菜、鱼、肉、蛋等
(1)维持细胞外液的渗透压 (2)参与体内酸碱平衡的调节 (3)氯离子在体内参与胃酸的生 成
海南省东方盐场晒盐一景
①溶解②过滤 ③蒸发
(2)过滤注意事项: 一贴: 二低: 三靠:
滤纸低于漏斗边缘0.5cm 滤液低于滤纸边缘
漏斗下端紧靠烧杯内壁 玻璃棒靠在三层滤纸处 烧杯靠在玻棒上倾倒液体
(1)滤纸对折,呈半圆型(一折);(2)再对折,呈扇形,但不要压出折线(二折);(3)滤纸展开(一边为三层),放到漏斗中调整大小后再拿出压折线,可撕掉外层中一角;(4)滤纸置于漏斗中,加水润湿;(5)轻压滤纸,赶出气泡,使其贴紧漏斗;(6)漏斗置于漏斗架,下端贴边放置烧杯。
(1)玻璃棒靠近三层滤纸一端;(2)玻璃棒引流倒入溶液;(3)溶液转移完毕,烧杯口沿玻璃棒上提并逐渐竖 直,防止溶液沿烧杯外壁流下;
防止液体由于局部过热,造成液滴飞溅
(1)溶液转移至蒸发皿(2)酒精灯加热蒸发;(3)开始出现结晶时,注意慢火加热并搅拌,防止局部过热导致晶体迸溅;
操作中4次用到玻璃棒,它的作用分别是什么?
溶解:搅拌,加速食盐溶解 过滤:引流,防止液体外溅蒸发:搅拌,防止液滴飞溅 计算产率:转移固体
1.盐是指一类组成里含有 和 的化合物。氯化钠是由 和 构成的。其中 有促生盐酸、帮助消化和增进食欲的作用。2.碳酸钠俗称 、 ;碳酸氢钠俗称 。3.氯化钠的用途:①生活中作 、 ;②医疗上用来配制 ;③农业上用来 ;④工业上可以用来制取 、 、氯气和盐酸等;⑤公路上用来 。
4.氯化钠主要蕴藏在 里,此外盐湖、盐井和盐矿中也有分布。世界上最大的盐矿储地是我国的柴达木盆地。5.制取粗盐的方法是晾晒或煮海水、盐井水、盐湖水,以除去其中的 。这一过程是 变化。
1.把粗盐变成精盐的大致步骤是 、沉淀、 过滤、蒸发、 。 2.过滤器是由 和滤纸组成的。在进行过滤时应注意 。3.粗盐提纯的实验中玻璃棒共用 次,作用分别是什么?
溶解时搅拌加速溶解;过滤时引流;蒸发时搅拌防止液滴飞溅;计算产率时转移固体。
4.若两次过滤后滤液仍然浑浊,原因可能有哪些?5.过滤后把滤液倒进 进行蒸发,当蒸发皿 中 停止加热。6.精盐产率= 7.若计算出的精盐产率比实际值偏大,试分析原因;若值偏小又有何原因。
①过滤时液面高于滤纸边缘;②滤纸破损;③仪器不干净。
产率偏高:①过滤不干净;②水没蒸发完。
产率偏低:①操作时液体洒落;②部分氯化钠沾在滤纸上或蒸发皿上。
二、碳酸钠、碳酸氢钠和碳酸钙
自学课本73—74页完成下面的问题
2.写出实验室制取二氧化碳的反应原理:思考:Na2CO3和NaHCO3是否也与HCl发生类似的反应?
CaCO3+2HCl=CaCl2+H2CO3
H2CO3=H2O+CO2
Na2CO3+2HCl=H2CO3+2NaCl
NaHCO3+HCl=H2CO3+NaCl
小结:NaHCO3比Na2CO3反应速率大,Na2CO3加热不分解, NaHCO3加热易分解
现象:有气泡产生,石灰水变浑浊
现象:反应比Na2CO3剧烈
仔细观察上面三个化学方程式,你有何发现? 由此你能想到一种检验CO32-、HCO3-存在的方法吗?
含有CO32-、HCO3-的盐与盐酸反应都放出CO2。
向待测物中滴加稀盐酸,并将产生的气体通入澄清的石灰水,石灰水变浑浊。
Na2CO3 + Ca(OH)2 = CaCO3 + 2NaOH
如何鉴别碳酸钠和碳酸氢钠?
产生能使澄清石灰水变浑浊的气体的是NaHCO3
2NaHCO3 Na2CO3+H2O+CO2
2.在溶液中加入相同溶液的盐酸
反应剧烈的是NaHCO3
3.溶解,加入氯化钙.产生沉淀的是Na2CO3
Na2CO3+CaCI2=CaCO3 +2NaCl
Na2CO3+Ca(OH)2=CaCO3 +2NaOH
两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应 。
表达式:AB + CD→
特 点:双交换,价不变
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
Cl+ CO3
2NaCl+H2O+CO2
下列化学反应属复分解反应的是
写出下列反应的方程式,并讨论它们是否属于复分解反应。1.盐酸除铁锈。2.氢氧化镁中和胃酸3纯碱制烧碱。4硫酸铜溶液与氢氧化钠溶液反应。5.硫酸溶液与碳酸钠反应
6HCl+2Fe2O3===2FeCl3+3H2O
Mg(OH)2+2HCl==MgCl2+2H2O
Ca(OH)2+Na2CO3==2NaCl+CaCO3↓
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
H2SO4+Na2CO3==Na2SO4+H2O+CO2↑
复分解反应发生的条件:
酸、碱、盐之间的反应都属复分解反应,但并不是任何酸、碱、盐之间都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时(至少满足上述条件之一),复分解反应才可以发生。
非金属氧化物与碱反应是复分解反应吗?为什么
想一想:化学方程式是否正确?
KNO3+NaOH=NaNO3+KOH
结合课本114页附录1判断下列反应能否发生
记住酸碱盐的溶解性是判断复分解反应基本要求,你有什么好方法快而准的记住它们吗?
酸都溶;溶碱有五位:钾、钠、铵、钙、钡;钾、钠、铵、硝酸盐都可溶;盐酸盐(— Cl)只有氯化银不可溶;硫酸盐(—SO4)只有硫酸钡不可溶;碳酸盐(—CO3)只溶钾、钠、铵、剩下都不溶。
钾钠铵硝溶得全,没有不溶水的盐。氯化物,要记住,只有银是不溶物。 硫酸盐,溶得多,只有钡在水中搁。碳磷酸盐很简单,溶于水的钾钠铵。
钾钠氨盐硝酸盐,均能溶于水中间。 硫酸盐中钡不溶,氯化盐中银不溶。 碳酸钾钠氨盐溶,氢氧钾钠钙钡溶。
1、判断下列复分解反应能否发生: H2SO4 + NaNO3—— Na2SO4 + BaCl2—— 2HNO3 + K2CO3—— KNO3 + NaOH——
BaSO4↓+ 2NaCl
2KNO3 + CO2↑+H2O
③碱+盐→新碱+新盐
①酸+碱→盐+水(中和反应)
⑤金属氧化物+酸→盐+水
反应物:无酸参加,必须可溶;生成物:必须有沉淀、气体、水三者之一。
酸 碱盐 盐
由两种化合物互相交换成分,生成另外两种化合物的反应。
复分解反应类型(举例)
1、酸+金属氧化物→盐 + 水
2、酸 + 碱 → 盐 + 水
Fe2O3 + 6HCl =2FeCl3+ 3H2O
NaOH + HCl = NaCl +H2O
3、盐+酸→新盐+新酸
CaCO3+2HCl=CaCl2+ CO2 ↑ +H2O
4、盐+碱→新盐+新碱
5、盐+盐→新盐+新盐
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
BaCl2+Na2SO4=BaSO4↓+2NaCl
CaCO3+2HCl=CaCl2+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2 ↑
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
CuSO4+2NaOH == Cu(OH)2↓+Na2SO4
NaCl+AgNO3=AgCl↓+NaNO3
Na2CO3+CaCl2=CaCO3↓+2NaCl
Na2CO3+BaCl2=BaCO3↓+2NaCl
练习1、判断下列复分解反应能否发生: H2SO4 + NaNO3— Na2SO4 + BaCl2— HNO3 + K2CO3— KNO3 + NaOH—
2KNO3 + CO2↑+H2O
1、下列各组物质的溶液,不能发生复分解反应的是 ( ) A、HCl,Ca(OH)2 B、Na2CO3,H2SO4C、AgNO3,BaCl2 D、KCl,CuSO4
2、下列反应中不属于复分解反应的是()。A、H2SO4+Ca(OH)2=CaSO4+2H2OB、H2SO4+BaCl2=BaSO4 +3HClC、2HCl+Fe=FeCl2+H2D、2HCl+CaCO3=CaCl2+H2CO3
将珍珠放入稀盐酸中,有气泡产生,生成的气体能使澄清的石灰水变浑浊,则珍珠中含有下列离子中的
A、氯离子 B、硫酸根离子 C、碳酸根离子 D、氢氧根离子
下列物质间能否发生复分解反应?若能,写出有关反应的化学方程式。1.硫酸和硝酸钠溶液2.氢氧化钠溶液和硝酸3.硫酸钠溶液和氯化钡溶液4.硝酸和碳酸钾溶液5.硝酸钾溶液和氢氧化钠溶液
侯德榜,1890年8月9日生于福建闽侯农村。少年时他学习十分刻苦,就是伏在水车上双脚不停地车水时,仍能捧着书本认真读书。后来在姑母的资助下,他单身来到福州英华书院和闽皖路矿学堂读书。毕业后曾在津浦铁路符离集车站做过工程练习生。在工作之余,他抓紧时间学习,1911年考人清华留美预备学校。经过3年的努力,他以10门功课1000分的优异成绩被保送到美国留学。8年中,他先后在麻省理工学院、柏拉图学院、哥伦比亚大学攻读化学工程,1921年取得博士学位。
原理:(1)NH3+H2O+CO2=NH4HCO3(首先通入氨气,然后再通入二氧化碳) (2)NH4HCO3+NaCl=NH4Cl+NaHCO3(NaHCO3溶解度最小,所以析出。) (3)2NaHCO3=Na2CO3+CO2↑+H2O(NaHCO3热稳定性很差,受热容易分解)
CaCO3+CO2+H2O=Ca(HCO3)2
Ca(HCO3)2=CaCO3 +CO2 +H2O
1.下列有关物质的化学式、名称、俗名不完全对
A.NaOH 氢氧化钠 烧碱
B.CaO 氢氧化钙 生石灰
C.Na2CO3 碳酸钠 纯碱
D.NaCl 氯化钠 食盐
2.化学就在我们身边,生活中处处有化学,根据你所学过的化学知识,判断下列说法中错误的是()。
A.“往菜里加点盐”中的盐特指“食盐”——NaCl
B.体温表中水银不是银,是金属汞
C.食品工业中,发酵粉的主要成分是小苏打——Na2CO3
D.生活中常用的铁制品都是铁的合金
梳理与反馈 一、知识梳理: 通过本节学习你有何收获? 二、反馈训练: 1.下列物质相互之间不能发生反应的是( ) A.NaOH、HCl B.BaCl2、Na2CO3 C.NaCl、Na2SO4 D.CuSO4、KOH 2.蒸馒头时,在发酵面团中加入某种物质,既能除去面团发酵产生的酸,又能使馒头松软,
1、生活中常见盐的用途;
2、 CO32-、HCO3-的检验方法;
3、复分解反应发生的条件。
加入的这种物质是( ) A.氢氧化钠 B.碳酸钠 C.氯化钠 D.氧化钙 3.下列各组物质中,能在同一溶液中大量共存的是( ) A.Na2SO4、 Ba(OH)2 、HCl . B.CuSO4、H2SO4、HNO3。 C. Na2CO3、 NaOH、Ca(OH)2。 D. K2SO4、 NaOH、Ba(NO3)2。 4.欲除去氢氧化钠中的少量氢氧化钙,可以选用的试剂是( ) A.氢氧化钾溶液 B.碳酸钠溶液 C.氯化钡溶液 D.稀盐酸
离子共存是指离子之间相互不发生化学反应
酸跟碱完全反应的产物。
酸中的氢离子部分被中和的产物。
碱中的氢氧根离子部分被中和的产物。
此外,对于含有相同酸根离子或相同金属离子的盐,常给一个统称。如盐酸盐、钠盐等。P77
在金属活动性顺序表中,只有________的金属才能把________的金属从它的______中置换出来,与氢的位置___关。盐必须是______盐。
①金属 + 盐 → 新盐 + 新金属
不要用K、Ca、Na置换盐溶液中的金属。铁参加的置换反应生成的都是亚铁盐。
②盐 + 酸 → 新盐 + 新酸
③盐 + 碱 → 新盐 + 新碱
④盐 + 盐 → 新盐 + 新盐
铁参加的置换反应生成的都是亚铁盐
条件:生成物中有沉淀或气体或水
条件:反应物两者均可溶; 生成物有沉淀或气体或水
条件:反应物两者均可溶; 生成物有沉淀
小结:酸和碱的化学性质
酸有一些相似的化学性质:
⑴酸能使酸碱指示剂显示不同的颜色;⑵酸能与多种活泼金属反应,生成盐和氢气;⑶酸能与某些金属氧化物反应,生成盐和水。⑷酸能与碱反应。⑸酸能与某些盐反应。
碱有一些相似的化学性质:
⑴碱能使酸碱指示剂显示不同的颜色;⑵碱能与某些非金属氧化物反应,生成盐和水。⑶碱能与酸反应。⑷碱能与某些盐反应。
四、几种常见离子的检验
①滴加稀盐酸,现象:有气泡产生;
②通入澄清石灰水,现象:生成白色浑浊。
①滴加硝酸钡,现象:生成白色沉淀;
②滴加稀硝酸,现象:沉淀不溶解。
①滴加氢氧化钠溶液,现象:有气泡产生;
②用红色石蕊试纸检验,现象:试纸变蓝。
①滴加硝酸银,现象:生成白色沉淀;
或用沾有无色酚酞的棉花检验
5.CO32-、HCO3-的检验
①检验依据: 组成里含有CO32-或HCO3-的盐都能与盐酸反应,生成二氧化碳气体。
②检验试剂:稀盐酸、澄清的石灰水。
③检验方法:取少量待测样品,加入少量稀盐酸,看能否生成使澄清的石灰水变浑浊的气体。
1.氯化钠的组成2.氯化钠的用途3.氯化钠的分布4.氯化钠的提纯
1.物理性质2.化学性质3.复分解反应
1.碳酸根离子的检验2.硫酸根离子的检验3.氯离子的检验4.铵根离子的检验
1.盐的分类2.盐的反应
1.下列各组离子能共存的是( )A.Ba2+、K+、NO3-、CO32-、H+B.K+、Cl-、Mg2+、NO3-、H+C.Fe3+、SO42-、OH-、Na+、Cu2+D.Ag+、Ba2+、Cl-、NO3-、K+
2.不用其它试剂,用最简捷的方法鉴别:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾五种溶液,则被鉴别出来的物质的正确的顺序是( ) A.①②③④⑤ B.④①②③⑤ C.④③①②⑤ D.②③①④⑤
3.下列各组溶液,不加其它试剂就能鉴别的是( ) A.Na2CO3、HCl、H2SO4、NaNO3 B.K2CO3、H2SO4、HNO3、BaCl2 C.HCl、AgNO3、HNO3、NaCl D.NaOH、FeCl3、MgCl2、BaCl2
4.有一包白色粉末,可能含有碳酸钙、硫酸钠、碳酸钠、氯化钙中的一种或几种。为了鉴别该白色粉末,做如下实验。(1)将白色粉末溶于水得无色溶液。(2)在该溶液中滴加BaCl2溶液有白色沉淀生成。(3)过滤后,在沉淀物里加入足量的稀硝酸,沉淀全部溶解并放出无色气体。 根据实验现象判断:此白色粉末中肯定含有 ,肯定不含有 。
CaCO3、Na2SO4、CaCl2
化学课题1 生活中常见的盐教课课件ppt: 这是一份化学<a href="/hx/tb_c9873_t3/?tag_id=26" target="_blank">课题1 生活中常见的盐教课课件ppt</a>,共40页。PPT课件主要包含了课前导入,新闻事件,亚硝酸钠NaNO2,PART1,盐的定义,生活中常见的盐,物质该如何分类,物质分类,盐的分类,盐的命名等内容,欢迎下载使用。
人教版九年级下册课题1 生活中常见的盐教学课件ppt: 这是一份人教版九年级下册课题1 生活中常见的盐教学课件ppt,共11页。PPT课件主要包含了通过这节课的学习,我还想学习,我体会到了,我收获了等内容,欢迎下载使用。
初中化学人教版九年级下册课题1 生活中常见的盐课文ppt课件: 这是一份初中化学人教版九年级下册课题1 生活中常见的盐课文ppt课件,共22页。PPT课件主要包含了洗涤剂,俗称小苏打,发酵粉,治疗胃酸过多,建筑材料,补钙剂,知识回顾,探究实验,稀盐酸,澄清石灰水等内容,欢迎下载使用。













