




- 2.2.2 氯气的实验室制法及氯离子的检验-【新教材】人教版(2019)高中化学必修第一册自助学案+配套练习 学案 7 次下载
- 2.3.1 物质的量的单位-摩尔-【新教材】人教版(2019)高中化学必修第一册自助学案+配套练习 学案 7 次下载
- 2.3.3 物质的量浓度及计算-【新教材】人教版(2019)高中化学必修第一册自助学案+配套练习 学案 7 次下载
- 2.3.4 一定物质的量浓度溶液的配制-【新教材】人教版(2019)高中化学必修第一册自助学案+配套练习 学案 7 次下载
- 第二章 海水中的重要元素——钠和氯(单元测试卷)-【新教材】人教版(2019)高中化学必修第一册自助学案+配套练习 学案 7 次下载
高中化学人教版 (2019)必修 第一册第三节 物质的量优质导学案
展开第三节 物质的量(学案)
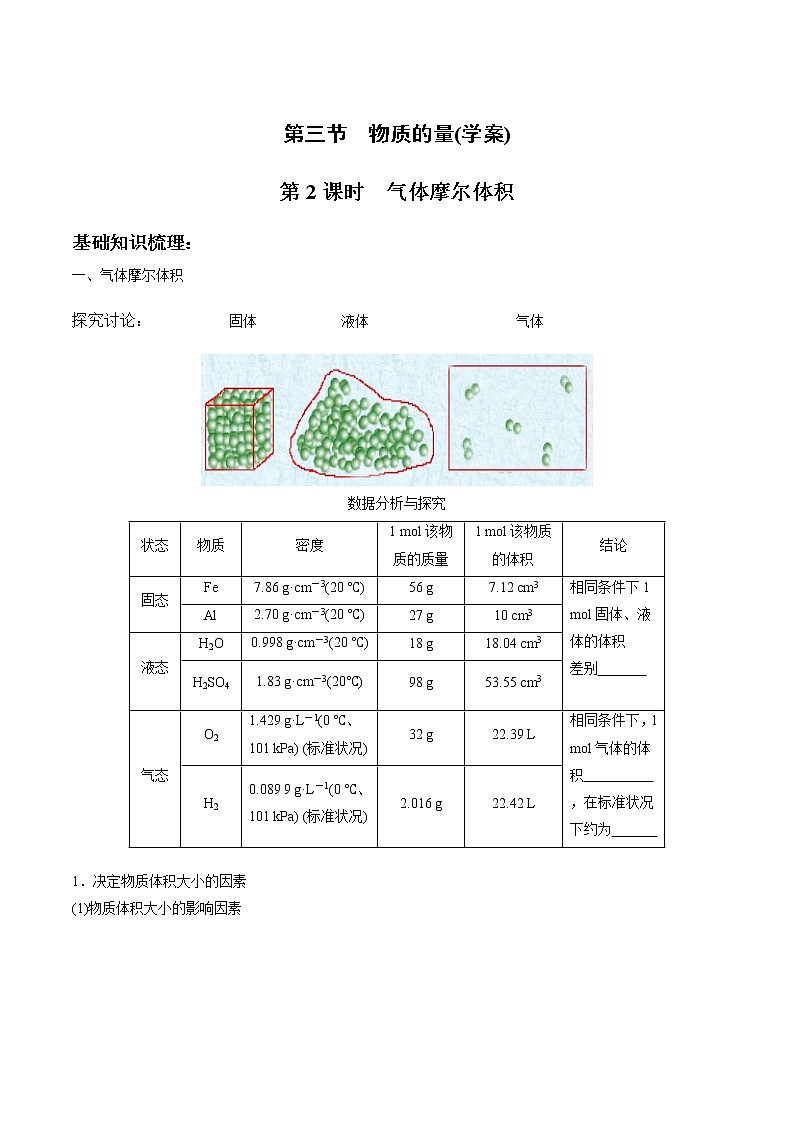
第2课时 气体摩尔体积
基础知识梳理:
一、气体摩尔体积
探究讨论: 固体 液体 气体
数据分析与探究
状态 | 物质 | 密度 | 1 mol该物质的质量 | 1 mol该物质的体积 | 结论 |
固态 | Fe | 7.86 g·cm-3(20 ℃) | 56 g | 7.12 cm3 | 相同条件下1 mol固体、液体的体积 差别
|
Al | 2.70 g·cm-3(20 ℃) | 27 g | 10 cm3 | ||
液态 | H2O | 0.998 g·cm-3(20 ℃) | 18 g | 18.04 cm3 | |
H2SO4 | 1.83 g·cm-3(20℃) | 98 g | 53.55 cm3 | ||
气态 | O2 | 1.429 g·L-1(0 ℃、101 kPa) (标准状况) | 32 g | 22.39 L | 相同条件下,1 mol气体的体积 ,在标准状况下约为 |
H2 | 0.089 9 g·L-1(0 ℃、101 kPa) (标准状况) | 2.016 g | 22.42 L |
1.决定物质体积大小的因素
(1)物质体积大小的影响因素
【答案】:
(2)粒子数目相同物质的体积关系
2.气体摩尔体积
(1)定义:
(2)符号:
(3)单位:
(4)数学表达式:
(5)标准状况下的气体摩尔体积:
在 ℃、 kPa时,1mol任何气体的体积都是
标准状况下,气体的摩尔体积Vm=
【答案】:
(1)单位物质的量的气体所占的体积
(2)Vm
(3)L/mol
(4)Vm=V/n
(5)0℃ 101 22.4L 22.4L /mol
3.标准状况下气体体积的计算
(1)计算关系
①气体的物质的量 mol;
②气体的摩尔质量 g·mol-1;
③气体的分子数 ;
④气体的质量 g。
【答案】:
①气体的物质的量n= mol;
②气体的摩尔质量M=Vm·ρ=22.4ρ g·mol-1;
③气体的分子数N=n·NA=·NA;
④气体的质量m=n·M=·M g。
二、阿伏加德罗定律
1.气体体积与物质的量关系的实验探究
(1)实验观察
电解水的实验装置如下图所示:
由图可知:A试管中收集到的气体是 ,B试管中收集到的气体是 ,二者的体积之比是 。
(2)计算推理
若有1.8 g水电解,产生氢气的质量为0.2 g,物质的量为0.1 mol;产生氧气的质量为1.6 g,物质的量为0.05 mol;二者物质的量之比为2∶1。
(3)相关结论
①同温同压下,气体的物质的量之比等于 之比。
②同温同压下,1 mol的不同气体,其体积 。
2.阿伏加德罗定律
(1)定律内容: 。
(2)特别提示:
①阿伏加德罗定律适用于任何气体,包括混合气体,不适用于非气体;
②同温、同压、同体积、同分子数,共同存在,相互制约,且“三同定一同”;
③标准状况下的气体摩尔体积是阿伏加德罗定律的一个特例。
(3)有关推论:
(1)阿伏加德罗定律的推论
相同条件 | 结论 | |
公式 | 语言叙述 | |
同温同压 | == | 同温同压下,体积之比等于物质的量之比,等于分子数之比 |
同温同体积 | == | 同温同体积下,压强之比等于物质的量之比,等于分子数之比 |
同温同压 | = | 同温同压下,密度之比等于摩尔质量之比 |
同温同压同体积 | = | 同温同压下,体积相同的气体,其质量与摩尔质量成正比 |
3、突破阿伏加德罗常数应用的陷阱
1).抓“两看”,突破气体与状况陷阱
一看“气体”是否处在“标准状况”。
二看“标准状况”下,物质是否为“气体”[如CCl4、CHCl3、CH2Cl2(注:CH3Cl为气体)、H2O、溴、SO3、己烷、苯等在标准状况下均不为气体]。
2).排“干扰”,突破质量(或物质的量)与状况无关陷阱
给出非标准状况下气体的物质的量或质量,干扰学生的正确判断,误以为无法求解物质所含的粒子数,实际上,此时物质所含的粒子数与温度、压强等外界条件无关。
【典型例题】
类型一、气体摩尔体积
【例1】.下列说法正确的是( )
A.标准状况下,6.02×1023个分子所占的体积约是22.4 L
B.0.5 mol H2所占的体积是11.2 L
C.标准状况下,1 mol H2O的体积为22.4 L
D.标准状况下,28 g CO与N2的混合气体的体积约为22.4 L
【答案】:D
【例2】.下列说法中不正确的是( )
A.HCl的相对分子质量与6.02×1023个HCl分子的质量(以g为单位)在数值上相等
B.6.02×1023个氮分子和6.02×1023个氢分子的质量比等于14∶1
C.32 g氧气所含的原子数目为2×6.02×1023
D.常温常压下,0.5×6.02×1023个一氧化碳分子所占体积是11.2 L
【答案】:D
【例3】.下列叙述正确的是( )
A.1 mol 任何气体的体积都约为22.4 L
B.1 mol 任何物质在标准状况下所占的体积都约是22.4 L
C.标准状况下,1 mol 水所占有的体积是22.4 L
D.标准状况下,22.4 L的任何气体的物质的量都约是1 mol
【答案】:D
【例4】.下列叙述中,正确的是( )
A.在标准状况下,1molH2O的体积约为22.4L
B.在标准状况下,0.5molH2、0.5molN2组成的混合气体的体积约为22.4L
C.在非标准状况下,1mol任何气体的体积不可能为22.4L
D.标准状况下,气体的摩尔体积为22.4L
【答案】:B
【例5】.如果g某气体中含有的分子数为,则g该气体在标准状况下占有的体积应表示为(式中为阿伏加德罗常数)( )
A. B. C. D.
【答案】:A
类型二、阿伏加德罗定律及其推论
【例1】.下列两种气体的分子数一定相等的是( )
A.质量相等、密度不等的N2和CO B.等体积、等密度的CO和NO
C.等温、等体积的O2和N2 D.等压、等体积的N2和CO2
【答案】:A
【例2】.】两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同的( )
A.原子总数 B.质子总数 C.分子总数 D.质量
【答案】:A C
【例3】.下列条件下,两种气体的分子数一定不相等的是( )
A.相同质量、不同密度的N2和C2H4B.相同体积、相同密度的CO和C2H4
C.相同温度相同压强相同体积的O2和N2D.相同压强、相同体积、相同质量的O2和N2
【答案】:D
【例4】.在同温、同压下,相同质量的下列气体占有的体积由大到小的顺序是:
①Cl2 ②N2 ③ H2 ④ CO2 ⑤ O2
【答案】:③ ② ⑤ ④ ①
【例5】.150 mL A2气体跟50 mL B2气体恰好完全反应,生成的气体体积为100 mL(同温、同压条件下),试填空:
(1)生成物的化学式是________。
(2)推断化学式的依据是________。
【答案】:BA3 B2+3A2=2BA3
类型三、计算
【例1】.已知某气体在相同状况下与空气密度之比是0.97,求该气体的式量。
【答案】:28
【例2】.在标准状况下,测得1.92g某气体的体积为672mL。计算此气体的相对分子质量。
【答案】:64
【例3】.标准状况下,89.6LCO和44.8LCO2混合,求混合气体的平均式量。
【答案】:30
高中第一节 原子结构与元素周期表优秀学案: 这是一份高中第一节 原子结构与元素周期表优秀学案,文件包含414卤族元素的性质自助学案-新教材人教版2019高中化学必修第一册自助学案+配套练习docx、414卤族元素的性质配套练习-新教材人教版2019高中化学必修第一册自助学案+配套练习docx等2份学案配套教学资源,其中学案共19页, 欢迎下载使用。
人教版 (2019)必修 第一册第一节 原子结构与元素周期表优质导学案: 这是一份人教版 (2019)必修 第一册第一节 原子结构与元素周期表优质导学案,文件包含411原子结构自助学案-新教材人教版2019高中化学必修第一册自助学案+配套练习docx、411原子结构配套练习-新教材人教版2019高中化学必修第一册自助学案+配套练习docx等2份学案配套教学资源,其中学案共15页, 欢迎下载使用。
化学第二节 金属材料优秀学案: 这是一份化学第二节 金属材料优秀学案,文件包含321常见的合金及应用自助学案-新教材人教版2019高中化学必修第一册自助学案+配套练习docx、321常见的合金及应用配套练习-新教材人教版2019高中化学必修第一册自助学案+配套练习docx等2份学案配套教学资源,其中学案共11页, 欢迎下载使用。













