

高中化学人教版 (2019)选择性必修3第三章 烃的衍生物第二节 醇酚教案
展开3.2.1 醇
醇和酚是重要的经的含氧衍生物,它们共同特点是都含有羟基(-OH)官能团。进行教学时,要注意根据“结构决定性质”的基本思想方法,研究羟基官能团的结构特点及其化学性质,从乙醇的结构和性质迁移到醇类的结构和性质。培养学生变化观念与证据推理的科学素养。
教学重点:乙醇的结构特点和化学性质
教学难点:醇的结构和性质
讲义 教具
【新课导入】
在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢?
【展示】
酒精在人体内的代谢主要靠两种酶:一种是乙醇脱氢酶,另一种是乙醛脱氢酶。
乙醇脱氢酶使乙醇氧化变成乙醛,而乙醛脱氢酶能使乙醛氧化为乙酸。乙酸参与体内代谢,转化为二氧化碳和水排出体外。人体内若是具备这两种酶,就能较快地分解酒精。一般人的体内都有乙醇脱氢酶,但不少人缺少乙醛脱氢酶,这使体内的乙醛不易被氧化为乙酸,从而让人脸部甚至体表毛细血管扩张充血,并产生其他醉酒症状。
乙醇是同学们非常熟悉的有机化合物,也是人类较早认识和利用的有机化合物之一。
【复习回顾】
书写乙醇的分子式、结构式、结构简式、结构特点及官能团。
【学生活动1】
对下列物质进行分类
【讲解】
醇:羟基与饱和碳原子相连的化合物称
酚:羟基与苯环直接相连而形成的化合物
【学生活动2】
阅读课本,完成下列问题
醇的定义
醇的分类
甲醇的物理性质、危害及应用
以几种醇的熔点和沸点为例,同时结合烷烃的物理性质的变化规律,总结醇的物理性质。
【讲解】
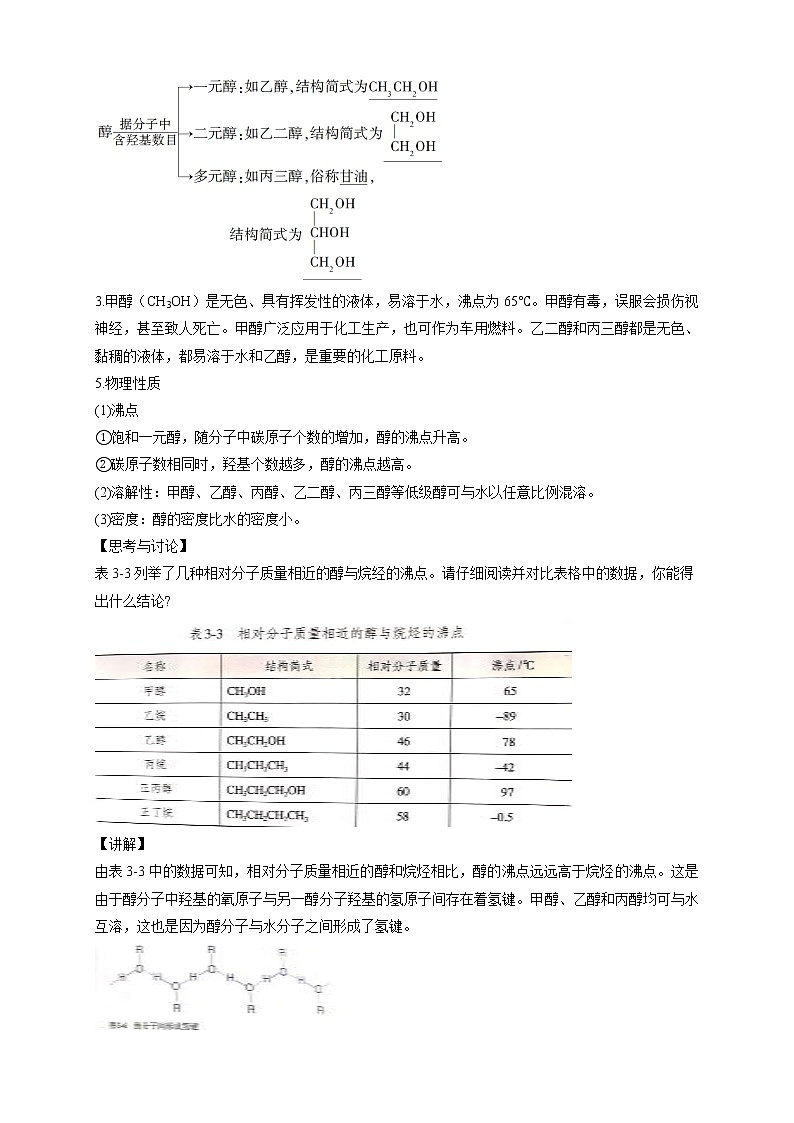
一、醇的概念、分类和命名
1.概念
羟基与烃基或苯环侧链上的碳原子相连的化合物。
官能团为羟基(—OH)。
一元醇:分子中只含有一个羟基的
饱和一元醇:由烷烃所衍生的一元醇,如甲醇、乙醇;
等饱和一元醇的通式为CnH2n+1OH。,
2.分类
3.甲醇(CH3OH)是无色、具有挥发性的液体,易溶于水,沸点为65℃。甲醇有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,也可作为车用燃料。乙二醇和丙三醇都是无色、黏稠的液体,都易溶于水和乙醇,是重要的化工原料。
5.物理性质
(1)沸点
①饱和一元醇,随分子中碳原子个数的增加,醇的沸点升高。
②碳原子数相同时,羟基个数越多,醇的沸点越高。
(2)溶解性:甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇可与水以任意比例混溶。
(3)密度:醇的密度比水的密度小。
【思考与讨论】
表3-3列举了几种相对分子质量相近的醇与烷经的沸点。请仔细阅读并对比表格中的数据,你能得出什么结论?
【讲解】
由表3-3中的数据可知,相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。这是由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子间存在着氢键。甲醇、乙醇和丙醇均可与水互溶,这也是因为醇分子与水分子之间形成了氢键。
【过渡】
醇的化学性质主要由羟基官能团决定,现在我们来分析在发生化学反应时官能团发生了什么变化。
【学生活动3】
复习回顾乙醇的化学性质,写出我们学过的有关乙醇的化学方程式。
搭建以上反应产物的球棍模型,并且分析乙醇的哪些化学键发生了变化。
【讲解】
与活泼金属(如Na)发生反应,其反应方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,
Na与醇的反应比Na与水的反应平缓,说明水分子中—OH活性比醇中—OH的大。
酯化反应
氧化反应
【过渡】
醇的化学性质主要由羟基官能团所决定。在醇分子中,由于氧原子吸引电子的能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。因此,醇在发生反应时,O—H容易断裂,使羟基中的氢原子被取代,同样,C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
【讲解】
取代反应
(1)醇可以与氢卤酸发生取代反应生成卤代烃和水。反应时醇分子中的C—O断裂,卤素原子取代了羟基而生成卤代烃。
例如:乙醇与浓氢溴酸混合加热后发生取代反应,生成溴乙烷,这是制备溴乙烷的方法之一。
CH3CH2OH+HBreq \(――→,\s\up16(△))CH3CH2Br+H2O。
如果把乙醇和浓硫酸的混合物的温度控制在140℃左右,乙醇将以另一种方式脱水,即每两个乙醇分子间会脱去一个水分子而生成乙醚。
C2H5OH+C2H5OHeq \(――→,\s\up11(浓硫酸),\s\d4(140 ℃))C2H5OC2H5+H2O。
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解多种有机物。
[概念辨析]
醚:由两个烃基通过一个氧原子连接起来的化合物
醚的官能团:
醚的结构可用R—O—R'来表示,R和R'都是烃基,可以相同,也可以不同。
【实验3-2】
实验方案:
如图3-9所示,在圆底烧瓶中加入乙醇和液硫酸(体积比约为1:3)的混合液20 mL,放入几片碎瓷片,以避免混合液在受热时暴沸。加热混合液,使液体温度迅速升到170℃,将生成的气体先通入氢氧化钠溶液除去杂质,再通入酸性高锰酸钾溶液和溴的四氯化碳溶液中,观察实验现象。
实验现象:
酸性高锰酸钾溶液退的,溴的四氯化碳溶液褪色。
实验结论:
乙醇在浓硫酸的作用下,加热到170 ℃时生成乙烯。
实验评价:
1.试剂的作用
2.现象、原因及结论
3.实验的关键——严格控制温度
(1)无水酒精和浓硫酸混合物在170 ℃的温度下主要生成乙烯和水,而在140 ℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚,故需迅速升温至170 ℃。
(2)温度计水银球要置于反应物的中央位置因为需要测量的是反应物的温度,而且不能与烧瓶接触。
【思考与讨论】
溴乙烷与乙醇都能发生消去反应,二者的反应有什么异同?
请写出分子式为C3H8O的有机化合物的同分异构体的结构简式。
CH3CH2CH2OH CH3CH(CH3)OH`
【讲解】
消去反应
CH3CH2OHCH2CH2↑+H2O
消去反应的实质
①醇分子中,连有—OH的碳原子的相邻碳原子上连有氢原子时,才能发生消去反应而形成不饱和键。
②若醇分子中与—OH相连的碳原子无相邻碳原子或其相邻碳原子上无氢原子,则不能发生消去反应。如CH3OH、(CH3)3CCH2OH不能发生消去反应生成烯烃。
【实验3-3】
实验方案:
在试管中加入酸性重铬酸钾溶液,然后滴加乙醇,充分振荡,观察实验现象。
实验现象:
溶液由橙红色变为绿色
实验结论:
乙醇能被酸性重铬酸钾溶液氧化,
其氧化过程可分为两个阶段:
【讲解】
氧化反应
氧化反应:有机化合物分子中失去氢原子或加入氧原子的反应
还原反应:有机化合物分子中加入氢原子或失去氧原子的反应
实例:
②乙醇被酸性重铬酸钾(K2Cr2O7)溶液氧化的过程为
(2)醇能否被氧化以及被氧化的产物的类别,取决于与羟基相连的碳原子上的氢原子的个数,具体分析如下:
【总结】
【课堂小结】
新修改的机动车驾驶证申领和使用规定于2010年4月1日起实施,新规规定酒驾一次扣12分,出此拳治理酒驾是因酒后驾车是引发交通事故的重要原因。如图所示为交警在对驾驶员是否饮酒进行检测。其原理是:橙色的酸性水溶液遇呼出的乙醇蒸气迅速变蓝,生成蓝绿色的。下列对乙醇的描述与此测定原理有关的是
乙醇沸点低 乙醇密度比水小 乙醇具有还原性乙醇是烃的含氧衍生物 乙醇可与羧酸在浓硫酸的作用下发生取代反应
A. B. C. D.
【答案】C
【解析】
乙醇沸点低,易挥发,易被检测,与测定原理有关;
乙醇密度比水小,可与水以任意比混溶,与测定原理无关;
乙醇分子中含有羟基,具有还原性,具有强氧化性,可以把乙醇迅速氧化自身生成蓝绿色的,与测定原理有关;
乙醇可看成是乙烷中的氢原子被羟基取代后的产物,是烃的含氧化合物,与测定原理无关;
乙醇可与羧酸在浓硫酸的作用下发生取代反应,与测定原理无关;
对乙醇的描述与此测定原理有关的是。
故选C。
关于卤代烃与醇的说法不正确的是
A. 卤代烃与醇发生消去反应的条件不同
B. 既可以发生消去反应,又可以被氧气催化氧化
C. 不同的卤代烃通过消去反应可能会生成相同的烯烃
D. 可以发生消去反应,那么也可以发生消去反应
【答案】B
【解析】
A.卤代烃在氢氧化钠的醇溶液中发生消去反应,醇发生消去反应是在浓硫酸作催化剂条件下,条件不同,故A正确;
B.发生消去反应生成烯烃,羟基所在碳上无氢原子,不能被氧气催化氧化,故B错误;
C.不同的卤代烃通过消去反应可能会生成相同的烯烃,故C正确;
D.,与Br相连的C的邻位上有H原子,能发生消去反应,故D正确,
故选B。
以下四种有机物:
其中既能发生消去反应又能发生催化氧化生成醛的是
A. 和B. 只有C. 和D. 和
【答案】C
【解析】
醇类物质中能发生消去反应,所连C的邻位C上应含有H原子;能发生催化氧化反应生成醛类,应含有的结构,以此解答该题。
可发生消去反应,可被氧化生成酮,故错误;
既能发生催化氧化生成丁醛,又能发生消去反应生成丁烯,故正确;
既能发生催化氧化生成甲基丙醛,又能发生消去反应生成甲基丙烯,故正确;
,可发生消去反应,但不能发生催化氧化,故错误。
故选:C。
乙醇分子中的各种化学键如图所示,关于乙醇在各种反应中断裂键的说法不正确的是
A. 和金属钠反应时断裂键
B. 在加热和有铜催化下与反应时断裂和键
C. 和乙酸反应制备乙酸乙酯时断裂键
D. 在空气中完全燃烧时断裂键
【答案】C
【解析】
A.乙醇与与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键,即断裂,故A正确;
B.乙醇在铜催化下与反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的碳氢键,即断裂,故B正确;
C.酯化反应时“酸脱羟基醇脱氢”,所以乙醇和乙酸反应制备乙酸乙酯时断裂键,故C错误;
D.在空气中完全燃烧时生成二氧化碳和水,断裂,故D正确。
故选C。
某二元醇的结构简式为,关于该有机物的说法错误的是
A. 用系统命名法命名:甲基,庚二醇
B. 该有机物通过消去反应能得到6种不同结构的二烯烃
C. 该有机物可通过催化氧化得到醛类物质
D. 该有机物能与足量金属Na反应产生
【答案】C
【解析】
A.有机物的最长碳链有7个碳原子,2个羟基分别位于2号和5号碳原子上,甲基位于5号碳原子上,系统命名法命名为:甲基,庚二醇,故A正确;
B.左边羟基消去,形成3种不同位置的双键,右边羟基消去可形成2种不同位置双键,故可得种不同结构的二烯烃,故B正确;
C.只含结构,该有机物中可通过催化氧化得到的是酮,而不是醛类物质,故C错误;
D.该有机物含有2ml羟基,能与足量金属Na反应产生1ml氢气,标准状况下的体积为,故D正确。
故选C。
本节课以乙醇为代表,了解醇的分类、组成和结构,理解醇的性质,掌握乙醇消去反应制乙烯实验和醇催化氧化和消去反应的条件,培养学生宏观辨识与微观探析科学素养。从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系,培养学生变化观念与证据推理的科学素养。
课程目标
学科素养
1.了解醇的典型代表物——乙醇的结构及性质。
2.了解乙醇消去反应制乙烯实验和醇催化氧化和消去反应的条件。
宏观辨识与微观探析:结合醇的代表物了解醇的分类、组成和结构,理解醇的性质
变化观念与证据推理:以乙醇为代表物,从化学键的变化理解醇的取代、消去、氧化反应的原理及转化关系。
试剂
作用
浓硫酸
催化剂和脱水剂
氢氧化钠溶液
吸收二氧化硫和乙醇(都与酸性高锰酸钾溶液反应,SO2能与溴的CCl4溶液反应)
溴的CCl4溶液
验证乙烯的不饱和性
酸性高锰酸钾溶液
验证乙烯的还原性
碎瓷片
防止暴沸
现象
原因及结论
烧瓶中液体逐渐变黑
浓硫酸与乙醇作用生成碳单质
溴的CCl4溶液褪色
乙烯与溴单质发生加成反应
酸性高锰酸钾溶液褪色
乙烯被酸性高锰酸钾氧化
CH3CH2CH2Br
CH3CH2CH2OH
反应条件
NaOH乙醇溶液 加热
浓硫酸,加热至170 ℃
化学键断裂
C—Br C—H
C—O C—H
化学键生成
碳碳双键
碳碳双键
反应产物
CH2CH2 NaBr H2O
CH2CH2 H2O
选择性必修3第一节 卤代烃教案: 这是一份选择性必修3第一节 卤代烃教案,共11页。教案主要包含了新课导入,复习回顾,学生活动1,学生活动2,思考与讨论,学生活动3,实验3-2,实验3-3等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修3第三节 核酸教案及反思: 这是一份高中化学人教版 (2019)选择性必修3第三节 核酸教案及反思,共7页。教案主要包含了新课导入,归纳总结,学生活动,拓展活动等内容,欢迎下载使用。
2020-2021学年第三章 烃的衍生物第四节 羧酸 羧酸衍生物教学设计: 这是一份2020-2021学年第三章 烃的衍生物第四节 羧酸 羧酸衍生物教学设计,共10页。教案主要包含了导入新课等内容,欢迎下载使用。













