





化学必修 第一册第二节 离子反应背景图课件ppt
展开长跑运动员在大量出汗后,可能会发生抽搐,所以运动员饮用水一般是一种电解质饮料,可以补充体内流失的电解质
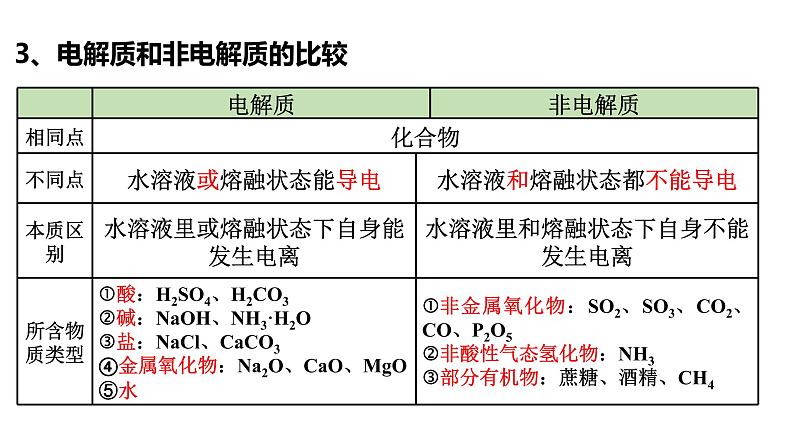
1.电解质:在水溶液里或熔融状态下能够导电的化合物
2.非电解质:在水溶液和熔融状态下都不能导电的化合物
包括:酸、碱、盐、某些金属氧化物、水等
包括:非金属氧化物、非酸性气态氢化物以及大部分有机物等
3、电解质和非电解质的比较
1.下列物质哪些是电解质?哪些是非电解质?那些能导电?
①金属铜 ②固态NaCl ③O2 ④H2SO4⑤碳棒 ⑥酒精水溶液 ⑦KOH水溶液⑧熔融状态的KNO3 ⑨葡萄糖 ⑩ 氨气
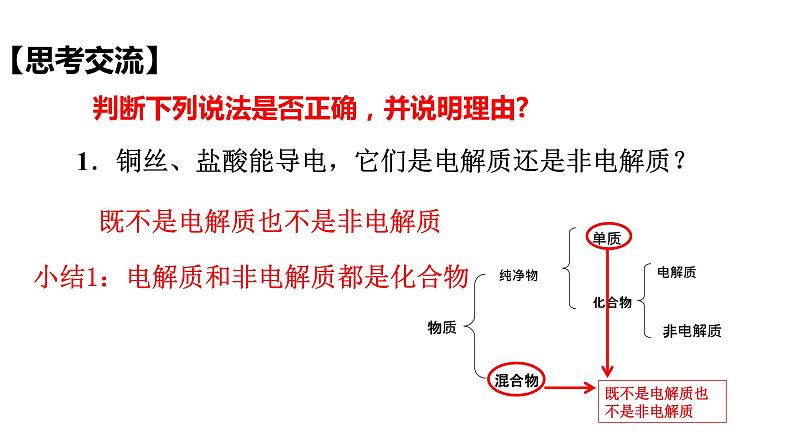
【思考交流】
1.铜丝、盐酸能导电,它们是电解质还是非电解质?
小结1:电解质和非电解质都是化合物
既不是电解质也不是非电解质
判断下列说法是否正确,并说明理由?
3.纯硫酸在熔融状态下不导电,所以硫酸不是电解质,这种说法正确吗?
小结2:电解质导电的条件是在水溶液里或熔融状态下,两个条件具备一个即可。
不正确 溶于水可导电
2.BaSO4、AgCl、CaCO3均难溶于水,它们是电解质吗?
是 难溶盐在熔融状态时可导电
4.SO2溶于水形成的溶液以及Na2O熔融状态下都能导电,这两种氧化物都是电解质吗?
小结3:在水溶液里或熔融状态下,本身直接电离出自由移动离子的化合物才是电解质(如SO2、SO3、P2O5、CO2、NH3的水溶液能导电是因为它们和水反应的产物电离出自由移动的离子,所以他们为非电解质)
SO2不是 Na2O是
5.NaCl晶体,液态HCl都不导电,所以它们不是电解质?
小结4:电解质导电是有条件的,电解质并不一定能导电; 能导电的物质也不一定是电解质。
是电解质 NaCl晶体,液态HCl在水溶液里都导电
【提示】电解质和非电解质判断方法
(1)看物质是否是化合物。
(2)看该物质在水溶液里或熔融状态下能否导电。
(3)看是否是物质本身电离而导电。
2.氯化钠的水溶液为什么能够导电?
3.在NaCl晶体中能导电吗?为什么?
没有自由移动的离子,不导电
1.金属为什么能够导电 ?
金属内有可以自由移动的电子
4、电解质导电情况分析
(1)不同电解质的导电情况
(2)影响电解质溶液导电能力的因素
① 溶液中自由移动离子的浓度,离子浓度越大,导电能力越强。
② 离子所带的电荷数,离子带电荷越多,导电能力越强。
电解质在溶解于水或受热熔化时,离解成能自由移动的离子的过程称为电离。
电离与通电无关,若化合物发生电离则能导电
(1)在水溶液中完全电离的电解质,电离方程式用“=”连接。如:HCl = H+ + Cl- ;NaOH = Na+ + OH- ;NaCl = Na+ + Cl-
用化学式和离子符号来表示电离过程的式子。
书写下列各组物质的电离方程式:1.硫酸、硝酸2.氢氧化钾、氢氧化钡3.硫酸铜、氯化钡
H2SO4 ==== 2 H+ + SO42-
HNO3 ==== H+ + NO3-
KOH ==== OH- + K+
Ba(OH)2 ==== 2 OH- + Ba2+
CuSO4 ==== Cu2+ + SO42-
BaCl2 ==== Ba2+ + 2Cl-
酸:电离时,生成的阳离子全都是H+的化合物。
碱:电离时,生成的阴离子全都是OH-的化合物。
盐:电离时,能生成金属阳离子或铵根离子和酸根阴离子的化合物。
3.从电离角度重新定义酸、碱、盐。
三、强电解质和弱电解质 强电解质:在水溶液里能够完全电离的电解质。 强酸:H2SO4 HCl HNO3 HClO4 HBr HI 强碱: NaOH KOH Ba(OH)2 Ca(OH)2 多数盐:NaCl NaHSO3 NH4Cl BaSO4 等
弱电解质:在水溶液里只有部分电离的电解质。弱酸:CH3COOH、HF、H2S 、HClO、H3PO4 H2CO3 等弱碱:NH3·H2O Cu(OH)2 等极少数盐: (CH3COO)2Pb ; 水
1、电解质的强弱与电解质在水中的溶液度大小无关,易溶于水的可能为强电解质也可能为弱电解质,如醋酸铅易溶于水但为弱电解质,难溶于水的也可能为强电解质或是弱电解质,如AgCl
2、判断电解质强弱的依据是其在水溶液里能否完全电离,而不是水溶液的导电性强弱。
第2节 离子反应第2课时
用实际参加反应的离子符号表示化学反应的式子.
(1)表示某一具体反应的离子方程式
(2)表示某一类型反应的离子方程式
在水溶液或熔融状态有离子参加或生成的反应.
1.可溶性的强电解质要写成离子形式:
(3)可溶性的盐(据溶解性表)
HCl H2SO4 HNO3 HBr HI HClO4
NaOH KOH Ba(OH)2 Ca(OH)2
(4)酸式盐的强 酸酸式酸根要拆成H+和酸根, 如HSO4-要拆成H+和SO42-
2.必须写成化学式的物质(重要)(1)弱电解质:①弱酸: HAc、H2CO3、H2S、 HF、H2SO3、 H3PO4 、 HCN、HClO、H2SiO3②弱碱:NH3·H2O、难溶性碱③H2O
(2)难溶物(根据溶解性表)
例:碳酸钙和盐酸反应 铁和硫酸铜溶液的反应
例:二氧化碳通入澄清石灰水
(7)微溶物处理原则 Ca(OH)2、MgCO3、CaSO4、Ag2SO4
例:二氧化碳通入澄清石灰水 石灰乳[Ca(OH)2浑浊液]和碳酸钠溶液作用
较稀,溶液澄清,写成离子形式
较浓或溶液浑浊,写成化学式
(6)酸式盐的弱酸酸式酸根不能拆成H+和酸根, 如HCO3-不能拆成H+和CO32-
三、离子方程式书写正误的判断方法
1、尊重客观实际,不可主观臆造产物及反应。
例:铁跟稀硫酸反应: 2Fe+6H+==2Fe3++3H2↑
凡非溶液中进行的反应一般不能写离子方程式。
Fe + 4HNO3 =Fe(NO3)3 + NO + 2H2O
4、看是否漏掉离子反应。
2、看“=”、“↑”、“↓”等是否正确。
3、看表示各物质的化学式是否正确。 (“拆”原则)
例:Ba(OH)2溶液与硫酸铜溶液反应 Ba2++SO42-==BaSO4
5、看电荷是否守恒,原子是否相等。
例:FeCl2溶液与Cl2反应 Fe2++Cl2==Fe3++2 Cl-
(正确)2Fe2++Cl2==2Fe3+十2Cl-
6、看反应物或产物的配比是否正确。
例:H2SO4与Ba (OH)2溶液反应 H++OH-+SO42-+Ba2+ ==BaSO4↓+H2O
(正确)2H++2OH-+SO42-+Ba2+ ==BaSO4↓+2H2O
7.看是否符合题设条件及要求,如过量、少量、等物质的量、适量、滴加顺序等对反应方式或产物的影响。
根据化学反应方程式书写离子反应方程式
NaOH + HCl = NaCl + H2OKOH + HCl = KCl + H2O2NaOH + H2SO4 = Na2SO4 + 2H2O2KOH + H2SO4 = K2SO4 + 2H2O
H+ + OH- = H2O
酸电离出来的H+与碱电离出来的OH- 结合生成了水。
离子方程式可表示同一类型的离子反应
1、多元弱酸盐与强酸反应
eg: Na2CO3与HCl 反应
2、CO2(SO2)与强碱反应
eg: CO2与Ca(OH)2 反应
四、与量有关的离子方程式书写
例1.少量烧碱滴入Ca(HCO3)2溶液
Ca2++HCO3-+OH-==CaCO3↓+H2O
例2.足量烧碱滴入Ca(HCO3)2溶液
Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
⑴NaHCO3少量时:
⑵ NaHCO3过量时:
Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O
1.NaHCO3溶液与Ca(OH)2溶液混合。
Ba2++SO42-+H++OH-==BaSO4 ↓ +H2O
⑵ KHSO4过量时:
Ba2++SO42-+2H++2OH-==BaSO4↓+2H2O
2.KHSO4溶液与Ba(OH)2溶液混合?
复分解型离子反应发生的条件:
(1)生成沉淀(根据溶解性表)如:AgCl、BaSO4、CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Fe(OH)3、 Fe(OH)2、 Cu(OH)2、CuS等等。(2)放出气体(3)生成弱电解质(难电离物质)弱酸:CH3COOH、HClO、H2SiO3弱碱:NH3 ·H2O水:H2O
离子反应的实质是反应物某些离子浓度减少。
五、离子反应发生的条件
某些离子间的氧化还原反应也是导致离子反应发生的条件。 例:2Fe2++Cl2==2Fe3+十2Cl-
某些离子间的络合反应也是导致离子反应发生的条件。 例:Fe3++3SCN-→[Fe(SCN)3]
离子共存:即溶液中的离子之间不发生化学反应。若发生化学反应则不能共存。
离子不能大量共存的类型
(1)生成沉淀(根据溶解性表)如:AgCl、BaSO4、CaCO3、BaCO3、Mg(OH)2、Al(OH)3、Fe(OH)3、 Fe(OH)2、 Cu(OH)2 、CuS等。(2)放出气体NH4+与OH-;H+与CO32-、HCO3-、S2- 、HS-、SO32-、HSO3-等
(3)生成弱电解质(难电离物质)弱酸:CH3COOH、HClO、H2SiO3弱碱:NH3 ·H2O水:H2O如:H+与Ac-、ClO-、SiO32-等所有弱酸根生成弱酸; OH-与NH4+等所有弱碱的阳离子生成弱碱;H+与OH-生成水
(4)发生氧化还原反应氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存。
(5)发生络合反应: Fe3+ 与 SCN-
⑴溶液无色透明时,则溶液中一定没有有色离子。
常见的有色离子:Cu2+(蓝)、Fe3+(黄)、Fe2+(浅绿)、MnO4-(紫红)、CrO42- (黄色)Cr2O72-(橙色)等
⑵强酸性溶液、PH小于7的溶液或使紫色石蕊变红或甲基橙变红的溶液中含有大量H+能够与H+反应的离子不能存在。如OH-(大量)、HCO3-、HS-、S2-、SO32-、HSO3-、PO43-、HPO42-、H2PO4-、F-、CN-、SiO32- 等不能大量存在
⑶强碱性溶液、PH大于7的溶液、使酚酞变红的溶液中存在大量OH-,则与OH-反应的离子不能存在。如:H+(大量)NH4+、Mg2+、Al3+、Ca2+、Fe3+、Cu2+、Fe2+、HCO3-、HSO3-、H2PO4-、HPO42-
(4)可能呈酸性也可能呈碱性的条件: ① 水电离出的CH+或水电离出的COH-小于10-7ml·L-1的溶液 ②与铝反应放出氢气的溶液
坚持四项“基本原则”(1)肯定性原则:根据现象判断出溶液中肯定存在的离子或一定不存在的离子。如溶液呈现蓝色则一定有Cu2+(2)互斥性原则:在某些离子一定存在时,与之不能共存的离子一定不在。如原溶液存在Cl-则一定不存在Ag+(3)电中性原则:溶液呈电中性有阳离子一定有阴离子,且溶液的正电荷总数和负电荷总数一定相等。如某溶液可能存在K+ Mg2+ Fe3+ Cl- OH- ,若通过现象得出存在OH-则Mg2+ Fe3+ 一定不在,这时 K+ 一定在。(4)进出性原则:通常指在实验过程中引入或生成的离子对后续实验有干扰。
在练习中体会“四项原则”某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:(1)不做任何实验就可以肯定原溶液中不存在的离子是____________。(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是______,有关的离子方程式为____________________。(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有______,有关的离子方程式为_____________________________________。
Ag++Cl-===AgCl↓
2020-2021学年第二节 离子反应优秀课件ppt: 这是一份2020-2021学年第二节 离子反应优秀课件ppt,共30页。PPT课件主要包含了熔融状态,水溶液状态,铜能导电,电解质,电解质与非电解质,非电解质,熔融状态下导电,④⑥⑧,①③④⑤⑨,①②④⑥⑧等内容,欢迎下载使用。
高中化学人教版 (2019)必修 第一册第二节 离子反应课前预习ppt课件: 这是一份高中化学人教版 (2019)必修 第一册第二节 离子反应课前预习ppt课件,共13页。PPT课件主要包含了实验1-3,有白色沉淀产生,Cl-,离子方程式,写出反应的化学方程式,难溶物,弱电解质,氧化物,弱碱水等,NaI2等等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 离子反应精品ppt课件: 这是一份人教版 (2019)必修 第一册第二节 离子反应精品ppt课件,文件包含12离子反应ppt、实验1-2物质的导电性mp4、实验1-3硫酸钠溶液与氯化钡溶液的反应mp4、导课视频手湿不要摸电器水能导电要牢记mp4等4份课件配套教学资源,其中PPT共21页, 欢迎下载使用。













