




高中化学人教版 (新课标)选修4 化学反应原理第二节 影响化学反应速率的因素背景图ppt课件
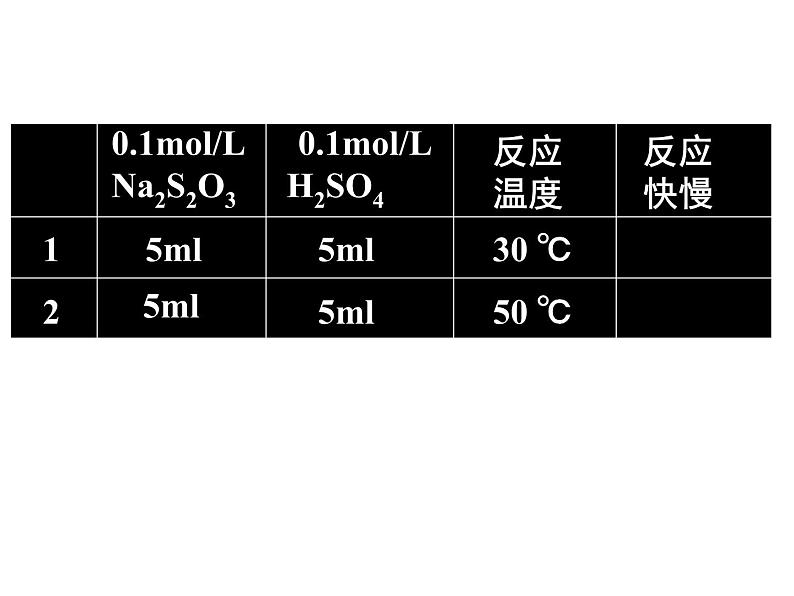
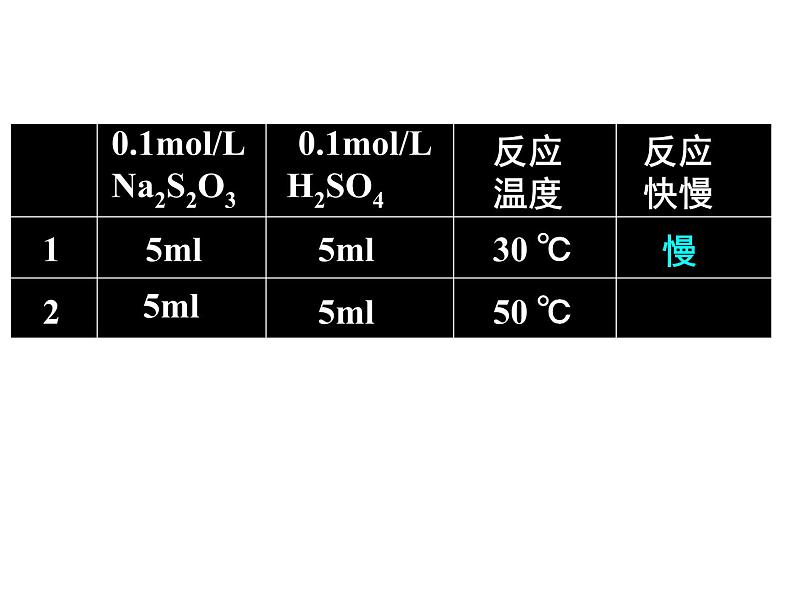
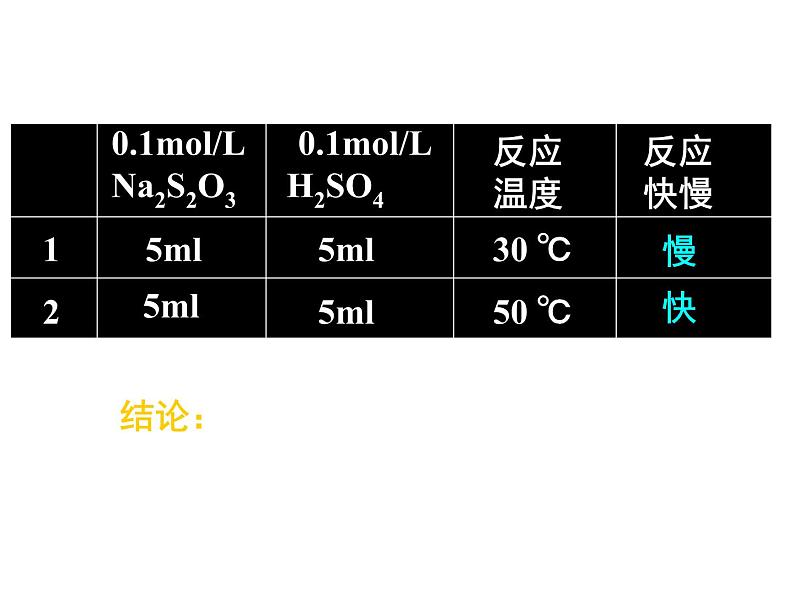
展开[实验目的]探究温度的不同对化学反应速率的影响[实验原理]Na2S2O3+ H2SO4 = Na2SO4+SO2↑+S↓ +H2O[实验用品]试管、胶头滴管、0.1ml/L的H2SO4 溶 液、 0.1ml/LNa2S2O3溶液
三、温度对化学反应速率的影响
1.取两支试管各加入5mL0.1ml/L的 H2SO4; 另取两支试管各加入5mL0.1ml/LNa2S2O3; 2.将四支试管分成两组(各有一支盛有H2SO4和Na2S2O3的试管),将其中一组浸入到热水中,将另一组试管浸入到冷水中; 3.经过一段时间后,分别混合并搅拌,观察现象。
0.1ml/L Na2S2O3
0.1ml/L H2SO4
温度对化学反应速率的影响
结论:其它条件不变,升高温度,反应速率加快;降低温度,反应速率减慢。
升高温度为什么能加快反应速度? (用有效碰撞模型加以解释)
分子运动速率加快,碰撞频率加快
(1)温度对反应速率的影响规律,对吸热反应、放热反应都适用,而且不受反应物状态的影响。 (2)在一般情况下,温度每升高10℃, 化学反应速率增大到2~4倍。
你能举出生活中利用改变温度改变反应速率的例子吗
例. 把除去氧化膜的 Mg 条,投入到盛有稀盐 酸的试管中,发现 H2 的 产生速率(v)与时间(t)的 变化情况如右图所示, t1 ~ t2 速率变化的主要原因是: t2 ~ t3 速率变化的主要原因是:
t1 t2 t3 t
放热反应,体系温度升高
四、催化剂对化学反应速率的影响
[实验目的] 探究催化剂对化学反应速率的影响[实验原理] [实验用品] 见书本22面
2H2O + O2 ↑
使用催化剂,加快化学反应速率。
活化分子 变成生成 物分子放 出的能量
本质原因:其他条件不变时,使用催化 剂,改变反应途径,使发生反应所需的活化能 降低,提高了反应体系中活化分子百分数, 加 入正催化剂,有效碰撞几率提高,反应速率增大.
科学探究 1.双氧水分解 2.高锰酸钾氧化草酸 3.淀粉水解
科学探究1与科学探究3这二个实验说明了什么问题?
科学探究1与科学探究3这二个实验说明了什么问题?你认为催化剂有什么特性?
科学探究1与科学探究3这二个实验说明了什么问题?你认为催化剂有什么特性?催化剂的选择性还存在于哪些方面?
1)同一催化剂能同等程度的改变化学反应的速率。
1)同一催化剂能同等程度的改变化学反应的速率。 2)催化剂只能改变反应速率,不能将不反应变成反应
1)同一催化剂能同等程度的改变化学反应的速率。 2)催化剂只能改变反应速率,不能将不反应变成反应 3)催化剂有一定的选择性和活化温度:
1)同一催化剂能同等程度的改变化学反应的速率。 2)催化剂只能改变反应速率,不能将不反应变成反应 3)催化剂有一定的选择性和活化温度: 4)催化剂中毒:催化剂的活性往往因接触少量杂质而明显下降,甚至遭到破坏,这种现象叫催化剂中毒。催化剂中毒会严重影响反应的顺利进行。工业上为了防止催化剂中毒,要把原料进行净化除去毒物。
五、其他如光照、反应物固体的颗粒大小、电磁波、超声波、溶剂的性质等,也会对化学反应的速率产生影响。
各条件对速率的影响大小是:
各条件对速率的影响大小是: 催化剂 >>温度>浓度=压强(体积变化引起的)。
各条件对速率的影响大小是: 催化剂 >>温度>浓度=压强(体积变化引起的)。 各种影响都有其局限性,要针对具体反应具体分析。
小结:影响化学反应速率的外因
练习:1.对于在溶液间进行的反应,对反应速率影响最小的因素是( ) A. 温度 B. 浓度 C. 压强 D. 催化剂
练习:2.下列条件的变化,是因为降低反应所需的能量而增加单位体积内的反应物活化分子百分数致使反应速率加快的是( ) A. 增大浓度 B. 增大压强 C. 升高温度 D. 使用催化剂
练习:3. 设C+CO2 2CO(正反应吸热)反应速率为v1;N2+3H2 2NH3(正反应放热)反应速率为v2。对于前述反应,当温度升高时,v1和v2变化情况为( ) A. 同时增大 B. 同时减小 C. v1减少,v2增大 D. v1增大,v2减小
练习:4.下列有关说法正确的( ) A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增大 B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增加活化分子的百分数,从而使化学反应速率增大 C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数
练习:5.用3克块状大理石与30毫升3ml/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是①再加入30毫升3ml/L盐酸 ②改用30毫升6ml/L盐酸 ③改用3克粉末状大理石④适当升高温度( ) A. ①②④ B. ②③④ C. ①③④ D. ①②③
练习:6.反应C(s)+H2O(g)=CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )A.增加C的量 B.将容器的体积缩小一半 C.保持体积不变,充入N2使体系压强增大D.保持压强不变,充入N2使容器体积变大
人教版 (新课标)选修4 化学反应原理第二节 影响化学反应速率的因素背景图课件ppt: 这是一份人教版 (新课标)选修4 化学反应原理第二节 影响化学反应速率的因素背景图课件ppt,共13页。PPT课件主要包含了补充练习,压缩体积,体积减小,反应物浓度增大,反应速率增大,22As,Bg+Cg,充气体,科学探究等内容,欢迎下载使用。
2021学年第二节 影响化学反应速率的因素集体备课ppt课件: 这是一份2021学年第二节 影响化学反应速率的因素集体备课ppt课件,共60页。PPT课件主要包含了定向爆破,火箭发射,真空包装,食品冷藏,复习思考一,复习思考二,分子运动,相互碰撞,分子具有足够能量,活化分子等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二节 影响化学反应速率的因素示范课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 影响化学反应速率的因素示范课课件ppt,共60页。PPT课件主要包含了冰箱延长食物保鲜期,反应物浓度降低,H2O2,探究实验,MnO2,实验步骤,催化剂,正催化剂,负催化剂,加快化学反应速率等内容,欢迎下载使用。













