



化学九年级上册第三单元 物质构成的奥秘课题2 原子的结构教学课件ppt
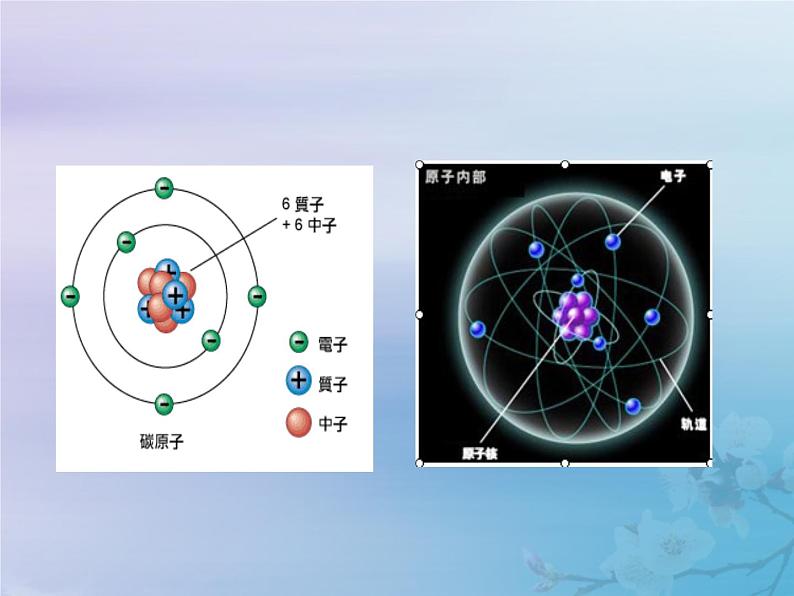
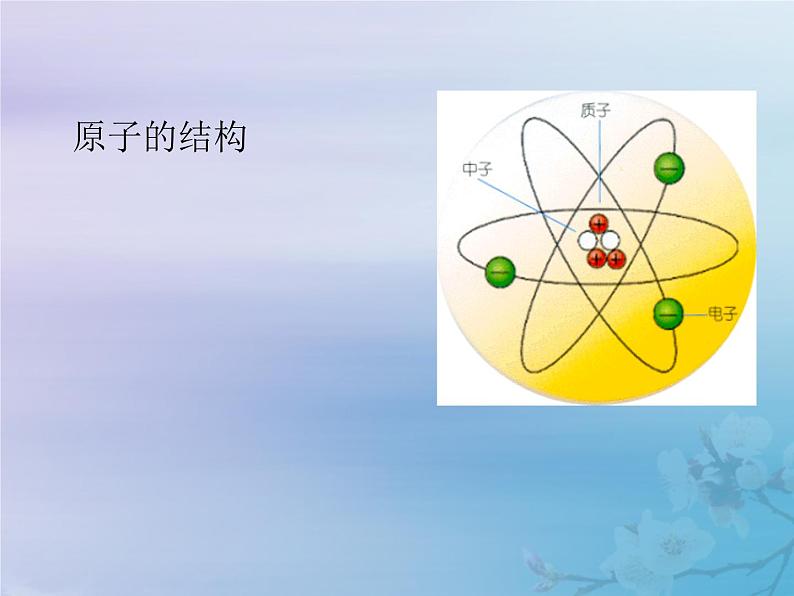
展开第三单元 物质构成的奥秘课题2 原子的结构
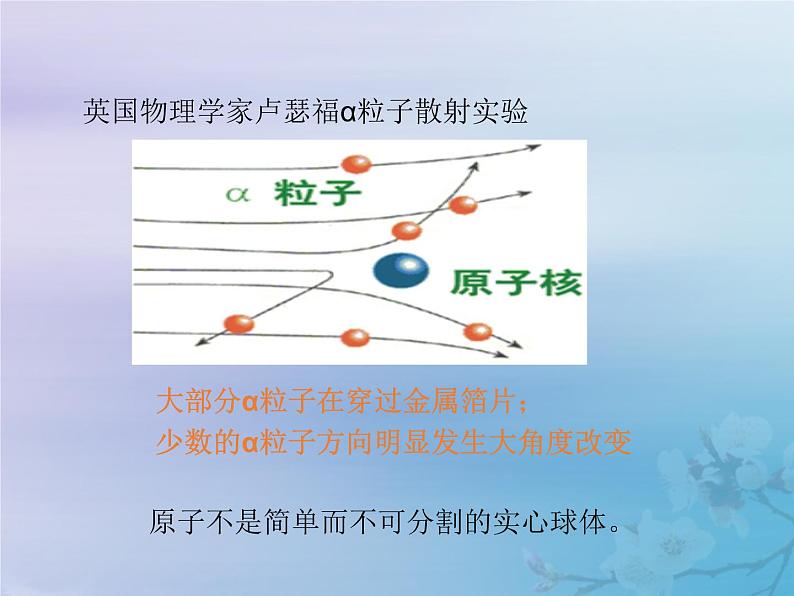
英国物理学家卢瑟福α粒子散射实验
大部分α粒子在穿过金属箔片;少数的α粒子方向明显发生大角度改变
原子不是简单而不可分割的实心球体。
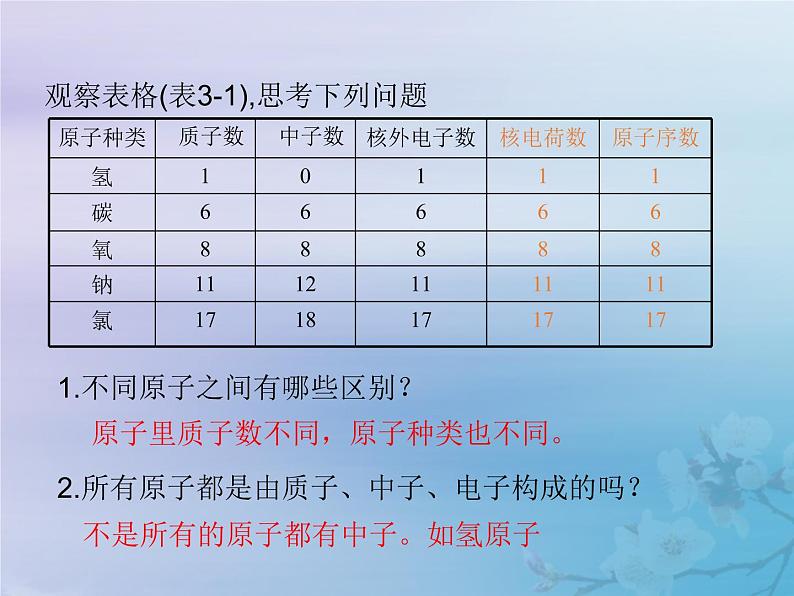
观察表格(表3-1),思考下列问题
1.不同原子之间有哪些区别?
2.所有原子都是由质子、中子、电子构成的吗?
原子里质子数不同,原子种类也不同。
不是所有的原子都有中子。如氢原子
3.质子数、中子数在数量上有什么关系?
4.质子数、电子数、核电荷数、原子序数有什么联系?
质子数不一定等于中子数。
质子数=核外电子数=核电荷数=原子序数
1.原子是由居于原子中心、带_____的原子核和核外带_____的电子构成,原子核是由_____和_____构成。由于它们所带的电荷_____,电性____,所以整个原子_____(填显或不显)电性。 2.能保持物质的化学性质的最小粒子是____;化学变化中的最小粒子是_____;原子中带正电荷的粒子是_ _________;不显电性的粒子有 、 、 。 3.据报道,1994年12月科学家发现了一种新元素,它的原子核内有111个质子, 161个中子,则该元素核外电子数是_____ 。
原子核的半径为原子半径的十万分之一
原子核的体积为原子体积的千亿分之一
所以在原子核外有很大的空间,电子就在这广阔的空间里高速运动。
原子核外的电子是如何运动的?
电子经常出现的区域叫电子层。
二、原子核外电子的排布
1.核外电子是分层排布的
电子层 一 二 三 四 五 六 七
K L M N O P Q
(2)第一层最多排2个,第二层最多排8个;
(3)最外层最多排8个电子(只有一个电子层时最多 2个电子);
(1)先 “里”后“外” (能量最低原则)
2.核外电子分层排布的规律(仅限前3层)
(4)每个电子层最多容纳2n2个电子(n代表电子层数)
画法:画圆圈,标核电,弧线呈扇面,数字一条线。
3.原子结构示意图
例如:O和P的原子结构示意图:
请按以下排列格式画出1~18号元素的原子结构示意图: H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
比一比,看一看你画对了吗?
氢 H 氦He
锂 Li 铍 Be 硼 B 碳 C 氮N 氧O 氟 F 氖Ne
钠Na 镁Mg 铝Al 硅Si 磷P 硫 S 氯Cl 氩Ar
4.元素的性质与原子最外层电子数的关系
【结论】元素的化学性质与原子核外电子的排布,特别是最外层电子数有密切关系。
⑴在同一周期中,从左到右,原子的电子层数相同(核外电子层数等于周期数),最外层电子数依次增大。 ⑵在同一族中,最外层电子数相同但电子层数从上到下依次递增。 ⑶同族元素原子的最外层电子数相同,具有相似的化学性质。
我们学习了原子的结构及原子结构示意图的画法,要熟练掌握1~18号元素的原子结构示意图画法并能灵活运用。【作业】⑴ 及时复习今天的新课内容,预习离子的形成。⑵把1~18号元素的原子结构示意图工整的画到作业本上交。
钠原子最外层有1个电子、氯原子最外层有7个电子,最外层都没有达到相对稳定结构,它们发生化学反应时,怎样才能达到相对稳定结构?
钠+氯气 氯化钠
失去 1个电子
失去 2个电子
失去 3个电子
金属原子 阳离子
得到 1个电子
得到 2个电子
得到 3个电子
非金属原子 阴离子
离子:带电荷的原子或原子团叫做离子。
⑴阳离子:带正电荷的原子或原子团。
⑵阴离子:带负电荷的原子或原子团。
⑴用离子符号来表示离子。
氢离子 钠离子 钾离子 镁离子 铝离子 铵根离子 水合氢离子
H+ Na+ K+ Mg2+ Al3+ NH4+ H3O+
F- Cl- O2- S2-
硝酸根离子 氢氧根离子 碳酸根离子 硫酸根离子
NO3- OH- CO32- SO42-
氟离子 氯离子 氧离子 硫离子
先写出元素符号,再在右上角标明该离子带的电荷数,注意“+”、“-”紧跟在数字后面。
镁离子: Mg2 +;5个硫酸根离子:5 SO42-
1.说出下列离子符号前面的数字和右上角数字的含义。
2O2- 6Na+ 3Al3+ 2Cl-
原 子:质子数 核外电子数
阳离子:质子数 核外电子数
阴离子:质子数 核外电子数
2.说出下列四个符号的含义及完成填空。
阴、阳离子由于静电作用而形成不带电性的离子化合物。可见,离子也是构成物质的离子。
①1个H2中含多少个质子和电子? ②1个H3中含多少个质子和电子? ③1个H3+中含多少个质子和电子? ④1个H3O+中含多少个质子和电子? ⑤1个NH4+中含多少个质子和电子?
1.某元素原子最外层上有2个电子,则此元素﹙ ﹚
A.一定是非金属元素 B.一定是金属元素
C.一定是稀有气体元素 D.以上说法都不正确
2.某元素的原子结构示意图为 ,该元素原子核内有_____个质子,核外共有_____个电子层,最外电子层上有_____个电子,它容易_____(填“得”或“失”)电子,形成_____(填“阴”或“阳”)离子。
3.某粒子的结构示意图如图所示,则m= ,n= , x= 。该粒子是 (填粒子的化学符号)。
4.某粒子的结构示意图如图所示,若该粒子带2个单位负电荷,它的化学符号是 ;若该粒子带2个单位正电荷,它的化学符号是 ;若该粒子不显电性,它的化学符号是 。
四、相对原子质量(Ar)
阅读上表 (表3-2),能得出什么结论?
1.质子和中子的质量很小且很接近,但比电子大很多。
2.整个原子的质量主要集中在原子核上。
一个氢原子的质量是:0.00000000000000000000000000167千克即1.67×10-27千克一个碳原子的质量是:0.00000000000000000000000001992千克即1.992×10-26千克
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27kg)为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量
标准碳原子质量的1/12 (kg)
(1)“相对原子质量”是一个比值;(2)“相对原子质量”单位为“ 1 ”,可省略。
质子、中子的相对质量约为:1氢原子的相对原子质量约为:1氧原子的相对原子质量约为:16
核电荷数=质子数=核外电子数
相对原子质量≈质子数+中子数
阅读上表 (表3-4),能得到什么信息?
化学九年级上册课题2 原子的结构课文ppt课件: 这是一份化学九年级上册课题2 原子的结构课文ppt课件,共20页。PPT课件主要包含了知识回顾,H2O,原子结构示意图,原子的构成,核电荷数质子数,原子核,核外电子,几种原子的构成,小题巧练,你知道吗等内容,欢迎下载使用。
初中化学人教版九年级上册课题2 原子的结构图片课件ppt: 这是一份初中化学人教版九年级上册课题2 原子的结构图片课件ppt,共44页。PPT课件主要包含了分子和原子的性质,知识回顾,构成物质的粒子,化学变化中的最小粒子,构成物质的微粒,引起质疑,学习目标,假说→科学,汤姆森的原子结构模型,原子的构成等内容,欢迎下载使用。
人教版九年级上册课题2 原子的结构示范课ppt课件: 这是一份人教版九年级上册课题2 原子的结构示范课ppt课件,共48页。PPT课件主要包含了带正电,带负电,答案整理,课堂练习,③④⑤,①②④,你知道吗,离核远近,能量高低,原子核等内容,欢迎下载使用。












