




初中化学人教版九年级上册课题2 原子的结构教课课件ppt
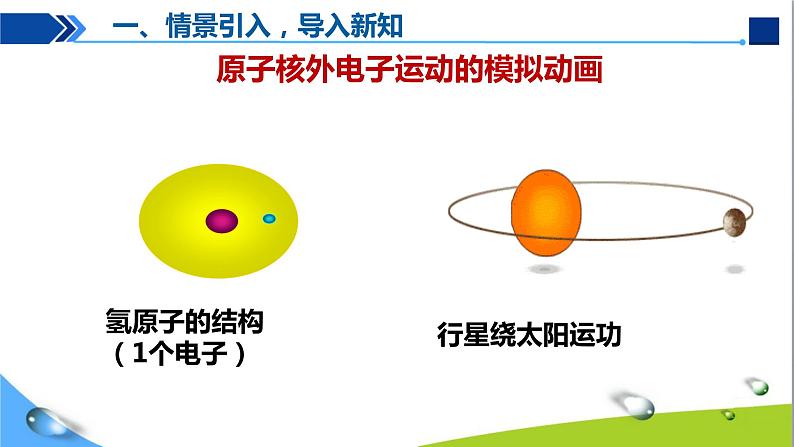
展开氢原子的结构(1个电子)
原子核外电子运动的模拟动画
一、情景引入,导入新知
原子核外电子排布有什么规律?
二、自主学习,发现疑问
原子结构示意图表示哪些意义?
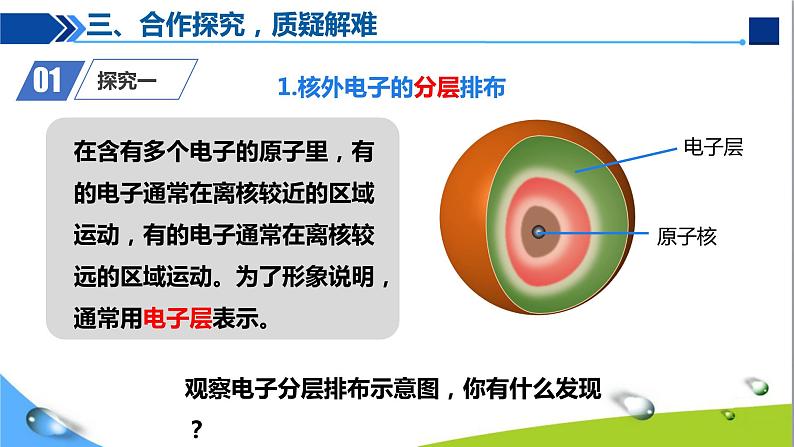
观察电子分层排布示意图,你有什么发现?
1.核外电子的分层排布
三、合作探究,质疑解难
电子层: 离核远近: 能量高低:
一 二 三 四 五 六 七
低 高
近 远
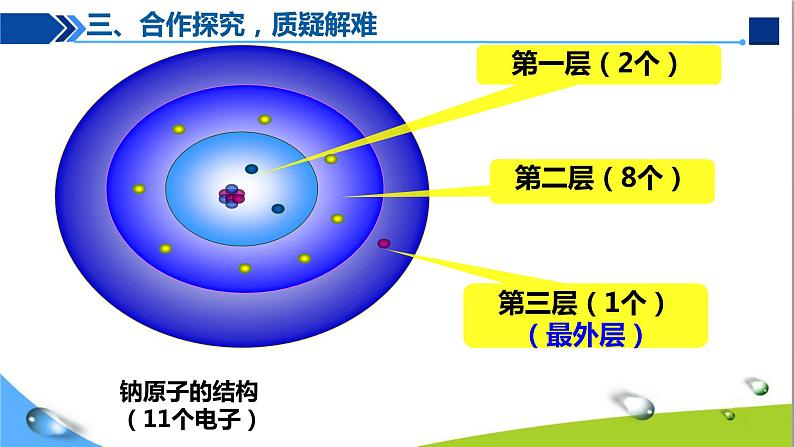
离核最远的电子层叫作最外层,最外层电子数不超过 8 个;只有一层的,电子数不超过 2 个。
第三层(1个)(最外层)
钠原子的结构(11个电子)
2.下列原子结构示意图是否正确?如有错误,指出错误的原因,并画出正确的原子结构示意图。
1.某原子结构示意图如图:则该原子核电荷数为 ,核外有 个电子,第二层上有 个电子,最外层有 个电子。
观察课本P54的原子结构示意图,思考它们的原子结构有何特点?
金属原子:最外层电子数一般少于4个
非金属原子:最外层电子数一般等于或多于4个
稀有气体原子:最外层电子数等于8个(氦原子除外,最外层电子数为2)
既不得电子,也不失电子
1.原子的最外层电子数决定原子的化学性质2.通常,原子最外层电子数相同,化学性质就相似
相对稳定结构:最外层排满的结构,即最外层为8个电子(氦为两个电子)
易得电子的原子的是 ;
(2)易失电子的原子的是 ;
(1)具有相对稳定结构的是 (填序号,下同);
(4)属于稀有气体原子的是 。
1.根据下列原子的结构示意图,回答下列问题:
(3)化学性质相似的是 ;
多数金属原子容易失去电子,非金属原子容易得到电子,那么原子失去/得到电子之后变成了什么?
1.带电的原子或原子团,叫做离子
带正电的原子,叫阳离子
带负电的原子,叫阴离子
在元素符号的右上角标明离子所带电荷的电性和数目;
数字在前,正负号在后,若数字为1,必须省略不写。
铝离子:带3个单位正电荷:
镁离子:带2个单位正电荷:
钠离子:带1个单位正电荷:
氧离子:带2个单位负电荷:
氯离子:带1个单位负电荷:
硫离子:带2个单位负电荷:
质子数 电子数
拓展:除单个原子带电形成离子外,带电的原子团也形成离子,又叫“根”。
原子团:2个或2个以上的原子集合在一起形成的一个整体。
离子所带电荷数等于原子失去或得到的电子数
1个氯离子带1个单位负电荷
1个铝离子带3个单位正电荷
1.区别(比较质子数与电子数)(1)原子:质子数 电子数(2)离子:质子数 电子数(3)阳离子:质子数 电子数(4)阴离子:质子数 电子数
氯化钠:由Na+、Cl-构成,Na+、Cl-数目比为1:1
氯化钠是由氯化钠离子构成。( )
氯化钠是由离子构成。( )
1.请你说说下列两种原子是如何变成对应离子的,并写出对应的离子符号
原子形成离子:(1)失为正,得为负; (2)得失电子数=电荷数
2.如图是五种粒子的结构示意图,下列说法错误的是( )
A.表示原子的是①③④ B.表示阴离子的是③⑤C.具有相对稳定结构的是②③⑤ D.④表示的粒子在化学反应中易失去电子
最外层排满,8电子结构
最外层<4个,即1、2、3
1.核外电子是 排布的,最多有七个电子层,离核最近的电子层为 ,最多容纳 个电子;离核最远的电子层又叫 ,电子数不超过 个。
四、要点回放,夯实基础
2.稀有气体的原子最外层一般是 个电子(氦原子最外层 个电子),属于 ;金属原子最外层电子数一般 ,在化学反应中易 电子;非金属原子最外层电子数一般 ,在化学反应中易 电子。3. 的原子叫离子。带 电的原子是阳离子,如 Na+等。带 电的原子是阴离子,如Cl-等。
原子核外电子的排布、离子的形成
原子的性质与最外层电子数的关系
五、课堂归纳,点拨提升
六、目标检测,检查效果
知识点一原子核外电子的排布1.月球上含有丰富的氨3(质子数为 2中子数为 1的原子)。下列原子结构示意图为氮 3 原子的是( )
2.下列四种粒子的结构示意图中,属于金属原子的是( )
3.如图为钠的原子结构示意图,从图中可获得的信息是( ) A.钠原子的核外第一层有 1个电子 B.钠原子在化学反应中容易失去 1个电子 C.钠原子核内的质子数为 11、中子数为 0 D.钠原子的核外有 2 层电子
知识点二离子的形成4.下列粒子结构示意图中,表示阴离子的是( )
5.下列说法中正确的是( )A.结构示意图为 的粒子一定是氖原子 B.M2+的核电荷数是12,则其核外电子数为14C.Na和Na+的化学性质相同 D.原子变成离子时,得失电子都有可能
6.下列几种粒子的结构示意图,有关它们的叙述正确的是( )
A.②表示的是阴离子 B. ①③所表示的粒子化学性质相似C.③是金属原子的结构D. D.①表示的是阳离子
7.对镁原子和镁离子这两种粒子的判断中,正确的是( )①核电荷数相等 ②核外电子数相等 ③电子层结构完全相同④质量几乎相等 ⑤等质量的两种微粒含有的质子数相等 A.①④⑤ B.①③⑤ C.①②③④⑤ D.②③④
8.推理是学习化学常用的思维方法,下列推理正确的是( ) A.原子通过得失电子形成离子,故离子也能通过失得电子 变成原子 B.阳离子带正电,故带正电的微粒一定是阳离子 C.原子是化学变化中最小的微粒,故原子不可再分 D.原子核由质子和中子构成,故所有原子都含有质子和中子
9. 根据下图所示的粒子结构示意图,回答问题:
① ② ③ ④ ⑤ ⑥
(1)属于相对稳定结构的是_________;(2)核电荷数相同的的是______;(3)在反应中易失电子的是_____,易得电子的是_____;(4)属于原子的是____________,属于阳离子的是______;属于阴离子的是______;
10.在宏观、微观和符号之间建立联系是化学学科的重要思维方式。根据如图所示的粒子结构示意图,回答问题(1)ABCE中属于阳离子的是 (填离子符号),粒子 A的名称是 。(2)若D表示某原子,则 m= ,该粒子在化学变化中容易 (选填“得到”或“失去”)电子。(3)若 D为离子,则D的离子符号为 ,由B和D相互作用形成的物质为 , 该物质由 (选填“分子”“原子”或“离子”)构成。
11.根据下列原子结构示意图,判断微粒化学性质相似的是( ) A.①③ B.②③ C.①④ D.③④
误认为最外层电子数相同的微粒化学性质一定相似
人教版九年级上册课题2 原子的结构背景图课件ppt: 这是一份人教版九年级上册课题2 原子的结构背景图课件ppt,共35页。
化学人教版课题2 原子的结构教学ppt课件: 这是一份化学人教版课题2 原子的结构教学ppt课件,共30页。PPT课件主要包含了48cm,知识点1原子的构成,“电子云”模型,不带电,原子的内部结构,核电荷数,原子对外不显电性,即电中性,氢原子没有中子,典例1等内容,欢迎下载使用。
化学课题2 原子的结构教学课件ppt: 这是一份化学课题2 原子的结构教学课件ppt,共29页。PPT课件主要包含了知识点1离子,阳离子,阴离子,阳离子+,失电子,阴离子-,得电子,离子的表示方法,离子符号的意义,Mg2+等内容,欢迎下载使用。














