初中化学人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构教课内容ppt课件
展开考点一原子的构成1.原子的结构2.构成原子的各粒子之间的关系(1)数量关系:核电荷数=质子数=核外电子数(与中子数无关)。(2)质量关系:组成原子核的质子和中子的质量相差不大,都比电子的质量大得多,原子的质量主要集中在原子核上。(3)体积关系:原子核的体积很小,原子核外有很大的空间。
易错提醒:(1)原子核内的质子数不一定等于中子数,如钠原子的质子数为11,中子数为12。(2)并不是所有的原子中都有中子,如普通氢原子中没有中子。(3)在原子中,虽然存在带电的粒子,但原子整体上不显电性。
例1 19世纪与20世纪之交,物理学中的放射现象和电子的先后被发现,不仅将人们的视线引入了原子核的内部,而且驱使人类更进一步地积极探索原子核的内部组成。某学习小组的同学在关于原子和原子核的讨论中,有以下四种说法:①原子是由居于原子中心的原子核和核外电子构成的②带负电的电子在原子核外空间里绕核运动③原子的全部正电荷和全部质量都集中在原子核里④原子核都是由质子和中子构成的,质子的个数一定不等于中子的个数其中正确的是( )A.①②B.①③C.①②③D.②④
解析:原子是由居于原子中心的带正电荷的原子核和核外带负电荷的电子构成的,电子绕着原子核作高速运动,①②正确;原子的全部正电荷都集中在原子核里,但就其质量而言,由于电子的质量很小,所以其质量主要由原子核的质量决定,而不是全部都集中在原子核里;原子核由质子和中子构成,但并不是所有原子核中都有中子,如普通氢原子内只有质子,没有中子,而且有的原子中质子数等于中子数,因此③④不正确。答案:A
考点二原子核外电子的排布1.电子能量、离核远近与电子层的关系
2.原子结构示意图(以氧原子为例)
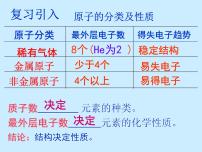
3.原子的性质与其结构的关系
易错提醒:(1)最外层电子数为8的结构是相对稳定结构,但达到相对稳定结构的原子最外层电子数不一定是8,如氦原子最外层电子数为2,也是相对稳定结构(它只有一个电子层)。(2)一般来讲,金属原子的最外层电子数小于4,但最外层电子数小于4的原子不一定是金属原子,如氦原子、氢原子。(3)原子的化学性质与最外层电子数关系密切,但是最外层电子数相同的原子化学性质不一定相似,如氦与镁;化学性质相似的原子最外层电子数也不一定相同,如氦与氖。
例2 (2015·湖南娄底中考)据《自然》杂志报道,科学家最近研究出一种以锶(Sr)做钟摆的钟,它是世界上最精确的钟,锶的原子结构示意图如图所示,请回答:(1)锶原子的核电荷数为 。 (2)锶原子核外电子层数为 。 (3)锶原子最外层容易 (填“得”或“失”)电子。 解析:(1)由锶的原子结构示意图可知,锶原子的质子数是38,即核电荷数为38;(2)由锶的原子结构示意图可知,锶原子核外电子层数为5;(3)由锶的原子结构示意图可知,最外层电子数为2,小于4,在发生化学反应时,易失去2个电子形成带2个单位正电荷的离子。答案:(1)38 (2)5 (3)失
名师点题解答此类题目应明确原子结构示意图各部分表示的意义,并通过分析图示中最外层电子数的特点得出原子的化学性质。
延伸拓展:1.离子的写法及符号、数字的意义(1)离子的表示方法:在元素符号右上角标明离子所带的电荷数及电性,数值在前,正、负号在后。离子所带电荷数为1时,“1”省略不写,如Na+、Zn2+。(2)离子符号前面的数字表示离子的个数;元素符号右上方的数字表示一个离子所带的电荷数。
2.原子和离子的区别
例3 (2015·辽宁丹东中考改编)根据下列粒子的结构示意图,回答问题: (1)具有相对稳定结构的是 ; (2)属于阴离子的是 ; (3)属于金属原子的是 ; (4)C粒子的符号为 。
解析:(1)最外层电子数为8的结构称之为相对稳定结构(最外层为第一层时2个电子就达到稳定结构)。(2)阴离子是原子得到电子形成的,核内质子数<核外电子数,故选C。(3)在原子中质子数=核外电子数,最外层电子数小于4,多为金属原子,大于4多为非金属原子。(4)C粒子是原子得到1个电子形成的,带1个单位的负电荷,故为F-。答案:(1)ACD (2)C (3)BE (4)F-
考点四相对原子质量1.定义以一种碳原子质量的 为标准,其他原子的质量跟它相比较所得到的比。2.表达式3.近似计算相对原子质量≈质子数+中子数。
归纳总结:原子的质量与相对原子质量的比较
一、分子、原子、离子的区别和联系典例1 (2015·湖北宜昌中考)下列关于微观粒子的说法正确的是( )A.只有离子能构成物质B.分子之间有间隔,原子之间没有间隔C.分子和原子都在不断运动D.分子和原子在化学变化中都能够再分解析:分子、原子、离子都可以构成物质,A项错误;分子之间有间隔,原子之间也有间隔,B项错误;分子和原子都在不断运动,C项正确;分子在化学变化中能够再分,原子在化学变化中不能够再分,D项错误。答案:C
方法点拨分子、原子、离子的区别和联系 (1)联系: (2)区别:①在化学变化中,分子可分裂成原子,原子重新结合成新分子。②分子、原子对外不显电性,离子带正电或负电。
二、粒子结构示意图的识别及应用典例2 (2015·湖南株洲中考)下图中A、B、C、D是四种粒子的结构示意图。请回答下列问题:(1)A中x= ;A粒子的符号是 。 (2)由B粒子的结构示意图可知,B粒子的名称是 。 (3)以上四种结构示意图所表示的粒子中,表示离子的是 (填字母代号)。
解析:(1)A粒子核外第一层上应有2个电子,即x=2;A粒子质子数=16,核外电子数=18,质子数<核外电子数,为带2个单位负电荷的硫离子,其离子符号为 。(2)由B粒子的结构示意图可知,质子数=核外电子数=13,为铝原子。(3)由C、D粒子的结构示意图可知,C粒子的质子数=核外电子数=8,为氧原子;D粒子的质子数=9,核外电子数=10,质子数<核外电子数,为氟离子。答案:(1)2 (2)铝原子 (3)AD
方法点拨判断粒子结构示意图的方法 看质子数和电子数的关系,若质子数等于电子数,则为原子,若不相等,则为离子,若质子数>电子数,为阳离子,若质子数<电子数,则为阴离子。
对原子构成的理解的误区典例 原子的构成示意图如图,下列叙述正确的是( )A.原子是实心球体B.质子、中子、电子均匀分布在原子中C.质子与电子质量相等D.整个原子的质量主要集中在原子核上
初中化学人教版九年级上册课题2 原子的结构教课课件ppt: 这是一份初中化学人教版九年级上册课题2 原子的结构教课课件ppt,共38页。PPT课件主要包含了C和D等内容,欢迎下载使用。
初中化学人教版九年级上册课题2 原子的结构多媒体教学ppt课件: 这是一份初中化学人教版九年级上册课题2 原子的结构多媒体教学ppt课件,文件包含课时2离子相对原子质量pptx、课时1原子的构成原子核外电子排布pptx等2份课件配套教学资源,其中PPT共45页, 欢迎下载使用。
人教版九年级上册课题2 原子的结构示范课ppt课件: 这是一份人教版九年级上册课题2 原子的结构示范课ppt课件,共48页。PPT课件主要包含了带正电,带负电,答案整理,课堂练习,③④⑤,①②④,你知道吗,离核远近,能量高低,原子核等内容,欢迎下载使用。