人教版 (新课标)选修4 化学反应原理第一节 原电池同步练习题
展开A.在外电路中电子由正极流向负极B.在原电池中负极发生还原反应
C.阳离子向正极方向移动D.原电池中正极一定是不活泼金属
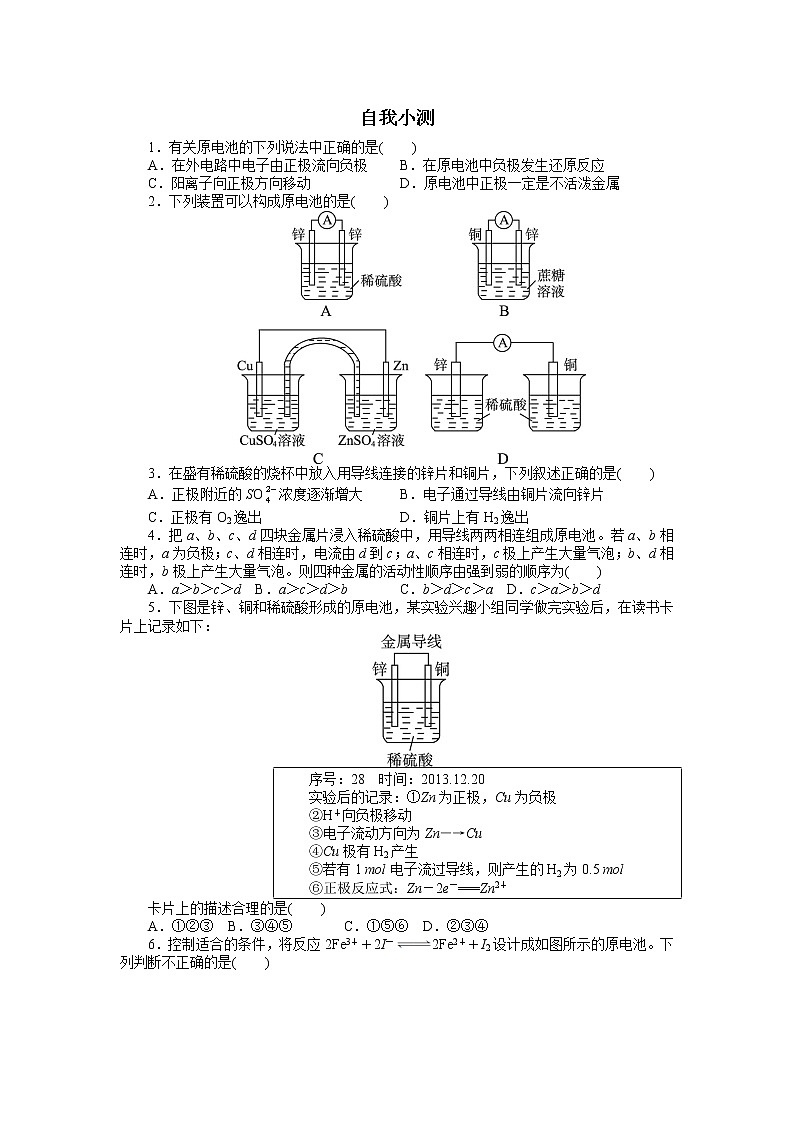
2.下列装置可以构成原电池的是( )
3.在盛有稀硫酸的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO浓度逐渐增大B.电子通过导线由铜片流向锌片
C.正极有O2逸出D.铜片上有H2逸出
4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡;b、d相连时,b极上产生大量气泡。则四种金属的活动性顺序由强到弱的顺序为( )
A.a>b>c>d B.a>c>d>bC.b>d>c>a D.c>a>b>d
5.下图是锌、铜和稀硫酸形成的原电池,某实验兴趣小组同学做完实验后,在读书卡片上记录如下:
序号:28 时间:
实验后的记录:①Zn为正极,Cu为负极
②H+向负极移动
③电子流动方向为Zn―→Cu
④Cu极有H2产生
⑤若有1 ml电子流过导线,则产生的H2为0.5 ml
⑥正极反应式:Zn-2e-===Zn2+
卡片上的描述合理的是( )
A.①②③ B.③④⑤C.①⑤⑥ D.②③④
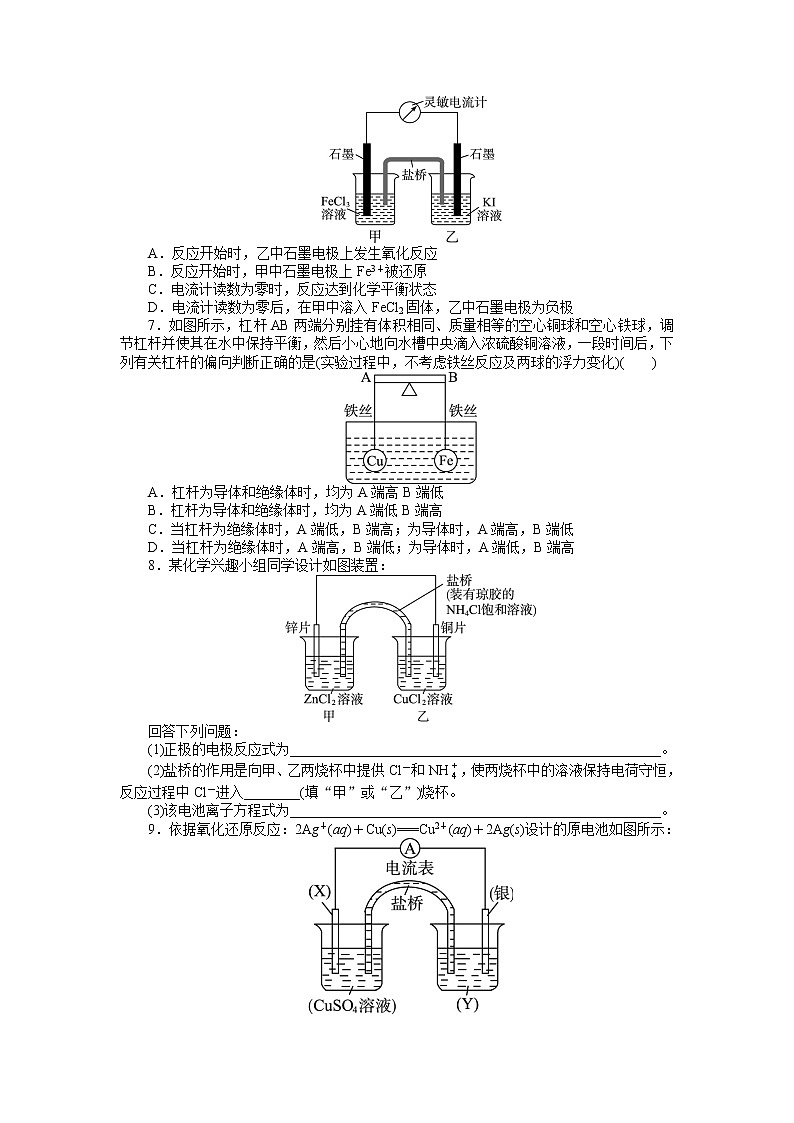
6.控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
7.如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中央滴入浓硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( )
A.杠杆为导体和绝缘体时,均为A端高B端低
B.杠杆为导体和绝缘体时,均为A端低B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
8.某化学兴趣小组同学设计如图装置:
回答下列问题:
(1)正极的电极反应式为_____________________________________________________。
(2)盐桥的作用是向甲、乙两烧杯中提供Cl-和NH,使两烧杯中的溶液保持电荷守恒,反应过程中Cl-进入________(填“甲”或“乙”)烧杯。
(3)该电池离子方程式为_____________________________________________________。
9.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示:
请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是______。
(2)银电极为电池的________极,发生的电极反应为________________________;X电极上发生的电极反应为________________________。
(3)外电路中的电子是从________电极流向______电极。
10.某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6 ml·L-1稀硫酸中,乙同学将电极放入6 ml·L-1的NaOH溶液中,如图所示。
(1)写出甲池中发生的有关电极反应式:
负极_______________________________________________________________________,
正极_______________________________________________________________________。
(2)乙池中负极为________。正极发生________反应,总反应离子方程式为____________________________。
(3)如果甲与乙两位同学均认为“构成原电池的电极材料若是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(4)由此实验,可得到如下哪些结论?________。
A.利用原电池反应判断金属活动性顺序应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应条件多变,应具体问题具体分析
(5)上述实验也反过来证明了“利用金属活动性顺序直接判断原电池中正负极”,这种做法________(填“可靠”或“不可靠”)。如不可靠,则请你提出另一个判断原电池正负极可行的实验方案__________________________________________。
参考答案
1. 解析:在外电路中,电子从负极流向正极;原电池中负极发生氧化反应;随着反应的进行,阳离子在正极被还原,所以电解质溶液中的阳离子向正极移动;原电池中一般正极金属比负极金属活泼性差,但不一定是不活泼金属。
答案:C
2. 解析:原电池构成的三个条件是:活泼性不同的两个电极,A错误;电解质溶液,B错误;构成闭合回路,D错误;C满足这三个条件。
答案:C
3. 解析:题干所述装置属于原电池装置,负极反应式:Zn-2e-===Zn2+,正极反应式:2H++2e-===H2↑,电子由负极流出经过外电路流向正极。为形成闭合回路,溶液中的阴离子向负极迁移,阳离子向正极移动。因此可知选项D正确。
答案:D
4. 解析:a、b相连时,a为负极,因较活泼金属为负极,故活动性a>b;c、d相连,电流由d到c,则c为负极,活动性c>d;a、c相连,c极产生大量气泡,说明H+在c极得电子生成H2,发生还原反应,c为正极,则活动性a>c;同理活动性d>b;由此可知a、b、c、d四种金属的活动性顺序由强到弱的顺序为a>c>d>b。
答案:B
5. 解析:构成原电池的正极是Cu,负极是Zn,故①错误;电子从负极Zn流出,流向正极Cu,H+向正极移动,在Cu上得电子:2H++2e-===H2↑,故②错误,③④正确;此原电池负极上发生的反应是Zn-2e-===Zn2+,⑥错误;总反应方程式:Zn+2H+===Zn2++H2↑,当有1 ml电子通过时,产生H2为0.5 ml,故⑤正确。
答案:B
6. 解析:由总反应方程式知,I-失去电子(氧化反应),Fe3+得电子(被还原),故A、B项正确。当电流计读数为零时,即说明没有电子发生转移,可证明反应达平衡,C项正确。加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,甲中石墨作负极,D项错误。
答案:D
7. 解析:若杠杆为导体则构成原电池,铁作负极失电子而溶解:Fe-2e-===Fe2+,溶液中Cu2+在正极(铜极)得电子生成铜,质量增大而下降,A端低,B端高;若杠杆为绝缘体,则铁球和CuSO4溶液发生置换反应生成Cu覆于表面,质量增加,下降,A端高,B端低。
答案:D
8. 解析:该装置是带盐桥的原电池装置,Zn+Cu2+===Zn2++Cu,正极反应为Cu2++2e-===Cu,由于甲中锌离子过剩,所以氯离子进入甲中保持电中性。
答案:(1)Cu2++2e-===Cu
(2)甲
(3)Zn+Cu2+===Zn2++Cu
9. 解析:由电池反应2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)可知:Cu-2e-===Cu2+发生氧化反应,所以负极材料必须选择Cu。
答案:(1)Cu AgNO3溶液
(2)正 Ag++e-===Ag Cu-2e-===Cu2+
(3)铜 银
10. 解析:(1)甲池中电池总反应方程式为Mg+H2SO4===MgSO4+H2↑,Mg作负极,电极反应式为:Mg-2e-===Mg2+,Al作正极,电极反应式为:2H++2e-===H2↑。
(2)乙池中电池总反应方程式为:2Al+2NaOH+2H2O===2NaAlO2+3H2↑,所以负极为Al,正极为Mg,正极上发生还原反应。
(3)甲池中Mg为负极,Al为正极;乙池中Al为负极,Mg为正极,若根据负极材料金属比正极活泼,则甲判断Mg活动性强,乙判断Al活动性强。
(4)选A、D。Mg的金属活动性一定比Al强,金属活动性顺序是正确的,应用广泛。
(5)判断正负极可根据回路中电流方向或电子流向等进行判断,直接利用金属活动性顺序判断原电池的正负极是不可靠的。
答案:(1)Mg-2e-===Mg2+ 2H++2e-===H2↑
(2)Al 还原 2Al+2OH-+2H2O===2AlOeq \\al(-,2)+3H2↑
(3)Mg Al
(4)AD
(5)不可靠 根据电路中电流的方向或电子转移的方向
2022年高三化学寒假自我小测:40原电池(二) Word版含解析: 这是一份2022年高三化学寒假自我小测:40原电池(二) Word版含解析,共5页。试卷主要包含了有关原电池的下列说法中正确的是,下列装置可以构成原电池的是,某化学兴趣小组同学设计如图装置,依据氧化还原反应等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第二章 化学反应速率和化学平衡第一节 化学反应速率课时训练: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二章 化学反应速率和化学平衡第一节 化学反应速率课时训练,共4页。
化学选修4 化学反应原理第二章 化学反应速率和化学平衡第一节 化学反应速率当堂达标检测题: 这是一份化学选修4 化学反应原理第二章 化学反应速率和化学平衡第一节 化学反应速率当堂达标检测题,共7页。试卷主要包含了反应,经2minB的浓度减少0,8ml·L-1·s-1,将5,把0,已知反应等内容,欢迎下载使用。













