






人教版 (2019)必修 第一册第二节 氯及其化合物授课ppt课件
展开1.与氢氧化钠溶液反应——制取漂白液(1)制取反应的化学方程式: 。(2)离子方程式: 。(3)漂白液的有效成分是 。
Cl2+2NaOH===NaCl+NaClO+H2O
Cl2+2OH-===Cl-+ClO-+H2O
2.与石灰乳反应——制取漂白粉(1)制取反应的化学方程式: 。(2)漂白粉的主要成分是 ,有效成分是 ,漂粉精的主要成分是 。(3)漂白粉的漂白原理:利用复分解反应原理,漂白粉中的 与酸(如盐酸或碳酸等)反应生成具有漂白性的 。(4)漂白粉长期露置于空气中,最终会生成氯化钙而失效,有关反应的化学方程式:① ;② ;③ 。
2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O
CaCl2、Ca(ClO)2
Ca(ClO)2+H2O+CO2===CaCO3↓+2HClO
CaCO3+2HCl===CaCl2+H2O+CO2↑
(1)氯气的溶解度不大,而且生成的次氯酸很不稳定,不便于保存,而次氯酸盐性质稳定,常用氯气与碱反应制取漂白粉。(2)漂白粉在空气中保存不当会变质。因此漂白粉和漂粉精的保存方法是密封、避光并置于阴凉干燥处。
例1 在抗震救灾中要用大量漂白粉和漂白液杀菌消毒。下列说法中正确的是A.漂白粉是纯净物,漂白液是混合物B.漂白粉的有效成分是Ca(ClO)2C.工业上将氯气通入澄清石灰水制取漂白粉D.漂白液的有效成分是Na2O2
解析 漂白粉的主要成分是氯化钙和次氯酸钙,有效成分是次氯酸钙,是混合物;漂白液的主要成分是氯化钠和次氯酸钠,有效成分是次氯酸钠,是混合物。
例2 用漂白粉溶液浸泡过的有色布条晾置在空气中一段时间,漂白效果更好,原因是A.漂白粉被氧化了B.有色布条被空气中的氧气氧化了C.漂白粉跟空气中的CO2充分反应,生成了较多量的HClOD.漂白粉溶液蒸发掉部分水,其浓度增大
解析 晾置在空气中一段时间漂白效果更好是因为漂白粉跟空气中的CO2充分反应,生成较多量的HClO。
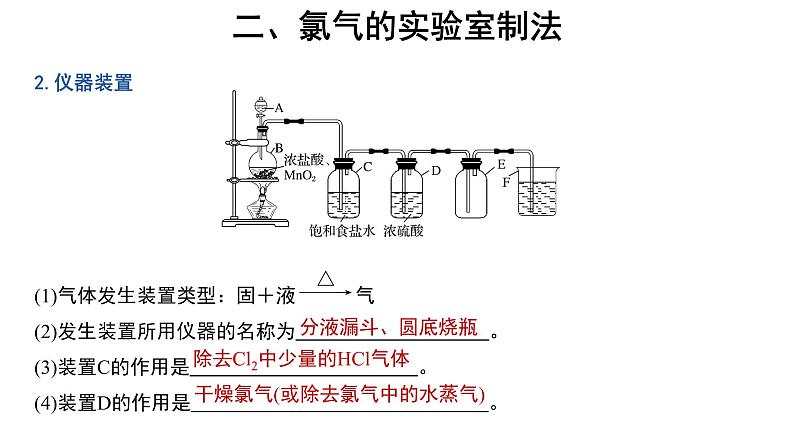
1.反应原理实验室常用强氧化剂(如MnO2、KMnO4等)氧化浓盐酸等来制取氯气:
2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
(1)气体发生装置类型:固+液 气(2)发生装置所用仪器的名称为 。(3)装置C的作用是 。(4)装置D的作用是 。
除去Cl2中少量的HCl气体
干燥氯气(或除去氯气中的水蒸气)
3.收集方法(1)向上排空气法(氯气密度大于空气)。(2)排饱和食盐水法(氯气在饱和氯化钠溶液中的溶解度很小,用此法可除去实验中挥发产生的氯化氢气体)。4.验满方法(1)将湿润的淀粉碘化钾试纸靠近盛氯气的瓶口,观察到试纸立即变蓝,则证明已集满。(2)将湿润的蓝色石蕊试纸靠近盛氯气的瓶口,观察到试纸立即发生先变红后褪色的变化,则证明已集满。
5.尾气处理(1)仪器装置图中烧杯F中盛放的液体是 。(2)该液体的作用是 。
吸收过量的氯气,防止污染环境
例3 某化学兴趣小组利用MnO2和浓盐酸及如图装置制备Cl2。下列分析中不正确的是
A.①中可用分液漏斗代替长颈漏斗B.①中缺少加热装置C.②中盛放的NaOH溶液可以净化氯气D.④中盛放的NaOH溶液可以吸收尾气
解析 A中可用分液漏斗代替长颈漏斗,避免盐酸挥发,气体逸出,同时便于控制反应速率,A正确;二氧化锰和浓盐酸需要加热才能反应生成氯气,需要添加加热装置,B正确;NaOH溶液吸收氯气,不能净化Cl2,可以用饱和食盐水净化氯气,C错误;氢氧化钠溶液与氯气反应,可以吸收氯气,防止污染空气,D正确。
(1)写出二氧化锰与浓盐酸反应的化学方程式:________________________________________。(2)在该反应中,HCl充当的是_______(填“氧化剂”或“还原剂”)。
例4 如图所示装置可用于二氧化锰与浓盐酸在加热条件下制取氯气,并利用产物进行后续实验,请填写下列空白:
4HCl(浓)+MnO2 MnCl2+Cl2↑
(3)洗气瓶B中盛有饱和食盐水,洗气瓶C中盛有品红溶液,在洗气瓶D中放有石灰乳,则C瓶中观察到的现象是______________;D瓶中发生反应的化学方程式是_________________________________________。(4)若反应产生了标况下11.2 L的氯气,则参与氧化还原反应的HCl的物质的量是___ml。
2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
(1)稀盐酸与MnO2不反应,制取氯气时必须选用浓盐酸;加热温度不宜过高,以减少氯化氢的挥发。(2)制取的氯气有毒,且在加热时容易逸出,所以应选用分液漏斗,而不用长颈漏斗。(3)尾气处理时,不能用澄清石灰水吸收氯气,因为澄清石灰水中Ca(OH)2含量少,吸收不完全。(4)实验结束后,先使反应停止并排出装置中残留的氯气,再拆卸装置,避免污染空气。
1.在5支试管中分别加入2~3 mL稀盐酸、NaCl溶液、Na2CO3溶液、自来水、蒸馏水,然后各滴入几滴AgNO3溶液,再分别加入少量稀硝酸,观察现象,填写下表:
2.请写出上述实验中有关的化学方程式:② ;③ , 。
NaCl+AgNO3===AgCl↓+NaNO3
Na2CO3+2AgNO3===Ag2CO3↓+2NaNO3
Ag2CO3+2HNO3===CO2↑+H2O+2AgNO3
氯离子(Cl-)的检验方法(1)方法:先加稀HNO3溶液,再加AgNO3溶液。(2)现象:产生白色沉淀。(3)原理:Ag++Cl-===AgCl↓。(4)加稀硝酸的目的:排除 等离子的干扰。
例5 在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断水溶液中含有
例6 有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:①溶于水,得到无色溶液;②在所得溶液中滴入AgNO3溶液,生成白色沉淀;③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。根据上述现象判断:(1)白色固体中一定含有的成分是____________,可能含有的成分是______。(2)请写出上述实验中有关反应的离子方程式:_________________________________________________________________________________。
===Ag2CO3↓、Ag2CO3+2H+===2Ag++H2O+CO2↑
解析 三种物质溶于水均得到无色溶液,且相互之间不反应;加入AgNO3溶液生成白色沉淀,说明固体中可能含KCl、K2CO3或两者中的一种;滴加稀HNO3,沉淀量减少说明固体中含有K2CO3,沉淀不完全消失说明固体中含有KCl。
1.判断正误(正确的打“√”,错误的打“×”)(1)工业上将氯气通入澄清石灰水制取漂白粉( )(2)漂白粉在空气中久置不可能发生氧化还原反应( )(3)漂白粉在空气中不稳定,所以可用于漂白纸张( )(4)实验室制取干燥、纯净的氯气,可依次通过浓硫酸、饱和食盐水( )(5)检验Cl-时,要加稀硝酸排除其他离子的干扰( )(6)1 ml Cl2与足量的NaOH溶液反应,转移电子数为2NA( )
2.已知:2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O,下列关于该反应的说法正确的是A.工业上可用来制取漂白粉B.属于复分解反应C.氯元素只被还原D.还原产物与氧化产物的质量比为1∶1
解析 氯气与氢氧化钙溶液反应,生成氯化钙(还原产物)和次氯酸钙(氧化产物),二者的物质的量之比为1∶1;该反应中氯气既是氧化剂又是还原剂,氯元素既被氧化又被还原。
3.“84消毒液”在日常生活中被广泛使用,该消毒液无色,pH大于7,对某些有色物质有漂白作用。已知,强碱弱酸形成的盐溶液呈碱性,则你认为“84消毒液”的有效成分是A.氯化氢 B.次氯酸钠C.高锰酸钾 D.碳酸钠
解析 pH大于7,说明溶液显碱性,氯化氢溶于水显酸性;“消毒液无色”,高锰酸钾溶液显紫红色;碳酸钠溶液虽显碱性,但碳酸钠不能杀菌消毒。
4.实验室用MnO2和浓盐酸制取氯气时,有14.6 g氯化氢被氧化,所得Cl2全部用石灰水吸收,可制得漂白粉的质量是A.14.3 g B.25.4 g C.28.6 g D.50.8 g
可得关系式:4HCl(被氧化)~2Cl2~CaCl2+Ca(ClO)2,设生成漂白粉的质量为m,则:4HCl(被氧化)~2Cl2~CaCl2+Ca(ClO)24×36.5 g 254 g14.6 g m(漂白粉)
5.下列检验Cl-的方法正确的是A.向某溶液中滴加AgNO3溶液,若产生白色沉淀说明该溶液中有Cl-B.向某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-C.向某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀不消失,说明 溶液中有Cl-D.向某溶液中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明溶液中有Cl-
加入盐酸,引入Cl-,B、C错误;
人教版高考化学一轮总复习第2章第2节氯及其化合物课时教学课件: 这是一份人教版高考化学一轮总复习第2章第2节氯及其化合物课时教学课件,共60页。PPT课件主要包含了环节1课前自主复习,环节2高考热点突破,环节3新情境专项练等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物备课课件ppt: 这是一份人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第二节 氯及其化合物备课课件ppt,共22页。PPT课件主要包含了氯水的成分,氯气与碱反应,你知道吗等内容,欢迎下载使用。
化学第二节 氯及其化合物说课ppt课件: 这是一份化学第二节 氯及其化合物说课ppt课件,共15页。PPT课件主要包含了新闻链接,氯气的物理性质,你知道吗等内容,欢迎下载使用。













