






人教版 (新课标)必修1第四节 氨 硝酸 硫酸图文ppt课件
展开合成氨是人类发展史上的一项重大突破,解决了因粮食不足而导致的饥饿和死亡问题。
对合成氨研究有贡献的三位科学家。
1900年,法国化学家勒沙特列在研究平衡移动原理的基础上通过计算,认为N2、H2在高压条件下可以直接化合生成氨,接着,他用实验来验证。但在实验过程中发生了爆炸,他也没有调查事故发生的原因,而是觉得这个实验有危险,于是放弃了研究。勒沙特列的合成氨实验就这样夭折了。
后来查明是由于他所用混合气体中含有O2,实验中H2和O2化合发生了爆炸。
稍后,德国化学家耐斯特通过理论计算,认为合成氨是不可能的。因此人工合成氨的研究又一次止步。后来才发现,是能斯特计算时误用了一个热力学数据,以至得到错误结论。
在合成氨研究屡屡受挫的情况下,德国另一位化学家哈伯知难而进,对合成氨进行了全面系统地研究和实验,终于在1908年7月在实验室里用N2和H2在600℃、200个大气压下合成氨,产率虽只有2%,但却是科学上的一项重大突破。
当哈伯的合成氨工艺流程公众于世后,立即引起了德国当时的统治者们的注意,德国统治者为了达到吞并欧洲称霸世界的野心,同时也利用哈伯想成为百万富翁的贪婪心理,请哈伯出任德国威廉研究所所长,继续他的研究。从1911年到1913年短短两年时间内,哈伯不仅提高了合成氨的产率,而且合成了1000吨液氨,并且用它制造出3500吨烈性炸药TNT。
到了1913年第一次世界大战时,哈伯已为德国建成了无数个大大小小的合成氨工厂,为侵略者制造了数百万吨炸药,从而导致并蔓延了这场秧祸全球的世界大战,这也是第一次世界大战德国为什么能坚持这么久的谜底。
当事实真相大白于天下时,哈伯受到了各国科学家的猛烈抨击,尤其是当他获得1918年诺贝尔化学奖时,更激起了世界人民的愤怒。 人工合成氨实验的成功令人欢心鼓舞,它对工农业生产、国防科技的重大意义是不言而喻的。但三位科学家留给后人的思考也是深刻的—科学必须造福于民!
哈伯(1868—1934),德国化学家,合成氨工业的奠基人。1918年哈伯由于对合成氨研究作出过重大贡献,而获诺贝尔化学奖。
----氨气的喷泉实验
城市中常见的人造喷泉及火山爆发的原理与上述的原理相似。
(2)溶液为什么变为红色?
(3)实验成败的关键是什么?
(1)氨为什么会形成喷泉?
a.烧瓶干燥;b.装置的气密性好;c.收集的气体纯度尽可能高。
氨极易溶于水,使烧瓶内外形成较大的压差;
①无色, 有刺激性气味的气体;
③极易溶于水(1:700)。
(1)氨与水的反应——显弱碱性
NH 3·H 2O =NH3↑ +H2O
NH3·H2O不稳定,受热时容易分解为NH3和H2O。不加热不分解.
现象:溶液红色褪色,冷却后恢复红色。
将氨的酚酞溶液倒入栓有小气球的试管中,加热。
①NH3极易溶于水。(1:700),
所以氨水显______,既能使无色的酚酞溶液变成____,又能使湿润的红色的石蕊试纸____。
②NH3与水反应后有碱性物质生成。
大部分NH3与水结合成 NH3·H2O, NH3·H2O可以小部分电离成NH4+和OH-。
氨水中的分子有:H2O、NH3 和 NH3·H2O
氨水中的离子有:NH4+、H+ 和 OH-
液氨 是氨气加压或降温后形成的液态物质,液氨所含的微粒是NH3。
讨论: 氨水的主要成份有哪些? 氨水与液态氨有何区别?
写出上述反应的离子方程式
NH3+HCl=NH4Cl
1.在反应中为什么会产生白烟?
挥发出的氨气和氯化氢气体在空中反应生成氯化铵固体小颗粒。
2.硫酸或磷酸与氨气反应能否产生白烟?
NH3+HCl==NH4Cl (白烟)
——此反应可检验NH3或HCl
【知识延伸】:挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;难挥发性酸H2SO4无此现象。
2NO + O2=== 2NO2
3NO2 +H2O ===2HNO3 +NO
这个反应叫做氨的催化氧化, 它是工业上制硝酸的基础.
2NH3+H2SO4 ==(NH4)2SO4
NH3 +HNO3 == NH4NO3
NH3 +CO2+ H2O === NH4 HCO3
4NH3+5O2 ==== 4NO+6H2O
2 NO + O2 === 2NO2
3NO2 + H2O === 2HNO3 + NO
2NH3+CO2 ==== CO(NH2)2+ H2O
NH3(g) NH3(l)
铵盐的形成:NH3 + H+=NH4+
铵盐都不稳定,受热易分解
NH4NO3 + NaOH = NaNO3 +H2O +NH3 ↑
(NH4)2SO4+2NaOH = Na2SO4+2H2O+2NH3 ↑
运用:实验室用来制NH3、用于NH4+的检验
反应实质:NH4++ OH-=NH3↑+H2O
如何用实验方法证明某白色固体是铵盐?
滴加NaOH溶液,再加热,并将湿润的红色石蕊试纸靠近试管口。
产生无色刺激性气味气体,能使湿润红色石蕊试纸变蓝。
铵盐(NH4+)的检验:
大量的铵盐用于生产氮肥
硝酸铵用于制炸药、氯化铵常用作印染和制干电池的原料,也可以用于金属的焊接,以除去金属表面的氧化物薄膜。
将一块普通的棉布浸在氯化铵的饱和溶液中,片刻之后,取出晾干就成防火布了。将这块经过化学处理的布用火柴点,不但点不着,而且还冒出白色的烟雾。
原来,经过这种化学处理的棉布(防火布)的表面附满了氯化铵的晶体颗粒,氯化铵这种物质,它有个怪脾气,就是特别怕热,一遇热就会发生化学变化,分解出两种不能燃烧的气体,一种是氨气,另一种是氯化氢气体。
这两种气体把棉布与空气隔绝起来,棉布在没有氧气的条件下当然就不能燃烧了。当这两种气体保护棉布不被火烧的同时,它们又在空气中相遇,重新化合而成氯化铵小晶体,这些小晶体分布在空气中,就象白烟一样。实际上,氯化铵这种化学物质是很好的防火能手,戏院里的舞台布景、舰艇上的木料等,都经常用氯化铵处理,以求达到防火的目的。
(1)原料:NH4Cl、Ca(OH)2
(2)原理:2NH4Cl+Ca(OH)2==2NH3↑+2H2O+CaCl2(3)制取装置:固固加热装置
5、NH3的实验室制法
(4)收集装置: 向下排空气法(5)检验: a:使湿润的酚酞试纸变红 b:遇浓盐酸产生大量的白烟(6)尾气处理:用水吸收NH3
要得到干燥的氨气,常用试剂有哪些?①CaO、碱石灰等碱性干燥剂②无水CaCl2不能用来干燥NH3(形成CaCl2•8NH3)
除了利用上述方法之外,实验室有无其他简单可行的方法来制得氨气?
方法二:加热浓氨水制氨气
思考:有什么现象?为什么有此现象?
1、吸收水分,减少溶剂。2、增加OH-的浓度。3、放出热量,升高温度。
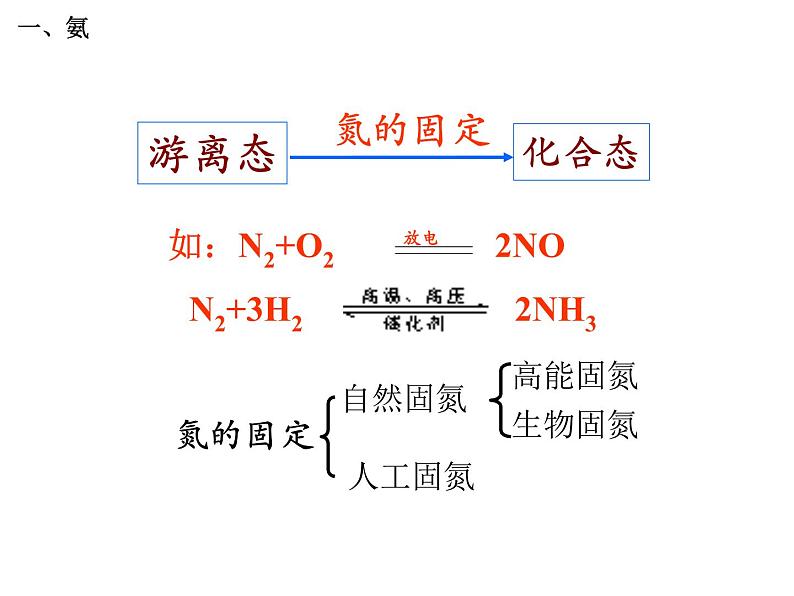
自然界中氮的循环过程
氮的固定(生物固氮、高能固氮、人工固氮)
土壤中的氮(铵盐→硝酸盐)
1.能将NH4Cl 、(NH4)2SO4、NaCl、 Na2SO4四种溶液一一区别开来的试剂是( )A . NaOH B. AgNO3 C . BaCl2 D. Ba(OH)2
2. A、B、C三种气体,A无色,在一定条件下A能与O2反应生成B,B不溶于水,它能与O2反应生成红棕色气体C;A、C气体均溶与水,其水溶液分别呈碱性与酸性,推断A ,B ,C 。
3.某学生在氨气的喷泉实验基础上积极思考产生喷泉的其他方法,并设计如图所示的装置。在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是:( ) A. Cu与稀盐酸 B. NaHCO3与NaOH C. CaCO3与稀硫酸 D. NH4HCO3与稀盐酸
高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸多媒体教学ppt课件: 这是一份高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸多媒体教学ppt课件,共53页。PPT课件主要包含了思考·交流,HCl,NH3,现象产生大量白烟,实验探究,实验·探究,如何检验SO42-,浓硫酸的特性,⑵脱水性,3氧化性等内容,欢迎下载使用。
化学必修1第四节 氨 硝酸 硫酸多媒体教学ppt课件: 这是一份化学必修1第四节 氨 硝酸 硫酸多媒体教学ppt课件,共14页。PPT课件主要包含了转移6e-,红棕色,HNO3,NO2等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第四节 氨 硝酸 硫酸教案配套ppt课件: 这是一份高中化学人教版 (新课标)必修1第四节 氨 硝酸 硫酸教案配套ppt课件,共19页。PPT课件主要包含了常见酸的挥发性,具有酸的通性,硝酸的不稳定性,浓硝酸与铜的反应,固+液→气,还原剂,介绍玻尔爱国事迹,氧化性酸小结,易钝化物质小结,硝酸的用途等内容,欢迎下载使用。













