





高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸多媒体教学ppt课件
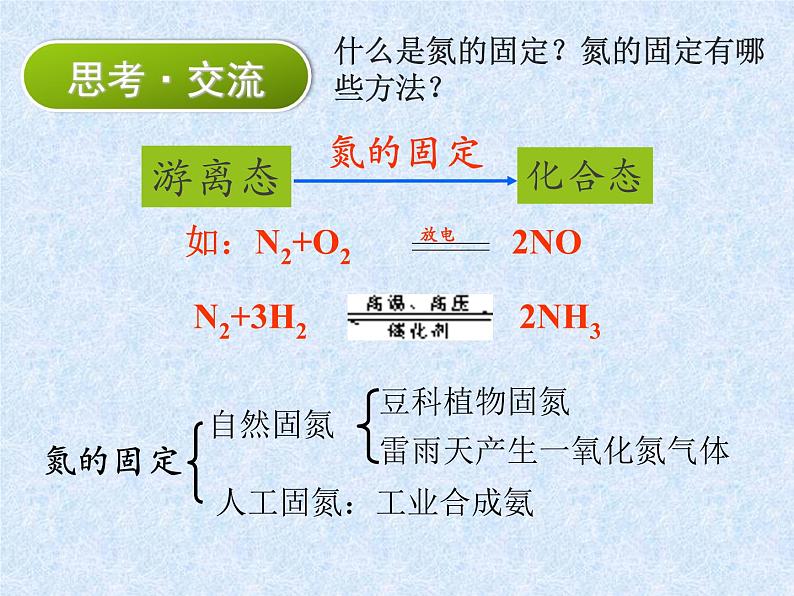
展开什么是氮的固定?氮的固定有哪些方法?
北海市一制冷车间发生氨气泄漏 2016年1月4日,广西北海市一冷冻厂发生氨气泄漏事件,整个厂区是白茫茫的一片,空气中弥漫着一股浓烈的刺激性气味,进入厂区呼吸都感到困难。厂区内寒气逼人。市消防中心接到报案后立即制定方案,出动46名消防队员,8辆消防车……
1、为什么在氨气泄漏时工厂里会寒气逼人?2、如何吸收弥漫在空气中的大量氨气?3、被围困在污染区的群众怎样做才能不吸入氨气?
①无色, 有刺激性气味的气体。
②易液化(沸点-33.35℃),液氨气化时要吸收大量的热,使周围温度急剧降低,因此常用作制冷剂。
③极易溶于水(1:700)。
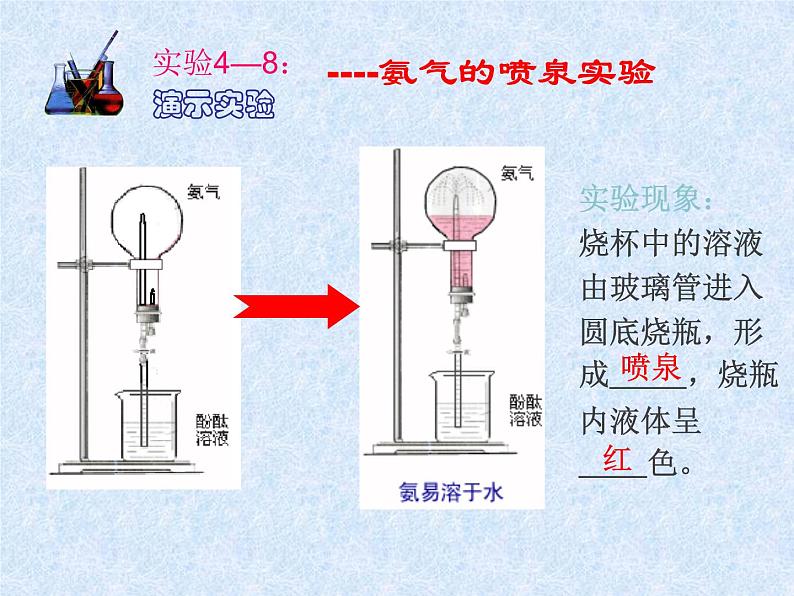
----氨气的喷泉实验
实验现象:烧杯中的溶液由玻璃管进入圆底烧瓶,形成 ,烧瓶内液体呈 色。
城市中常见的人造喷泉及火山爆发的原理与上述的原理相似。
1、形成喷泉的原因是什么?2、由该实验可以得到什么结论?
1、当滴管中的水挤入到烧瓶中时,烧瓶内的氨溶解,使瓶内压强迅速降低,瓶外的空气将烧杯内的溶液很快压入到烧瓶,形成喷泉。2、氨气极易溶于水,其水溶液呈碱性。
2、氨的化学性质(1)氨跟水反应 一水合氨很不稳定 氨水显碱性的原理: 氨水中含少量氢氧根离子,呈弱碱性,故能使酚酞试液变红。
NH3·H2O == NH3↑ +H2O
氨气是中学阶段唯一遇水显碱性的气体,能够使湿润的红色石蕊试纸变蓝。
分子:NH3、H2O、NH3·H2O(主要)离子:NH4+、OH-
NH3+HCl=NH4Cl
——此反应可检验NH3
2、氨的化学性质(2)氨跟酸反应
NH3+HCl=NH4Cl (白烟)
NH3+HNO3=NH4NO3 (白烟)
与挥发性的酸反应有白烟
2NH3+H2SO4=(NH4)2SO4
写出上述反应的离子方程式
2、氨的化学性质(3)氨跟酸性氧化物反应与CO2:NH3+CO2+H2O=NH4HCO3 (工业制纯碱中的反应)与SO2:NH3 + SO2 +H2O =NH4HSO3
2、氨的化学性质(4)氨跟盐反应Al3++3NH3·H2O = Al(OH)3↓+3NH4+(5)还原性
氨经一系列反应可以得到硝酸,如图所示
1、试写出以下每一步转化的反应方程式。2、分析上述每一步反应中氮元素化合价的变化,指出氮元素发生的是氧化反应还是还原反应。
3、氨的用途(1)氮肥(2)农药(3)炸药(4)制冷剂
向饱和的NaCl溶液中通入足量的NH3后,再通入足量的CO2,发现有NaHCO3晶体析出,为什么? 写出有关的方程式。NH3+CO2+H2O=NH4HCO3 NH4HCO3+NaCl=NaHCO3↓+NH4Cl
铵盐的形成:NH4+和酸根离子物理性质:铵盐都是晶体 铵盐都易溶于水化学性质:(1)铵盐都不稳定,受热易分解
应用:实验室制NH3以及NH4+的检验
(1)试样为固体(2)试样为液体
(1)①取少量固体放入坩埚中,加入固态碱进行研磨,若闻到氨味,说明样品中含有NH4+; ②取少量样品与碱混合于试管中,加热,将湿润的红色石蕊试纸靠近试管口,试纸变蓝 ,说明样品中含有NH4+; (2)取少量液体注入试管中,再加入碱液,微热,然后用湿润红色石蕊试纸或浓盐酸检验。
(二)NH3的实验室制法
原理:加热铵盐与碱的固体混合物。
探究:1、NH3如何收集? 2、如何检验NH3已经收满?剩余的NH3 如何处理? 3、若要制备干燥的NH3 ,可用什么作干燥剂?
(1)原料:NH4Cl 、 Ca(OH)2
(3)制取装置: 固固加热装置
(4)收集装置: 向下排空气法(5)检验: a:使湿润的酚酞试纸变红 b:遇浓盐酸产生大量的白烟(6)尾气处理:用水吸收NH3
要得到干燥的氨气,常用试剂有哪些?①CaO、碱石灰等碱性干燥剂。②无水CaCl2不能用来干燥NH3(形成CaCl2.8NH3)。
用氢氧化钠代替氢氧化钙好吗?氢氧化钠易吸水,易结块,不易产生NH3;且热的氢氧化钠对玻璃有腐蚀作用。
第四节 氨 硝酸 硫酸
(一)稀硫酸具有酸的通性 H2SO4=2H++SO42-
一、硫酸(H2SO4)
①与指示剂反应:使紫色石蕊试液变红 ②与活泼金属反应放出氢气(硝酸除外): ③与金属氧化物反应生成盐和水:2H++Na2O=2Na++H2O ④与盐的反应生成新盐和新酸:2H++CO32-=H2O+CO2↑ ⑤与碱的反应,生成盐和水。
①试剂: 和 。 ②方法:未知液先用足量 酸化再加 。③现象: 。⑤离子方程式: 。
Ba2+ + SO42- = BaSO4↓
①纯硫酸是无色、粘稠的油状液体(常用浓硫酸质量分数为98.3%)。
②纯硫酸难挥发,沸点338℃。(高沸点酸)
③密度:质量分数为98.3%的硫酸的密度为 1.84g/cm3 。
④易溶于水,能以任意比与水混溶。
将浓硫酸沿着容器内壁缓慢地注入水中,并用玻璃棒不断搅拌,使产生的热量迅速扩散。
将浓硫酸与其它低密度的液体混合时,方法与浓硫酸在水中的溶解方法相同。
98%的浓硫酸与稀硫酸的性质有何不同?
用途:可以作干燥剂, 可以干燥的气体,如 H2、O2、Cl2、CO2、CO、CH4、SO2、 N2、HCl。
浓硫酸吸收现成水(如气体、液体中的水,固体中的结晶水)
还原性气体:H2S、HBr、HI
脱水性是指浓硫酸能把有机物中的氢氧原子按2:1(H2O)的个数比脱去。
现象:蔗糖变黑,体积膨胀,形成疏松多孔的海绵状的炭,并有刺激性气味的气体产生。
现象:加热能反应,产生的气体能使品红褪色,使石蕊溶液变红;溶液稀释后呈蓝色。
①与不活泼金属反应 Cu + 2H2SO4(浓) == CuSO4+ SO2↑+ 2H2O
若铜过量,硫酸能否完全反应?为什么?
结论:浓硫酸既有氧化性又有酸性
在常温下,浓硫酸跟某些金属,如铁、铝等接触时,能够使金属表面生成一薄层致密的氧化物薄膜,从而阻止内部的金属继续跟硫酸发生反应(钝化现象)。因此,冷的浓硫酸可以用铁或铝的容器贮存。但受热时,浓硫酸可以与Fe、Al反应。
气态的CO2、SO2从炭的空隙中冲出,导致了炭内形成无数个分布不均的孔洞,使炭呈多孔蓬松状。
C + 2H2SO4(浓) == CO2↑+ SO2↑+ 2H2O
浓硫酸具有强氧化性,稀硫酸是否有氧化性?如果有,其氧化性与浓硫酸的氧化性有何不同?浓硫酸与稀硫酸比较:稀硫酸:弱氧化性(由H+体现)——H2浓硫酸:强氧化性(由 S体现)——SO2
硫酸是世界上用量最大、用途最广的化工基本原料之一,故素有“化学工业之母”之称。
玻尔是丹麦著名的物理学家,曾获得诺贝尔奖。第二次世界大战中,玻尔被迫离开将要被德国占领的祖国。为了表示他一定要返回祖国的决心,他决定将诺贝尔金质奖章溶解在一种溶液里,装于玻璃瓶中,然后将它放在柜面上。后来,纳粹分子窜进玻尔的住宅,那瓶溶有奖章的溶液就在眼皮底下,他们却一无所知。这是一个多么聪明的办法啊!战争结束后,玻尔又从溶液中还原提取出金,并重新铸成奖章。新铸成的奖章显得更加灿烂夺目,因为,它凝聚着玻尔对祖国无限的热爱和无穷的智慧。那么,玻尔是用什么溶液使金质奖章溶解呢?
原来他用的溶液叫王水。王水是浓硝酸和浓盐酸按1:3的体积比配制成的的混和溶液。由于王水中含有硝酸、氯气和氯化亚硝酰等一系列强氧化剂,同时还有高浓度的氯离子。因此,王水的氧化能力比硝酸强,不溶于硝酸的金,却可以溶解在王水中。
纯硝酸是无色、易挥发、有刺激性气味的液体,在空气中遇水蒸气呈白雾状,能以任意比溶于水中。
(2)不稳定性(硝酸越浓越易分解)
思考:常用的浓硝酸为什么会呈黄色?
浓硝酸易分解生成NO2溶于硝酸
(3)强氧化性——稀、浓硝酸
4HNO3(浓) + Cu = Cu(NO3)2 + 2NO2↑+ 2H2O
8HNO3(稀) + 3Cu = 3Cu(NO3)2 + 2NO↑+ 4H2O
分析上述反应中电子转移的方向和数目,并指出氧化剂和还原剂。
不产生氢气,N元素被还原
试写出Ag与稀硝酸、与浓硝酸反应的化学方程式。
2HNO3(浓) + Ag = AgNO3 + NO2↑+ H2O
4HNO3(稀) + 3Ag = 3AgNO3+ NO↑+ 2H2O
常温下,铁和铝遇浓硝酸和浓硝酸表面发生钝化,故浓硝酸、浓硫酸的贮存和运输可用铝(铁)槽车运输。若加热,则铁和铝都会跟浓硝酸、浓硫酸反应。
VHNO3:VHCl = 1:3组成的混合物
若将浓硝酸和浓盐酸按体积比1 : 3混合所得混合物叫王水,氧化性极强,可溶解金、铂等不活泼金属。
人教版 (新课标)必修1第四节 氨 硝酸 硫酸授课课件ppt: 这是一份人教版 (新课标)必修1第四节 氨 硝酸 硫酸授课课件ppt,共57页。PPT课件主要包含了概念认知·自主学习,1物理性质,无色气体,刺激性,2喷泉实验,3氨水的性质,能力形成·合作探究,学情诊断·课堂检测等内容,欢迎下载使用。
高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸教案配套ppt课件: 这是一份高中化学人教版 (新课标)必修1第四章 非金属及其化合物第四节 氨 硝酸 硫酸教案配套ppt课件,共60页。PPT课件主要包含了概念认知·自主学习,碱指示剂,碱性氧化物,①②③,浓盐酸,浓硝酸,能力形成·合作探究,学情诊断·课堂检测等内容,欢迎下载使用。
化学必修1第四节 氨 硝酸 硫酸教学课件ppt: 这是一份化学必修1第四节 氨 硝酸 硫酸教学课件ppt,共1页。













