





化学必修1第四节 氨 硝酸 硫酸多媒体教学ppt课件
展开【学习目标】1、掌握硝酸的强氧化性;2、掌握氧化还原反应方程式的配平。
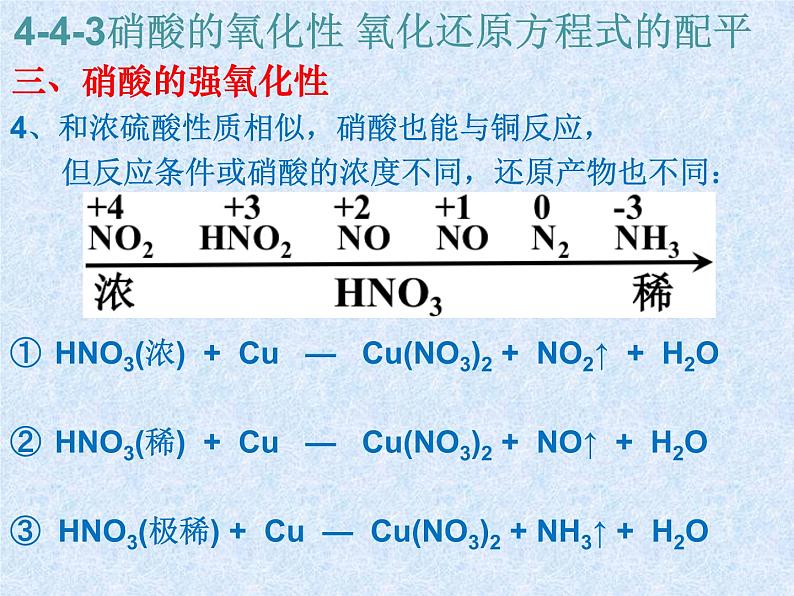
4-4-3硝酸的氧化性 氧化还原方程式的配平
2、硝酸的物理性质: 纯硝酸是无色、易挥发、有刺激性气味的液体。3、硝酸不稳定,久制浓硝酸会变黄: 4HNO3 光或热 2H2O + 4NO2↑+ O2↑
三、硝酸的强氧化性
4、和浓硫酸性质相似,硝酸也能与铜反应, 但反应条件或硝酸的浓度不同,还原产物也不同:
HNO3(浓) + Cu — Cu(NO3)2 + NO2↑ + H2OHNO3(稀) + Cu — Cu(NO3)2 + NO↑ + H2O③ HNO3(极稀) + Cu — Cu(NO3)2 + NH3↑ + H2O
5、用双线桥法分析下列方程式,并回答问题: 3Zn + Fe2(SO4)3 = 3ZnSO4 + 2Fe
四、氧化还原方程式的配平(化合价升降守恒)
5、用双线桥法分析下列方程式,并回答问题:
(1) 氧化还原反应方程式中存在哪些守恒规律? 质量守恒(元素种类与原子个数守恒), 电子转移守恒(化合价升降守恒)。(2) 利用电子转移守恒规律,配平下列方程式? NO2 + H2O = HNO3 + NO
(1) 氧化还原反应方程式中存在哪些守恒规律? 质量守恒(元素种类与原子个数守恒), 电子转移守恒(化合价升降守恒)。(2) 利用电子转移守恒规律,配平下列方程式?
6、配平下列方程式,并回答问题:
HNO3(浓) + Cu — Cu(NO3)2 + NO2↑ + H2OHNO3(稀) + Cu — Cu(NO3)2 + NO↑ + H2O③ HNO3(极稀) + Cu — Cu(NO3)2 + NH3↑ + H2O
(1) 算出参加反应的硝酸与发生还原反应的硝酸之比: ① 发生反应的硝酸 :被还原的硝酸 = 4:2 ② 发生反应的硝酸 :被还原的硝酸 = 8:2 ③ 发生反应的硝酸 :被还原的硝酸 = 9:1
4-4-2 浓硫酸的氧化性
(2) 算出表现酸性与表现氧化性的硝酸之比: ① 表现酸性的硝酸 :表现氧化性的硝酸 = 2:2 ② 表现酸性的硝酸 :表现氧化性的硝酸 = 6:2 ③ 表现酸性的硝酸 :表现氧化性的硝酸 = 8:1
(3) 算出方程式中氧化剂与还原剂的物质的量之比: ① 氧化剂 :还原剂 = 2:1 ② 氧化剂 :还原剂 = 2:3 ③ 氧化剂 :还原剂 = 1:4
9、100 mL 2 ml·L-1稀硝酸与1.92 g铜充分反应后: (1) 产生的气体是___,标况下的体积为______ L, 反应过程中转移的电子数为______ NA。 (2) 若溶液体积不变,反应后溶液中 H+浓度为___ ml·L-1,NO3- 浓度为___ ml·L-1
HNO3 : n=cV=0.2 ml
Cu : n=m/M=0.03 ml
0.448 L
剩余HNO3 : (0.2-0.08)ml=0.12 ml
10、以下是氮循环的一部分: (1) NO2的颜色是______;A的化学式是________; (2) 反应②的化学方程式是___________________; NH3生成NO的方程式:______________________;(3) NO2溶于水方程式:________________________, 氧化剂是______;(4) 治理汽车尾气的方法是:2NO + 2CO = 2CO2 + N2。 当生成1 ml N2时,被还原的NO为____ ml。
4NH3+5O2 4NO+6H2O
2NO + O2 = 2NO2
化学必修 第一册第三节 氧化还原反应优秀课件ppt: 这是一份化学必修 第一册第三节 氧化还原反应优秀课件ppt,共23页。PPT课件主要包含了氧化还原反应的分类,氧化还原反应的配平,本节重难点,一般氧化还原反应,自身氧化还原反应,歧化反应,③NH4NO3,H2O+N2O↑,归中反应,氧化还原反应分类等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化评优课课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 硫及其化合物的相互转化评优课课件ppt,共15页。PPT课件主要包含了发生电子转移,遵循质量守恒,化合价升降总数相等,得失电子守恒,还原剂,氧化剂,还原产物,氧化产物,跟踪练习等内容,欢迎下载使用。
硝酸与硫酸的氧化性: 这是一份硝酸与硫酸的氧化性,共23页。












