
高中第一节 共价键图文课件ppt
展开1.能记住共价键的分类——σ键和π键。2.能说出σ键和π键的特征。
一、共价键的基本知识1.基本概念(1)定义:原子间通过共用电子对形成的化学键。(2)形成元素:通常是电负性相同或差值较小的非金属元素原子。(3)特征。共价键具有饱和性。(4)表示方法。①用“—”表示一对共用电子所形成的共价键,如H—H。②用“ ”表示两对共用电子所形成的共价键,如CH2 CH2。③用“≡”表示三对共用电子所形成的共价键,如CH≡CH。
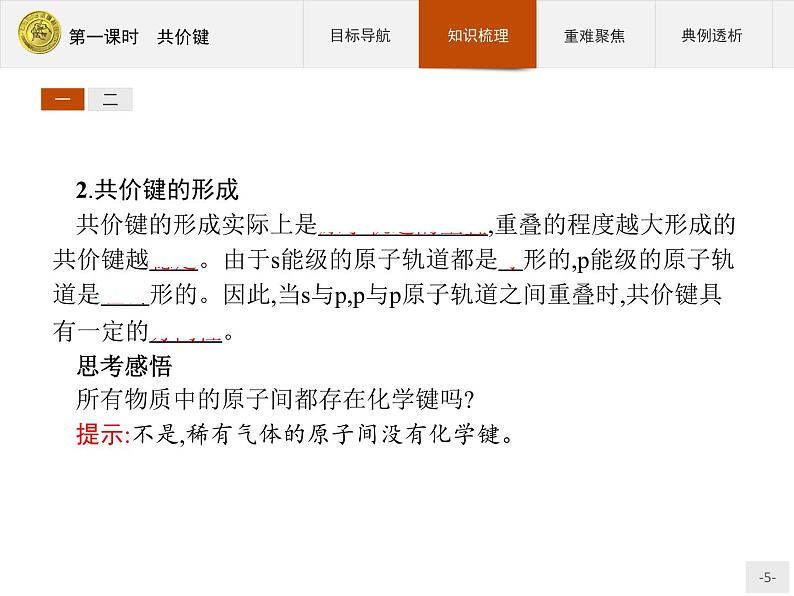
2.共价键的形成共价键的形成实际上是原子轨道的重叠,重叠的程度越大形成的共价键越稳定。由于s能级的原子轨道都是球形的,p能级的原子轨道是哑铃形的。因此,当s与p,p与p原子轨道之间重叠时,共价键具有一定的方向性。思考感悟所有物质中的原子间都存在化学键吗?提示:不是,稀有气体的原子间没有化学键。
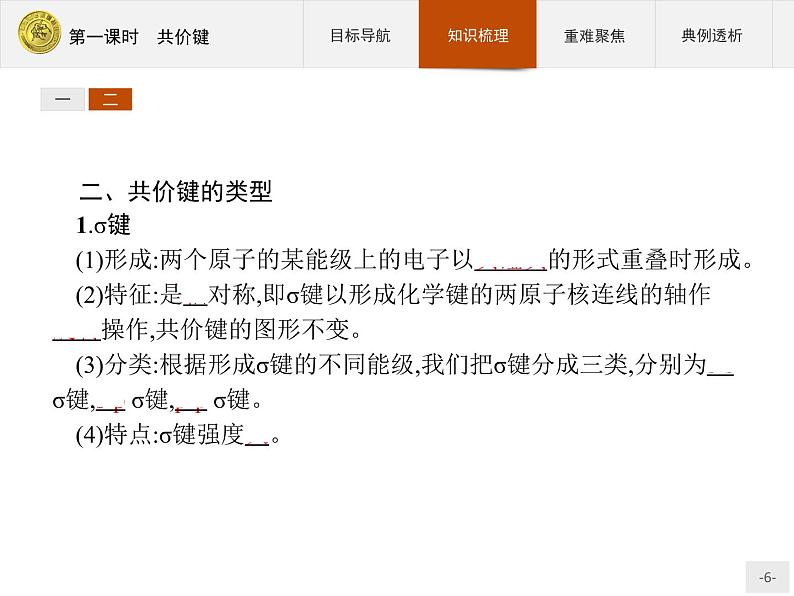
二、共价键的类型1.σ键(1)形成:两个原子的某能级上的电子以头碰头的形式重叠时形成。(2)特征:是轴对称,即σ键以形成化学键的两原子核连线的轴作 旋转操作,共价键的图形不变。(3)分类:根据形成σ键的不同能级,我们把σ键分成三类,分别为s-s σ键,s-p σ键,p-p σ键。(4)特点:σ键强度大。
2.π键(1)形成:两个原子的p能级上的电子以肩并肩的形式重叠时所形成。(2)特征:是镜像对称,π键以它们之间包含原子核的平面为镜面,互为镜像。(3)特点:π键不能(填“能”或“不能”)旋转,强度小。3.二者的判断共价单键是σ键,共价双键中有一个σ键和一个π键,共价三键由一个σ键和两个π键组成。
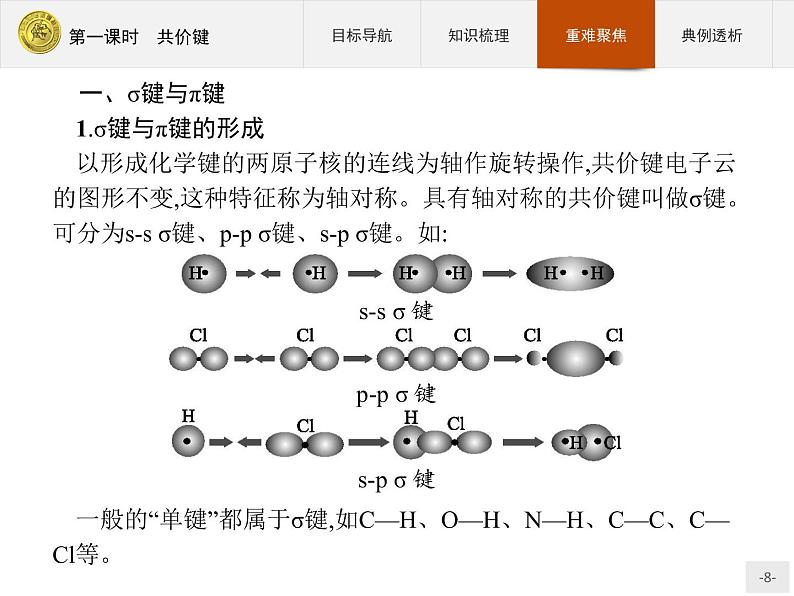
一、σ键与π键1.σ键与π键的形成以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,这种特征称为轴对称。具有轴对称的共价键叫做σ键。可分为s-s σ键、p-p σ键、s-p σ键。如:
一般的“单键”都属于σ键,如C—H、O—H、N—H、C—C、C—Cl等。
每个π键的电子云由两块组成,分别位于由两个原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,这种特征称为镜面对称。具有镜面对称的共价键叫做π键。
2.σ键和π键的比较
特别提醒(1)s轨道与s轨道形成σ键时,电子并不是只在两核间运动,只是电子在两核间出现的概率大。(2)形成共价键的两种元素电负性差别较小,一般电负性差值小于1.7。如H(2.1)与Cl(3.0),电负性差值为0.9,形成共价键。(3)形成共价键时,成键的两个原子核都吸引共用电子对,使之处于平衡状态,体系总能量降低。(4)π键电子云重叠程度比σ键小,因此π键没有σ键牢固,反应中比较活泼。
二、共价键的特征及其存在1.共价键的特征共价键具有饱和性和方向性。(1)共价键的饱和性。a.按照共价键的共用电子对理论,一个原子有几个未成对电子,便可与几个自旋状态相反的电子配对成键,这就是共价键的“饱和性”。氢原子、氯原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H4、H2Cl、Cl3等分子。b.共价键的饱和性决定了共价化合物的分子组成。
(2)共价键的方向性。a.共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现的概率越大,形成的共价键越牢固。电子所在的原子轨道都有一定的形状,所以要取得最大重叠,共价键必然有方向性。b.相似分子(如HX)中成键原子电子云(原子轨道)重叠程度越大,形成的共价键越牢固,分子结构越稳定。如HX的稳定性:HF>HCl>HBr>HI。c.共价键的方向性决定了分子的空间结构。
2.共价键的存在范围(1)共价化合物:以共用电子对(形成共价键)形成分子的化合物称为共价化合物。共价化合物的组成粒子(原子)通过共价键结合成分子,因此共价化合物中一定存在共价键。如SO2、CO2、CH4、H2O2、CS2、H2SO4等。(2)非金属单质分子中(稀有气体除外),如O2、F2、H2、C60等。
σ键与π键的比较【例题1】 关于σ键和π键的比较,下列说法不正确的是( )A.σ键是轴对称,π键是镜面对称B.σ键是“头碰头”式重叠,π键是“肩并肩” 式重叠C.σ键不能断裂,π键容易断裂D.氢原子只能形成σ键,氧原子可以形成σ键和π键答案:C解析:σ键较稳定,不易断裂,而不是不能断裂。化学反应的实质是旧键的断裂和新键的形成。
点拨对于原子能否形成π键可依据原子的价电子数确定,若达到稳定结构只差一个电子,如H、Cl,则只能形成σ键;若达到稳定结构差两个及两个以上电子,如O、N等,则既能形成σ键又能形成π键,H2O中氧原子只形成σ键,而O2中既有σ键又有π键。
σ键和π键的判断【例题2】 下列物质的分子中既有σ键又有π键的是( )①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2A.①②③B.③④⑤⑥C.①③⑥D.③⑤⑥答案:D解析:当两个原子间能形成多个共用电子对时,先形成一个σ键,另外的原子轨道只能形成π键。HCl中只有一个H—Cl σ键;H2O含有两个H—O σ键;H2O2含有两个H—O σ键和一个O—O σ键;N2中含有共价三键:其中一个为σ键,两个为π键;C2H4中碳原子与碳原子之间有共价双键,其中一个为σ键,一个为π键,另外有四个C—H σ键;C2H2中碳原子与碳原子之间有共价三键,其中一个为σ键,两个为π键,另外有两个C—H σ键。
点拨判断分子中是否含有π键,可从分子所含单键、双键和三键角度分析。
共价键的存在【例题3】 下列各组物质中,所有化学键都是共价键的是( )A.H2S和Na2O2B.H2O2和CaF2C.NH3和N2D.HNO3和NaCl答案:C解析:A项,Na2O2中既有离子键又有O—O共价键,不正确;B项,CaF2中只有离子键,不正确;D项,NaCl中只有离子键,没有共价键。
人教版 (2019)第二章 烃第一节 烷烃完美版课件ppt: 这是一份人教版 (2019)<a href="/hx/tb_c4002463_t3/?tag_id=26" target="_blank">第二章 烃第一节 烷烃完美版课件ppt</a>,共24页。
高中化学人教版 (2019)选择性必修2第一节 共价键精品课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第一节 共价键精品课件ppt,文件包含人教版化学选修二211《共价键》第一课时课件pptx、211共价键第一课时教案doc等2份课件配套教学资源,其中PPT共25页, 欢迎下载使用。
人教版 (2019)选择性必修2第一节 共价键公开课课件ppt: 这是一份人教版 (2019)选择性必修2第一节 共价键公开课课件ppt,共26页。PPT课件主要包含了第1课时,共价键,第一节共价键,共价键理论,轨道“头碰头”,轨道“肩并肩”,s-sσ键,s-pσ键,p-pσ键,小结σ键等内容,欢迎下载使用。