




人教版 (新课标)选修3 物质结构与性质第一节 共价键课文配套课件ppt
展开【教学目标】1.理解σ键和π键的特征和性质2.认识σ键和π键的形成过程3.学会区分σ键和π键
江西省鹰潭市第一中学 桂耀荣
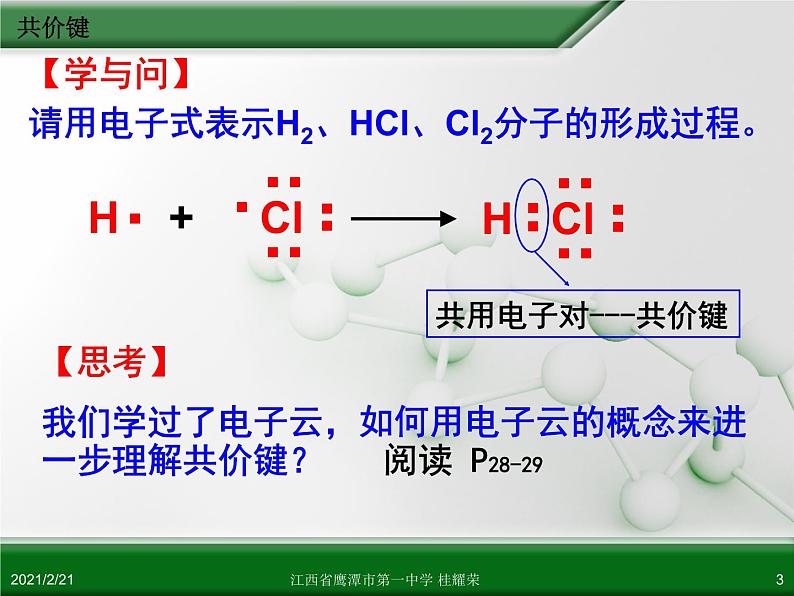
【学与问】 请用电子式表示H2、HCl、Cl2分子的形成过程。
【思考】 我们学过了电子云,如何用电子云的概念来进一步理解共价键? 阅读 P28-29
共用电子对---共价键
现代价键理论的基本要点:
a.电子配对原理 : 两原子各自提供1个自旋方向相反的电子彼此配对
b.最大重叠原理: 两个原子轨道重叠部分越大,两核间电子的概率 密度越大,形成的共价键越牢固,分子越稳定
为什么不可能有H3、H2Cl、Cl3分子的形成?
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就共价键的“饱和性”。H 原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3分子。
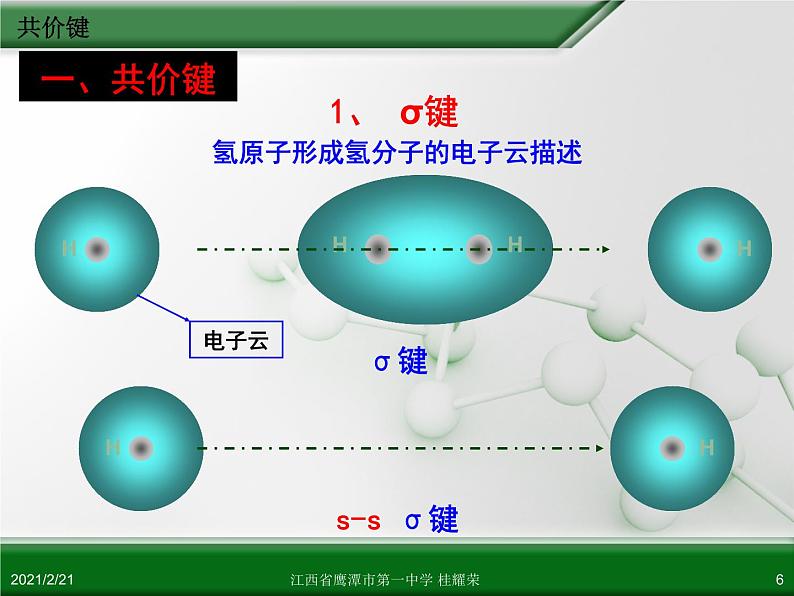
氢原子形成氢分子的电子云描述
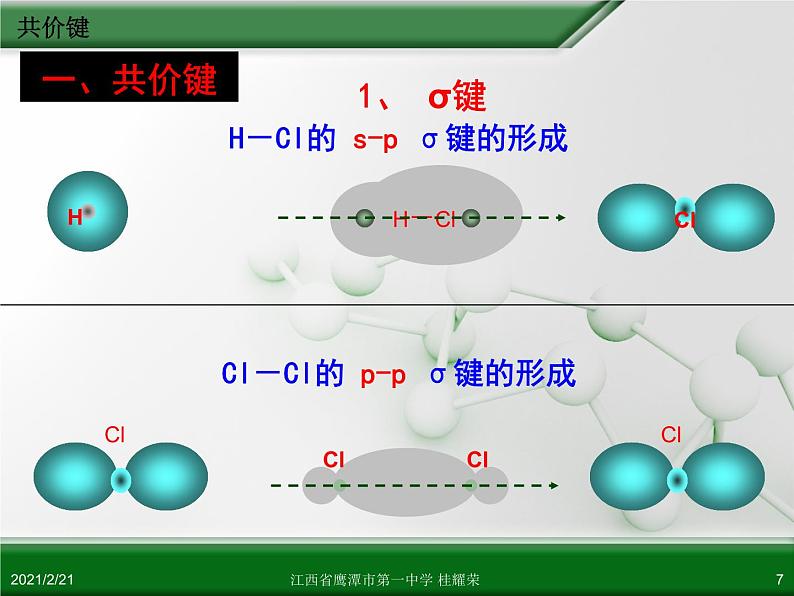
Cl-Cl的 p-p σ键的形成
H-Cl的 s-p σ键的形成
1. σ键 特征:①电子云结构为 轴对称 (头碰头) ②键能较大,较稳定 类型:有 s-s σ键,如 H2 有 s-p σ键,如 HCl 有 p-p σ键,如 Cl2
O2 中 p-pσ键和 p-pπ键的形成过程
特征:①电子云结构为 镜面对称 (肩并肩) ②键能比σ键小 ,不稳定,易断 类型:常见的有 p-p π键,如 CH2=CH2中
σ键强度大,不易断裂,不活泼。
π键强度较小,容易断裂,活泼。
共价单键是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个为π键
归纳:σ键和π键的比较
规律:共价单键是 σ键 ; 双键中一个σ键 ,另一个是π键; 三键中一个是σ键 ,另两个是π键
3. 如何判断是 σ键 或是 π键
N2中 p-pσ键和 p-pπ键的形成过程
【科学探究2】 P30钠和氯同样能形成电子对,但不是共价键而是离子键?怎样去解释?完成表格
【科学探究3】 P30探究共价键的类别和个数?
CH3-CH3分子结构
CH2=CH2分子结构
1、判断下列分子中,只含σ键的是 ,既含σ键又含有π键的是 。(填序号) ⑴ H2 ⑵ HCl ⑶ NH3 ⑷ H2O ⑸ CO2 ⑹ N2 ⑺ C2H4 ⑻ C2H2 ⑼ F2 ⑽ CH3CH3 ⑾ H2O2
只含σ键的是:1 2 3 4 9 10 11
既含σ键又含π键的是:5 6 7 8
2、下列说法中正确的是( ) A. p轨道之间以“肩并肩”重叠可形成σ键B. p轨道之间以“头碰头”重叠可形成π键C. s和p轨道以“头碰头”重叠可形成σ键D. 共价键是两个原子轨道以“头碰头”重叠 形成的
3、下列物质分子中无π键的是( ) A.N2 B.O2 C.Cl2 D.C2H4
人教版 (新课标)选修3 物质结构与性质第一节 原子结构图文ppt课件: 这是一份人教版 (新课标)选修3 物质结构与性质第一节 原子结构图文ppt课件,共30页。PPT课件主要包含了宇宙大爆炸,道尔顿原子模型,汤姆生原子模型,卢瑟福原子模型,α粒子散射实验,玻尔原子模型,能层与能级,1能层,核外电子分层排布,2能级等内容,欢迎下载使用。
高中人教版 (新课标)第一节 共价键示范课ppt课件: 这是一份高中人教版 (新课标)第一节 共价键示范课ppt课件,共26页。PPT课件主要包含了表2-1,表2-2,思考与交流,H2O105°,NH3107°,CO2180°,物理性质,等电子原理,SO2,NO2-等内容,欢迎下载使用。
高中化学人教版 (新课标)选修3 物质结构与性质第二章 分子结构与性质第三节 分子的性质课堂教学ppt课件: 这是一份高中化学人教版 (新课标)选修3 物质结构与性质第二章 分子结构与性质第三节 分子的性质课堂教学ppt课件,共22页。PPT课件主要包含了非极性键,Cl2Cl-Cl,极性键,共用电子对是否有偏向,判断方法,H-O-O-H,极性键非极性键,非极性分子,极性分子,F合0等内容,欢迎下载使用。













