
2020-2021学年广东省深圳实验中学联考九年级(上)期末化学试卷 解析版
展开一、单项选择题I:本大题共8小题,每小题1.5分,共12分。在每小题列出的四个选项中,只有一项最符合题意。
1.下列有关说法正确的是( )
A.工业上从空气中分离出氧气属于化学变化
B.用石灰浆刷墙壁,干燥后墙面变硬发生了化学变化
C.石油分馏后得到汽油、煤油、柴油等属于化学变化
D.干冰升华是化学变化
2.“见微知著”,研究微观是化学学习中重要的内容,有以下表述:
①氯气:Cl2;②由三个氧原子构成的臭氧分子:3O;③粒子结构示意图表示的粒子:S2+;
④两个铁离子:2Fe2+;⑤导电、导热性最好的金属:Ag;⑥+2价的镁元素:Mg+2. 其中正确的有( )
A.②④⑤B.①⑤C.①③⑤D.①④⑥
3.下列有关实验现象的说法正确的是( )
A.紫色石蕊遇到醋酸变红色
B.硫在空气中燃烧,产生明亮的蓝紫色火焰,有刺激性气味的气体生成
C.红磷在空气中燃烧,产生白雾
D.铁丝在空气中剧烈燃烧,放出大量的热,火星四射,有黑色熔融物生成
4.2019年诺贝尔化学奖得主为锂电池研究者,碳酸乙烯酯(C3H4O3)可用作锂电池电解液。下列有关碳酸乙烯酯的说法正确的是( )
A.碳酸乙烯酯是由三个碳原子、四个氢原子和三个氧原子构成的
B.其中C、H、O三种元素的质量比为3:4:3
C.其中碳元素的质量分数最大
D.碳酸乙烯酯的相对分子质量为88
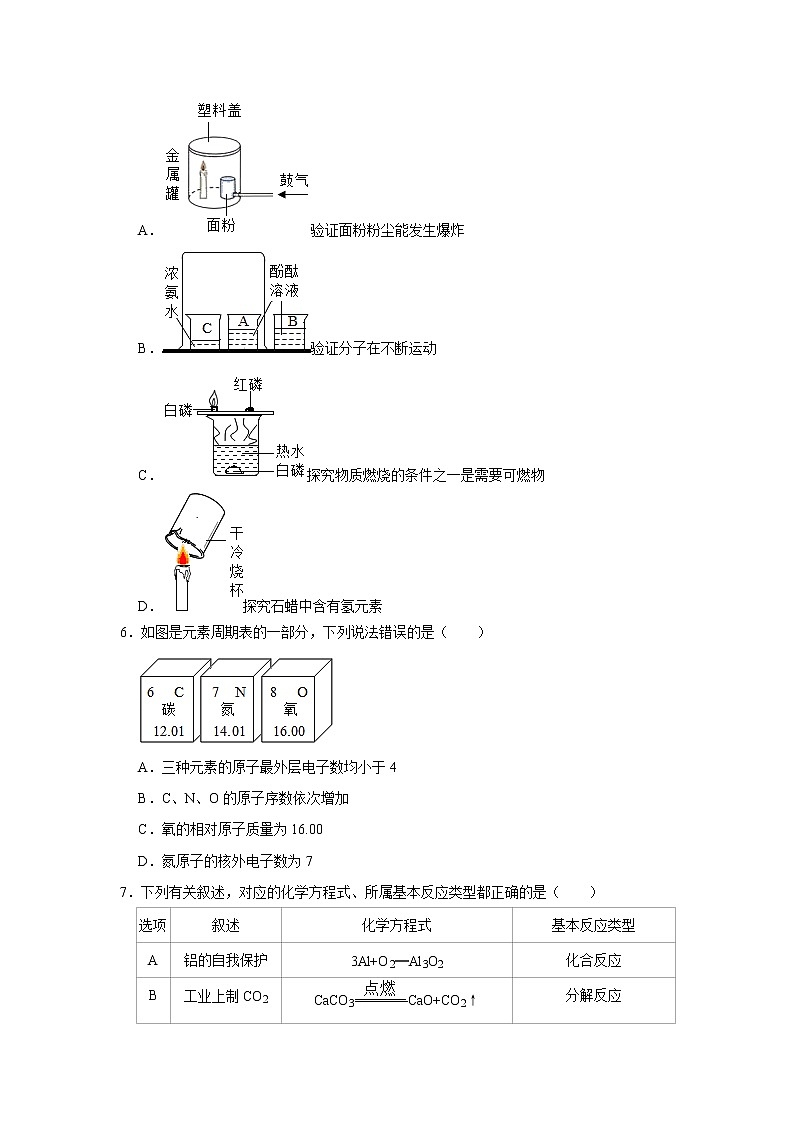
5.下列实验方案不能达到实验目的的是( )
A.验证面粉粉尘能发生爆炸
B.验证分子在不断运动
C.探究物质燃烧的条件之一是需要可燃物
D.探究石蜡中含有氢元素
6.如图是元素周期表的一部分,下列说法错误的是( )
A.三种元素的原子最外层电子数均小于4
B.C、N、O的原子序数依次增加
C.氧的相对原子质量为16.00
D.氮原子的核外电子数为7
7.下列有关叙述,对应的化学方程式、所属基本反应类型都正确的是( )
A.AB.BC.CD.D
8.生活处处有化学,安全时刻记心中。下列做法不合理的是( )
A.夜间发现家中石油液化气泄露,立即开灯查明泄露原因
B.用活性炭吸附冰箱中的异味
C.炒菜时,油锅不慎着火迅速用锅盖盖灭
D.高楼发生火灾时,用湿毛巾捂住口鼻在火场的浓烟中爬行逃生
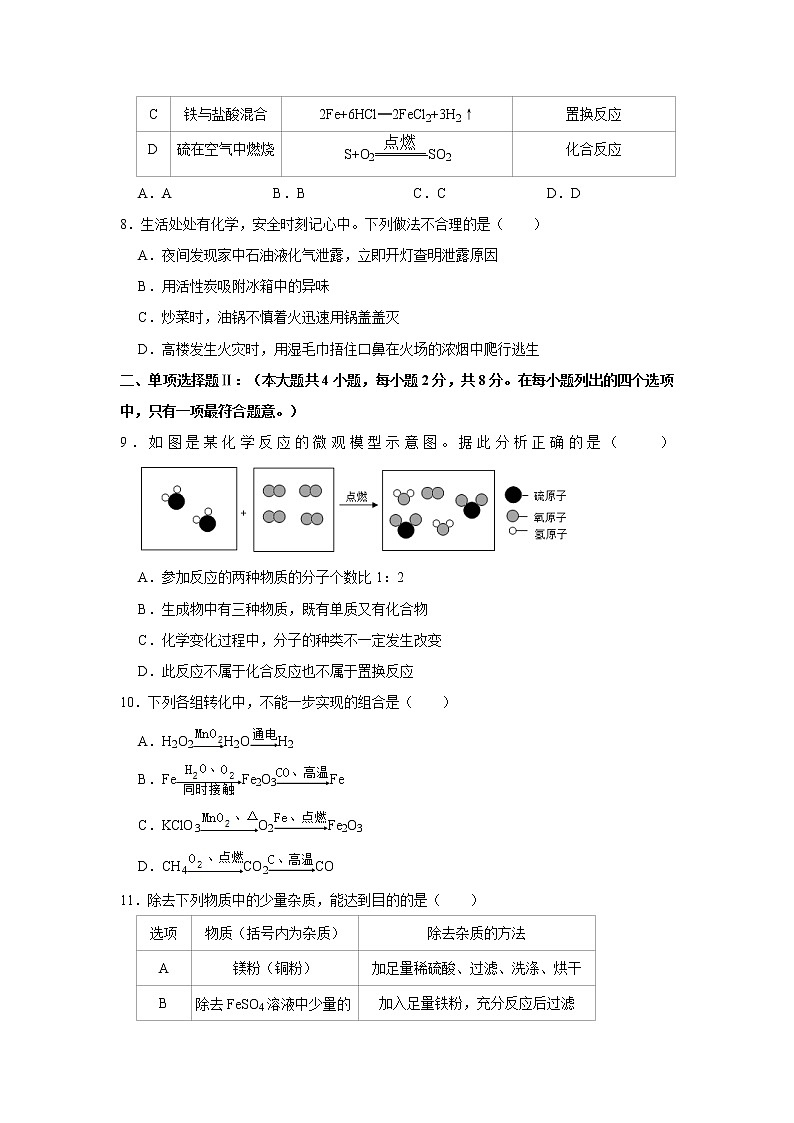
二、单项选择题Ⅱ:(本大题共4小题,每小题2分,共8分。在每小题列出的四个选项中,只有一项最符合题意。)
9.如图是某化学反应的微观模型示意图。据此分析正确的是( )
A.参加反应的两种物质的分子个数比1:2
B.生成物中有三种物质,既有单质又有化合物
C.化学变化过程中,分子的种类不一定发生改变
D.此反应不属于化合反应也不属于置换反应
10.下列各组转化中,不能一步实现的组合是( )
A.H2O2H2OH2
B.FeFe2O3Fe
C.KClO3O2Fe2O3
D.CH4CO2CO
11.除去下列物质中的少量杂质,能达到目的的是( )
A.AB.BC.CD.D
12.下列有关化学反应与反应时间对应的图形不正确的是( )
A.一定量的镁条在空气中点燃生成氧化镁的质量
B.加热高锰酸钾制取氧气时剩固体的质量
C.一定质量的木炭与过量氧气在密闭容器内加热使其充分反应
D.等质量的铁、锌分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系
三、非选择题(本大题共4小题,共30分)
13.(7分)如图是实验室制取气体的一些装置,据图回答有关问题。(友情提示:以下所选装置均填装置序号)
(1)写出序号为②的仪器名称:② 。
(2)写出化学实验室中选用装置C制取氧气的化学方程式 ;为获得较干燥的氧气,可选用 (填字母)作为收集装置。
(3)试回答下列问题:实验室中制取二氧化碳可采用的发生装置是B,理由是 。其反应的化学方程式是 。如果用A装置代替B,有什么优点 。
14.(6分)某小组同学在协助老师整理化学试剂时,发现一瓶标签残缺的无色液体(如图)(温馨提示:标签上的5%表示该混合物中主要成分所占的质量分数)。他们对此瓶无色液体是什么产生了兴趣,于是进行了如下探究:
【大胆猜想】
猜想一:水; 猜想二:稀硫酸; 猜想三:过氧化氢溶液。
小组同学对标签又进行了仔细的观察、分析,他们一致认为猜想一不合理,理由是水是 (填物质类别)。
【设计方案】
同学们结合所学知识设计出如下探究方案:
【结论与解释】
以上事实证明猜想 是正确的。
【反思与评价】
为避免在今后的实验中出现标签残缺的情况,在倾倒液体时应注意 。
15.(8分)某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如图:
(1)操作①的名称为 ,需要使用玻璃棒,其作用是 。
(2)Ⅰ中有关反应的化学方程式为 ,溶液由蓝色变为 色。
(3)固体A的成分是 、 (填化学式)。
(4)Ⅱ中加入过量的稀硫酸的目的是 。
(5)过程Ⅰ、Ⅱ中涉及反应的基本反应类型为 。
16.(9分)许多电子元件中都使用了黄铜。为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如表所示:
(1)兴趣小组同学发现:电子元件中的黄铜较难研磨成粉末,原因之一是黄铜合金的硬度比组成它的纯金属硬度 (填“大”或“小”)。
(2)黄铜合金中的铜不能与稀硫酸发生反应,原因是 。
(3)兴趣小组同学发现:生成氢气的质量既可通过实验测定获得,也可通过计算获得。计算方法是:所加稀硫酸总质量加上黄铜质量,最后减去烧杯中剩余物质的质量,计算的依据是 定律。
(4)黄铜粉末完全反应生成氢气的总质量,即m值为 。
(5)该黄铜中铜的质量分数为多少?(写出计算过程)
2020-2021学年广东省深圳实验中学联考九年级(上)期末化学试卷
参考答案与试题解析
一、单项选择题I:本大题共8小题,每小题1.5分,共12分。在每小题列出的四个选项中,只有一项最符合题意。
1.下列有关说法正确的是( )
A.工业上从空气中分离出氧气属于化学变化
B.用石灰浆刷墙壁,干燥后墙面变硬发生了化学变化
C.石油分馏后得到汽油、煤油、柴油等属于化学变化
D.干冰升华是化学变化
【分析】化学变化是指有新物质生成的变化,物理变化是指没有新物质生成的变化,化学变化和物理变化的本质区别是否有新物质生成;据此分析判断。
【解答】解:A、工业上从空气中分离出氧气的过程中没有新物质生成,属于物理变化,故说法错误。
B、用石灰浆刷墙壁,干燥后墙面变硬的过程中有新物质生成,属于化学变化,故说法正确。
C、石油分馏后得到汽油、煤油、柴油等的过程中没有新物质生成,属于物理变化,故说法错误。
D、干冰升华的过程中只是状态发生改变,没有新物质生成,属于物理变化,故说法错误。
故选:B。
2.“见微知著”,研究微观是化学学习中重要的内容,有以下表述:
①氯气:Cl2;②由三个氧原子构成的臭氧分子:3O;③粒子结构示意图表示的粒子:S2+;
④两个铁离子:2Fe2+;⑤导电、导热性最好的金属:Ag;⑥+2价的镁元素:Mg+2. 其中正确的有( )
A.②④⑤B.①⑤C.①③⑤D.①④⑥
【分析】①根据氯气是双原子分子进行分析;
②根据分子是由原子构成的进行分析;
③根据微观图示可知,硫离子带2个单位的负电荷进行分析;
④根据铁离子带三个单位的正电荷进行分析;
⑤根据导电、导热性最好的金属进行分析;
⑥根据元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后进行分析。
【解答】解:①氯气是双原子分子,化学式为Cl2,故正确;
②分子是由原子构成的,所以由三个氧原子构成的臭氧分子表示为O3,故错误;
③微观图示可知,硫离子带2个单位的负电荷,表示为S2﹣,故错误;
④铁离子带三个单位的正电荷,所以两个铁离子:2Fe3+,故错误;
⑤导电、导热性最好的金属,化学式为Ag,故正确;
⑥元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以;⑥+2价的镁元素表示为,故错误。
故选:B。
3.下列有关实验现象的说法正确的是( )
A.紫色石蕊遇到醋酸变红色
B.硫在空气中燃烧,产生明亮的蓝紫色火焰,有刺激性气味的气体生成
C.红磷在空气中燃烧,产生白雾
D.铁丝在空气中剧烈燃烧,放出大量的热,火星四射,有黑色熔融物生成
【分析】A、根据酸的化学性质,进行分析判断。
B、根据硫在空气中燃烧的现象,进行分析判断。
C、根据红磷在空气中燃烧的现象,进行分析判断。
D、根据铁丝在空气中不能燃烧,进行分析判断。
【解答】解:A、醋酸显酸性,紫色石蕊遇到醋酸变红色,故选项说法正确。
B、硫在空气中燃烧,产生淡蓝色火焰,有刺激性气味的气体生成,故选项说法错误。
C、红磷在空气中燃烧,产生大量的白烟,而不是白雾,故选项说法错误。
D、铁丝在空气中只能烧至发红,不会产生剧烈燃烧、火星四射,故选项说法错误。
故选:A。
4.2019年诺贝尔化学奖得主为锂电池研究者,碳酸乙烯酯(C3H4O3)可用作锂电池电解液。下列有关碳酸乙烯酯的说法正确的是( )
A.碳酸乙烯酯是由三个碳原子、四个氢原子和三个氧原子构成的
B.其中C、H、O三种元素的质量比为3:4:3
C.其中碳元素的质量分数最大
D.碳酸乙烯酯的相对分子质量为88
【分析】A、根据碳酸乙烯酯的微观构成,进行分析判断。
B、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断。
C、根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析判断。
D、根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答。
【解答】解:A、碳酸乙烯酯是由碳酸乙烯酯分子构成的,1个碳酸乙烯酯分子是由三个碳原子、四个氢原子和三个氧原子构成的,故选项说法错误。
B、其中C、H、O三种元素的质量比为(12×3):(1×4):(16×3)≠3:4:3,故选项说法错误。
C、C、H、O三种元素的质量比为(12×3):(1×4):(16×3)=9:1:12,其中氧元素的质量分数最大,故选项说法错误。
D、碳酸乙烯酯的相对分子质量为12×3+1×4+16×3=88,故选项说法正确。
故选:D。
5.下列实验方案不能达到实验目的的是( )
A.验证面粉粉尘能发生爆炸
B.验证分子在不断运动
C.探究物质燃烧的条件之一是需要可燃物
D.探究石蜡中含有氢元素
【分析】A、根据可燃性粉尘与空气混合遇灭火可能发生爆炸,进行分析判断。
B、根据一段时间后,A烧杯中的酚酞溶液变红色,进行分析判断.
C、根据薄铜片上的白磷和红磷、水中的白磷的燃烧情况,进行分析判断。
D、根据干冷的烧杯能检验水蒸气的存在,进行分析判断。
【解答】解:A、连接好装置,在小塑料瓶中放入干燥的面粉,点燃蜡烛,用塑料盖盖住罐.从橡皮管一端快速鼓入大量的空气,使面粉充满罐.就会听到“砰”的一声响,塑料盖被掀起,可验证面粉粉尘能发生爆炸,故选项实验方案能达到实验目的。
B、一段时间后,A烧杯中的酚酞溶液变红色,而两者没有直接接触,说明氨分子运动到了酚酞溶液中,故选项实验方案能达到实验目的。
C、铜片上的白磷燃烧,红磷不燃烧,水中的白磷不能燃烧,薄铜片上的白磷能与氧气接触,温度能达到着火点,水中的白磷不能与氧气接触,红磷温度没有达到着火点;可得出燃烧需要与氧气接触,且温度达到着火点;白磷、红磷均为可燃物,图中实验不能探究物质燃烧的条件之一是需要可燃物,故选项实验方案不能达到实验目的。
D、在火焰上方罩一个干而冷的烧杯,烧杯内壁出现水雾,说明生成了水,反应物氧气中只含有氧元素,说明石蜡中一定含有氢元素,故选项实验方案能达到实验目的。
故选:C。
6.如图是元素周期表的一部分,下列说法错误的是( )
A.三种元素的原子最外层电子数均小于4
B.C、N、O的原子序数依次增加
C.氧的相对原子质量为16.00
D.氮原子的核外电子数为7
【分析】根据图中元素周期表一格可以获得的信息:原子序数、相对原子质量、元素符号、元素种类等,结合给出的元素周期表的一部分进行分析判断即可。
【解答】解:A、根据元素周期表中一部分获取的信息,C、N、O的原子序数分别为6、7、8,根据原子序数=核电荷数=质子数=核外电子数,C、N、O原子的核外电子数分别为6、7、8,第一层上只能容纳2个电子,则它们的原子最外层电子数分别为4、5、6,故选项说法错误。
B、根据元素周期表中一部分获取的信息,C、N、O的原子序数分别为6、7、8,依次增加,故选项说法正确。
C、根据元素周期表中的一格中获取的信息,可知氧的相对原子质量为16.00,故选项说法正确。
D、根据元素周期表中的一格中获取的信息,氮元素的原子序数为7;根据原子序数=核电荷数=质子数=核外电子数,则氮原子的核外电子数为7,故选项说法正确。
故选:A。
7.下列有关叙述,对应的化学方程式、所属基本反应类型都正确的是( )
A.AB.BC.CD.D
【分析】根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;↑和↓的标注是否正确。若化学方程式书写正确,再根据反应特征确定基本的反应类型(化合、分解、置换、复分解)。
【解答】解:A、该化学方程式氧化铝的化学式书写错误,正确的化学方程式应为4Al+3O2═2Al2O3,故选项错误。
B、该化学方程式反应物条件应为高温,正确的化学方程式应为CaCO3CaO+CO2↑,故选项错误。
C、铁和盐酸反应生成氯化亚铁和氢气,正确的化学方程式为:Fe+2HCl═FeCl2+H2↑,故选项错误。
D、该化学方程式书写完全正确,该反应符合“多变一”的形式,符合化合反应的特征,属于化合反应,故选项正确。
故选:D。
8.生活处处有化学,安全时刻记心中。下列做法不合理的是( )
A.夜间发现家中石油液化气泄露,立即开灯查明泄露原因
B.用活性炭吸附冰箱中的异味
C.炒菜时,油锅不慎着火迅速用锅盖盖灭
D.高楼发生火灾时,用湿毛巾捂住口鼻在火场的浓烟中爬行逃生
【分析】A.根据防范爆炸的措施来分析;
B.根据活性炭的吸附性来分析;
C.根据灭火的原理来分析;
D.根据火场逃生的措施来分析。
【解答】解:A.可燃性的气体与氧气或空气混合后点燃易发生爆炸,开灯会产生电火花,易引燃混合气体,发生危险,故错误;
B.活性炭具有吸附性,所以可用活性炭吸附冰箱中的异味,故正确;
C.油锅起火,最佳的灭火措施是盖锅盖,起到隔绝氧气的作用,故正确;
D.用湿毛巾捂住口鼻在火场的浓烟中爬行逃生,可以防止有害气体和粉尘进入呼吸道,故正确。
故选:A。
二、单项选择题Ⅱ:(本大题共4小题,每小题2分,共8分。在每小题列出的四个选项中,只有一项最符合题意。)
9.如图是某化学反应的微观模型示意图。据此分析正确的是( )
A.参加反应的两种物质的分子个数比1:2
B.生成物中有三种物质,既有单质又有化合物
C.化学变化过程中,分子的种类不一定发生改变
D.此反应不属于化合反应也不属于置换反应
【分析】观察化学反应的微观模型示意图,分析反应物、生成物及反应的条件,写出反应的化学方程式;根据微粒的变化、物质的组成、反应的特点分析判断有关的说法。
【解答】解:由化学反应的微观模型示意图可知,该反应是硫化氢燃烧生成了二氧化硫和水,方程式是:2H2S+3O22SO2+2H2O。
A、由方程式可知,参加反应的两种物质的分子个数比2:3,故A分析不正确;
B、由微粒的变化和构成可知,生成物中有两种物质,都是化合物,故B分析不正确;
C、由微粒的变化可知,化学变化过程中,分子的种类一定发生改变,故C分析不正确;
D、由反应的特点可知,此反应不属于化合反应也不属于置换反应,故D分析正确。
故选:D。
10.下列各组转化中,不能一步实现的组合是( )
A.H2O2H2OH2
B.FeFe2O3Fe
C.KClO3O2Fe2O3
D.CH4CO2CO
【分析】A、过氧化氢在二氧化锰催化作用下分解生成水和氧气,电解水生成氢气和氧气;
B、铁和水、氧气反应生成氧化铁,高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳;
C、氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,铁在氧气中燃烧生成四氧化三铁;
D、甲烷燃烧生成水和二氧化碳,高温条件下二氧化碳和碳反应生成一氧化碳。
【解答】解:A、过氧化氢在二氧化锰催化作用下分解生成水和氧气,电解水生成氢气和氧气,该选项能够一步实现;
B、铁和水、氧气反应生成氧化铁,高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,该选项能够一步实现;
C、氯酸钾在二氧化锰催化作用下受热分解生成氯化钾和氧气,铁在氧气中燃烧生成四氧化三铁,该选项中铁不能一步转化成氧化铁;
D、甲烷燃烧生成水和二氧化碳,高温条件下二氧化碳和碳反应生成一氧化碳,该选项能够一步实现。
故选:C。
11.除去下列物质中的少量杂质,能达到目的的是( )
A.AB.BC.CD.D
【分析】根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变。除杂质至少要满足两个条件:①一般加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。
【解答】解:A、镁粉能与稀硫酸反应生成硫酸镁溶液和氢气,铜不与稀硫酸反应,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
B、足量铁粉能与CuSO4溶液反应生成硫酸亚铁溶液和铜,充分反应后过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确。
C、KClO3在二氧化锰的催化作用下生成氯化钾和氧气,二氧化锰作催化剂,反应前后质量不变,能除去杂质但引入了新的杂质二氧化锰,不符合除杂原则,故选项所采取的方法错误.
D、CaO能与水反应生成氢氧化钙,碳酸钙难溶于水,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误。
故选:B。
12.下列有关化学反应与反应时间对应的图形不正确的是( )
A.一定量的镁条在空气中点燃生成氧化镁的质量
B.加热高锰酸钾制取氧气时剩固体的质量
C.一定质量的木炭与过量氧气在密闭容器内加热使其充分反应
D.等质量的铁、锌分别与足量的稀硫酸反应,产生氢气的质量与反应时间的关系
【分析】A、镁燃烧生成氧化镁;
B、高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气;
C、木炭燃烧生成二氧化碳;
D、稀硫酸和铁反应生成硫酸亚铁和氢气,和锌反应生成硫酸锌和氢气。
【解答】解:A、镁燃烧生成氧化镁,过程中氧化镁质量不断增大,镁完全反应后氧化镁质量不再变化,该选项对应关系正确;
B、高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,随着反应进行固体质量减小,完全反应后固体质量不再变化,该选项对应关系正确;
C、一定质量的木炭与过量氧气在密闭容器内加热生成二氧化碳,随着反应进行木炭质量减小,最终消失,该选项对应关系不正确;
D、锌比铁活泼,反应速率较快,反应需要时间短,最终铁和稀硫酸反应生成的氢气多,该选项对应关系正确。
故选:C。
三、非选择题(本大题共4小题,共30分)
13.(7分)如图是实验室制取气体的一些装置,据图回答有关问题。(友情提示:以下所选装置均填装置序号)
(1)写出序号为②的仪器名称:② 集气瓶 。
(2)写出化学实验室中选用装置C制取氧气的化学方程式 2KMnO4K2MnO4+MnO2+O2↑ ;为获得较干燥的氧气,可选用 E (填字母)作为收集装置。
(3)试回答下列问题:实验室中制取二氧化碳可采用的发生装置是B,理由是 反应物为固体和液体,且不需要加热 。其反应的化学方程式是 2HCl+CaCO3=CaCl2+H2O+CO2↑ 。如果用A装置代替B,有什么优点 可以控制反应速率 。
【分析】(1)考查实验室常用仪器名称;
(2)根据装置特点选择反应物,然后根据反应物书写化学方程式;根据题目要求和气体性质选择收集装置;
(3)根据反应物状态和反应条件,选择发生装置;盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,据此书写化学方程式;根据装置特点总结装置优点。
【解答】解:(1)②为收集气体的集气瓶;
故答案为:集气瓶。
(2)C为固体加热发生装置,且带有棉花,故选高锰酸钾制取氧气,高锰酸钾在加热条件下反应生成锰酸钾、二氧化锰和氧气,书写化学方程式注意配平及气体符号,所以化学方程式为2KMnO4K2MnO4+MnO2+O2↑;制取干燥氧气,则不能用排水法收集,密度比空气大,可选向上排空气法收集,故选E为收集装置;
故答案为:2KMnO4K2MnO4+MnO2+O2↑;E。
(3)实验室采用大理石或石灰石与稀盐酸制取二氧化碳,反应物为固液混合物,且不需要加热,故可选B为发生装置;盐酸与碳酸钙反应生成氯化钙、水和二氧化碳,书写化学方程式注意配平及气体符号,所以化学方程式为2HCl+CaCO3=CaCl2+H2O+CO2↑;A带有注射器,可以控制加入液体的量,达到控制反应物浓度的目的,因此可以控制反应速率;
故答案为:反应物为固体和液体,且不需要加热;2HCl+CaCO3=CaCl2+H2O+CO2↑;可以控制反应速率。
14.(6分)某小组同学在协助老师整理化学试剂时,发现一瓶标签残缺的无色液体(如图)(温馨提示:标签上的5%表示该混合物中主要成分所占的质量分数)。他们对此瓶无色液体是什么产生了兴趣,于是进行了如下探究:
【大胆猜想】
猜想一:水; 猜想二:稀硫酸; 猜想三:过氧化氢溶液。
小组同学对标签又进行了仔细的观察、分析,他们一致认为猜想一不合理,理由是水是 纯净物 (填物质类别)。
【设计方案】
同学们结合所学知识设计出如下探究方案:
【结论与解释】
以上事实证明猜想 二 是正确的。
【反思与评价】
为避免在今后的实验中出现标签残缺的情况,在倾倒液体时应注意 标签向着手心 。
【分析】【大胆猜想】
小组同学对标签又进行了仔细的观察、分析,他们一致认为猜想一不合理,理由是水是纯净物。
【设计方案】
镁和稀硫酸反应生成硫酸镁和氢气;
过氧化氢在二氧化锰催化作用下分解生成水和氧气,氧气能使带火星的木条复燃。
【结论与解释】
根据实验事实证明猜想二是正确的。
【反思与评价】
为避免在今后的实验中出现标签残缺的情况,在倾倒液体时应注意标签向着手心,以防止残液下流腐蚀标签。
【解答】解:【大胆猜想】
小组同学对标签又进行了仔细的观察、分析,他们一致认为猜想一不合理,理由是水是纯净物。
故填:纯净物。
【设计方案】
实验过程如下所示:
故填:气泡;Mg+H2SO4═MgSO4+H2↑;MnO2。
【结论与解释】
以上事实证明猜想二是正确的。
故填:二。
【反思与评价】
为避免在今后的实验中出现标签残缺的情况,在倾倒液体时应注意标签向着手心,以防止残液下流腐蚀标签。
故填:标签向着手心。
15.(8分)某化学兴趣小组的同学想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计流程如图:
(1)操作①的名称为 过滤 ,需要使用玻璃棒,其作用是 引流 。
(2)Ⅰ中有关反应的化学方程式为 Fe+CuSO4═FeSO4+Cu ,溶液由蓝色变为 浅绿 色。
(3)固体A的成分是 Fe 、 Cu (填化学式)。
(4)Ⅱ中加入过量的稀硫酸的目的是 使铁完全反应 。
(5)过程Ⅰ、Ⅱ中涉及反应的基本反应类型为 置换反应 。
【分析】金属活动性顺序中,排在氢前面的金属,能和稀盐酸或稀硫酸反应生成盐和氢气,排在前面的金属,能把排在后面的金属从它的盐溶液中置换出来。
【解答】解:(1)操作①的名称为过滤,需要使用玻璃棒,其作用是引流。
故填:过滤;引流。
(2)Ⅰ中铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu,溶液由蓝色变为浅绿色。
故填:Fe+CuSO4═FeSO4+Cu;浅绿。
(3)固体A的成分是过量的Fe和Cu。
故填:Fe;Cu。
(4)Ⅱ中加入过量的稀硫酸的目的是使铁完全反应。
故填:使铁完全反应。
(5)过程Ⅰ、Ⅱ中涉及反应:铁和硫酸铜反应生成硫酸亚铁和铜,和稀硫酸反应生成硫酸亚铁和氢气,都是一种单质和一种化合物反应生成另外一种单质和一种化合物,都是置换反应。
故填:置换反应。
16.(9分)许多电子元件中都使用了黄铜。为测定某黄铜(假设合金中仅含铜和锌)中铜的质量分数,兴趣小组同学称取20g黄铜粉末于烧杯中,将80g稀硫酸分四次加入,充分反应,测得实验数据如表所示:
(1)兴趣小组同学发现:电子元件中的黄铜较难研磨成粉末,原因之一是黄铜合金的硬度比组成它的纯金属硬度 大 (填“大”或“小”)。
(2)黄铜合金中的铜不能与稀硫酸发生反应,原因是 在金属活动顺序中,铜在氢的后面,不能置换出稀硫酸中的氢 。
(3)兴趣小组同学发现:生成氢气的质量既可通过实验测定获得,也可通过计算获得。计算方法是:所加稀硫酸总质量加上黄铜质量,最后减去烧杯中剩余物质的质量,计算的依据是 质量守恒 定律。
(4)黄铜粉末完全反应生成氢气的总质量,即m值为 0.20 。
(5)该黄铜中铜的质量分数为多少?(写出计算过程)
【分析】(1)根据合金的特性进行分析;
(2)根据金属活动性规律进行分析;
(3)(4)根据质量守恒定律进行分析;
(5)根据氢气的质量和化学方程式计算出参加反应的锌的质量,然后根据黄铜中铜的质量分数=进行计算。
【解答】解:(1)合金的硬度要比其组分金属的硬度大;
(2)黄铜合金中的铜不能与稀硫酸发生反应,原因是:在金属活动顺序中,铜在氢的后面,不能置换出稀硫酸中的氢;
(3)由题可知,计算依据反应前后物质的质量总和相等,即质量守恒定律;
(4)通过分析表格中的信息可知,加入20g稀硫酸最多可生成0.08g氢气,当加入60g稀硫酸时,最多应该生成0.24g氢气,现在却生成了0.20g氢气,说明第三次加入20g稀硫酸时锌已经完全反应,所以第四次加入20g稀硫酸时不再有氢气生成,m=0.20;
(5)设锌的质量为x。
Zn+H2SO4=ZnSO4+H2↑
65 2
x 0.2g
x=6.5g
黄铜中铜的质量分数为:
=67.5%
答:黄铜中铜的质量分数为67.5%。
故答案为:
(1)大;
(2)在金属活动顺序中,铜在氢的后面,不能置换出稀硫酸中的氢;
(3)质量守恒;
(4)0.20;
(5)67.5%。
选项
叙述
化学方程式
基本反应类型
A
铝的自我保护
3Al+O2═Al3O2
化合反应
B
工业上制CO2
CaCO3CaO+CO2↑
分解反应
C
铁与盐酸混合
2Fe+6HCl═2FeCl2+3H2↑
置换反应
D
硫在空气中燃烧
S+O2SO2
化合反应
选项
物质(括号内为杂质)
除去杂质的方法
A
镁粉(铜粉)
加足量稀硫酸、过滤、洗涤、烘干
B
除去FeSO4溶液中少量的CuSO4
加入足量铁粉,充分反应后过滤
C
除去KCl固体中的少量KClO3
加入少量的二氧化锰,加热
D
CaO(CaCO3)
加水溶解、过滤
实验方案
实验现象
方案一:向盛有少量镁条的试管中加入适量的该液体。
观察到试管中有 产生。
涉及反应方程式为 。
方案二:向盛有少量 (填化学式)的试管
中加入适量的该液体,并将带火星的木条放在试管口。
观察到无气泡产生,带火星的木条不能复燃
第一次
第二次
第三次
第四次
加入稀硫酸的质量(g)
20
20
20
20
烧杯中剩余物的质量(g)
39.92
59.84
79.80
99.80
产生氢气的总质量(g)
0.08
0.16
0.20
m
选项
叙述
化学方程式
基本反应类型
A
铝的自我保护
3Al+O2═Al3O2
化合反应
B
工业上制CO2
CaCO3CaO+CO2↑
分解反应
C
铁与盐酸混合
2Fe+6HCl═2FeCl2+3H2↑
置换反应
D
硫在空气中燃烧
S+O2SO2
化合反应
选项
物质(括号内为杂质)
除去杂质的方法
A
镁粉(铜粉)
加足量稀硫酸、过滤、洗涤、烘干
B
除去FeSO4溶液中少量的CuSO4
加入足量铁粉,充分反应后过滤
C
除去KCl固体中的少量KClO3
加入少量的二氧化锰,加热
D
CaO(CaCO3)
加水溶解、过滤
实验方案
实验现象
方案一:向盛有少量镁条的试管中加入适量的该液体。
观察到试管中有 气泡 产生。
涉及反应方程式为 Mg+H2SO4═MgSO4+H2↑ 。
方案二:向盛有少量 MnO2 (填化学式)的试管
中加入适量的该液体,并将带火星的木条放在试管口。
观察到无气泡产生,带火星的木条不能复燃
实验方案
实验现象
方案一:向盛有少量镁条的试管中加入适量的该液体。
观察到试管中有气泡产生,是因为镁和稀硫酸反应生成硫酸镁和氢气,
反应方程式为:Mg+H2SO4═MgSO4+H2↑。
方案二:向盛有少量的MnO2试管中加入适量的该液体,并将带火星的木条放在试管口。
观察到无气泡产生,带火星的木条不能复燃,说明液体不是过氧化氢溶液
第一次
第二次
第三次
第四次
加入稀硫酸的质量(g)
20
20
20
20
烧杯中剩余物的质量(g)
39.92
59.84
79.80
99.80
产生氢气的总质量(g)
0.08
0.16
0.20
m
2022-2023深圳龙岗实验学校九年级(上)期末化学试卷: 这是一份2022-2023深圳龙岗实验学校九年级(上)期末化学试卷,共7页。
2021-2022学年广东省深圳市九年级(上)期末化学试卷(含详细答案解析): 这是一份2021-2022学年广东省深圳市九年级(上)期末化学试卷(含详细答案解析),共13页。试卷主要包含了1g,【答案】B,【答案】D,【答案】A,【答案】C等内容,欢迎下载使用。
初中化学九上广东省深圳市南山实验教育集团2019-2020学年九年级(上)期中化学试卷 含解析: 这是一份初中化学九上广东省深圳市南山实验教育集团2019-2020学年九年级(上)期中化学试卷 含解析,共34页。试卷主要包含了选择题,填空题,实验题等内容,欢迎下载使用。











