






高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH授课课件ppt
展开知识点一 单一溶液的pH计算1.强酸、强碱溶液的pH计算(1)强酸溶液:如HnA,设浓度为c ml·L-1,c(H+)= ml·L-1,pH=-lg c(H+)=-lg( )。 (2)强碱溶液(25 ℃):如B(OH)n,设浓度为c ml·L-1,c(OH-)=nc ml·L-1,c(H+)= ml·L-1,pH=-lg c(H+)=14+lg(nc)。
(3)强酸、强碱溶液pH计算方法强酸直接由酸的浓度求出 ,强碱先由碱的浓度求出 ,再根据水的离子积换算出 ,然后用公式pH= 求出pH。 2.酸溶液稀释后的pH变化规律(1)pH=1的盐酸加水稀释103倍后,溶液中c(H+)为 ml·L-1,pH为 。
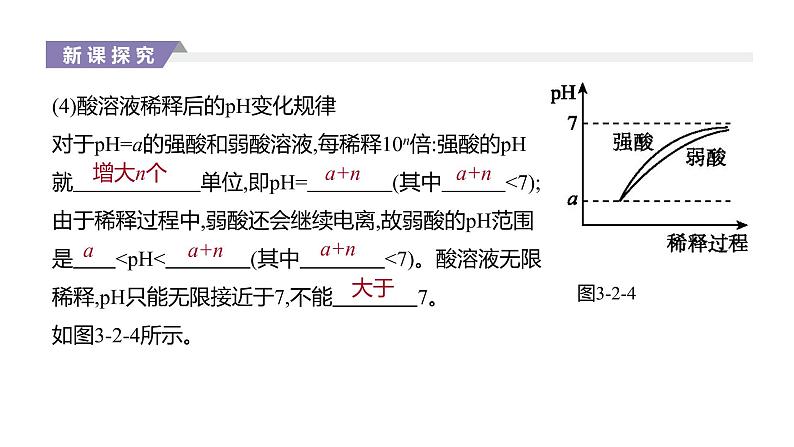
(4)酸溶液稀释后的pH变化规律对于pH=a的强酸和弱酸溶液,每稀释10n倍:强酸的pH就 单位,即pH= (其中 <7);由于稀释过程中,弱酸还会继续电离,故弱酸的pH范围是
[素养养成] 对于pH相同的强酸和弱酸(强碱和弱碱)溶液,稀释相同的倍数后,pH如何变化?而对于物质的量浓度相同的强酸和弱酸(强碱和弱碱)溶液,稀释相同的倍数,pH如何变化?
提示:稀释弱电解质溶液,能促进弱电解质的电离。pH相同的强酸和弱酸(强碱和弱碱)溶液,稀释相同的倍数后,弱酸(弱碱)的pH变化小于强酸(强碱)的pH变化 。物质的量浓度相同的强酸和弱酸溶液,稀释相同的倍数后,溶液pH均增大,且强酸的pH变化更大;而物质的量浓度相同的强碱和弱碱溶液,稀释相同的倍数后,溶液pH均减小,且强碱的pH变化更大。
例2 pH=2的a、b两种酸溶液各1 mL,分别加水稀释到1000 mL,其中pH与溶液体积V的关系如图3-2-6所示。下列说法正确的是( )A.a、b两酸溶液的物质的量浓度一定相等B.稀释后,a酸溶液的酸性比b酸溶液强C.x=6时,a是强酸,b是弱酸D.若a、b都是弱酸,则5>x>2
[解析] 读图可知,稀释过程中,b酸的pH变化小,则b酸较a酸弱,二者pH相等时,物质的量浓度一定不同,A项错误;读图知稀释后a溶液的pH大于b溶液的pH,则a中c(H+)小于b中c(H+),a酸溶液的酸性比b酸溶液的弱,B项错误;pH=2的a酸溶液稀释1000倍,pH不可能增加4,C项错误;若a、b都是弱酸,稀释1000倍后,a、b两溶液pH均要增大,且增加量均小于3,故5>x>2。
[特别提醒] 酸、碱稀释注意事项(1)弱酸、弱碱在稀释过程中既有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其pH的范围。(2)酸、碱无限稀释,pH无限接近于7,但不能超过7。
3.强酸与强碱混合后溶液pH的计算(1)25 ℃时,pH=12的NaOH溶液与pH=2的硫酸,若等体积混合后,溶液的pH为 ;若按9∶11的体积比混合后,溶液的pH为 ;若按11∶9的体积比混合后,溶液的pH为 。
(3)强酸(pH1)强碱(pH2)混合计算规律①若等体积混合pH1+pH2=14,则溶液显中性,pH=7;pH1+pH2≥15,则溶液显碱性,pH=pH2-0.3;pH1+pH2≤13,则溶液显酸性,pH=pH1+0.3。
[素养养成] 计算强碱混合溶液pH时,为什么要先求混合后的c(OH-),再根据KW求出溶液中的c(H+),而不是直接用混合前溶液的c(H+)进行计算?
提示:混合后溶液因电离呈强碱性时,溶液中H+全部由水电离产生,水电离产生的c(H+)几乎可忽略,所以碱性混合溶液pH计算时不能抓次要因素(用混合前H+浓度计算),应抓主要因素(用混合后OH-浓度计算H+浓度)。
例3 已知100 ℃时,0.01 ml·L-1 NaHSO4溶液中水电离的c(H+)=10-10 ml·L-1,该温度下将pH=8的NaOH溶液V1 L与pH=5的H2SO4溶液V2 L混合,所得溶液pH=7,则V1∶V2为( )A.2∶9 B.1∶9 C.1∶1 D.1∶2
例4 (1)在25 ℃下,将pH=3的硫酸溶液和pH=10的NaOH溶液混合,若要使混合后溶液的pH=7,则硫酸溶液和NaOH溶液的体积比约为 。
[解析]pH=3的硫酸溶液的c(H+)为10-3 ml·L-1,pH=10的NaOH溶液中c(OH-)为10-4ml·L-1,故若使混合后溶液的pH=7,则硫酸溶液和NaOH溶液两者中和反应需要物质的量相等,因此体积比应为1∶10;
(2)在25 ℃时,有pH为a的盐酸和pH为b的NaOH溶液,取Va L该盐酸,同该NaOH溶液中和,需Vb L NaOH溶液。填空:①若a+b=14,则Va∶Vb= (填数字)。 ②若a+b=13,则Va∶Vb= (填数字)。 ③若a+b>14,则Va∶Vb= (填表达式)。
[解析]25 ℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取Va L该盐酸用该NaOH溶液中和,需Vb L NaOH溶液,则有Va L×10-a ml·L-1=Vb L×10b-14 ml·L-1,即Va∶Vb=10a+b-14,①若a+b=14,则Va∶Vb=10a+b-14=1;②若a+b=13,则Va∶Vb=10a+b-14=1∶10=0.1;③若a+b>14,则Va∶Vb=10a+b-14。
[规律小结] 溶液pH计算的一般思维模型
2.25 ℃时,关于pH=2的盐酸,下列说法不正确的是( )A.溶液中c(H+)=1.0×10-2 ml·L-1B.加水稀释100倍后,溶液的pH=4C.此溶液中由水电离出的c(H+)=1.0×10-12 ml·L-1D.加入等体积pH=12的氨水,溶液呈中性
[解析] pH=-lg c(H+)=2,则溶液中c(H+)=1.0×10-2 ml·L-1,与题意不符,A错误;加水稀释100倍后,溶液中的溶质的物质的量不变,则溶液的c(H+)=1.0×10-4 ml·L-1,pH=4,与题意不符,B错误;KW=c(H+)×c(OH-),酸电离的c(H+)=1.0×10-2 ml·L-1,则水电离的c(OH-)=1.0×10-12 ml·L-1,水电离的c(H+)=c(OH-),则此溶液中由水电离出的c(H+)=1.0×10-12 ml·L-1,与题意不符,C错误;加入等体积pH=12的氨水,一水合氨为弱碱,则碱过量,溶液呈碱性,符合题意,D正确。
3.下列叙述正确的是( )A.醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>bB.25 ℃ 1.0×10-3 ml·L-1盐酸的pH=3.0,1.0×10-8 ml·L-1盐酸的pH=8.0C.1 mL pH=1的盐酸与10 mL NaOH溶液混合后pH=7,则NaOH溶液的pH=11D.pH=1的盐酸稀释100倍后,pH=3
[解析] 醋酸溶液加水稀释能促进电离,但由于溶液体积增大,氢离子浓度降低,溶液pH增大,即a
5.室温下,将20 mL 0.01 ml·L-1 KOH溶液与30 mL 0.005 ml·L-1H2SO4溶液混合并加水至100 mL。(1)KOH溶液的pH= ,H2SO4溶液的pH= ,混合液的pH= 。
[解析]0.01 ml·L-1 KOH溶液中氢氧根离子浓度为0.01 ml·L-1,则根据c(H+)c(OH-)=KW=10-14分析,氢离子浓度为10-12 ml·L-1,则pH=12;0.005 ml·L-1 H2SO4溶液中氢离子浓度为0.01 ml·L-1,根据pH=-lg c(H+)分析,则pH=2;KOH的物质的量为0.01 ml·L-1×0.02 L=2×10-4 ml,H2SO4中n(H+)=0.01 ml·L-1×0.03 L=3×10-4 ml,二者反应后n(H+)=1×10-4 ml ,c(H+) =1×10-3 ml·L-1,则有pH=3;
5.室温下,将20 mL 0.01 ml·L-1 KOH溶液与30 mL 0.005 ml·L-1H2SO4溶液混合并加水至100 mL。(2)将10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH(酸)与强碱的pH(碱)之间应满足的关系: 。
pH(酸)+pH(碱)=15
[解析]将10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,假设强酸的pH为a,则氢离子浓度为10-a ml·L-1,强碱的pH为b,则氢氧根离子浓度为10-14+b ml·L-1,则有10×10-a=10-14+b×1,则有-a+1=-14+b,则有a+b=15,pH(酸)+ pH(碱)=15。
1.等浓度的下列稀溶液,它们的pH由小到大排列的顺序正确的是 ( )①乙酸 ②盐酸 ③硫酸A.①②③ B.③②①C.②③① D.②①③
2.常温下,将pH=3的H2SO4和pH=12的NaOH溶液混合,当混合溶液的pH=10时,强酸和强碱的体积之比为( )A.1∶9 B.9∶1 C.10∶1 D.1∶10
(3)MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中不正确的是( )A.MOH是一种弱碱B.在x点,MOH完全电离C.在x点,c(M+)=c(R+)D.稀释前ROH溶液中c(OH-)是MOH溶液中c(OH-)的10倍
人教版高考化学一轮总复习第9章第2节水的电离和溶液的pH课时教学课件: 这是一份人教版高考化学一轮总复习第9章第2节水的电离和溶液的pH课时教学课件,共60页。PPT课件主要包含了环节1课前自主复习,环节2高考热点突破,环节3新情境专项练等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教学演示课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH教学演示课件ppt,共60页。PPT课件主要包含了已知浓度,的酸或碱,未知浓度的碱或酸,主要仪器及使用,2滴定,不恢复,二至三,浅红色,酸或碱的量,1滴定前的准备等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH教案配套ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH教案配套ppt课件,共60页。PPT课件主要包含了H2O,H++OH-,3特点,水的离子积常数,2结论,2pH,课堂回眸等内容,欢迎下载使用。













