

【化学】江苏省兴化一中2018-2019学年高二上学期期末考试
展开江苏省兴化一中2018-2019学年高二上学期期末考试.
本试卷可能用到的相对原子质量:H 1 N 14 O 16 S 32 Cl 35.5 Cu 64 I 127
一、单项选择题: (本部分23题,每题3分,共69分)。
1.我国首飞的长征七号运载火箭采用液氧和煤油作为推进剂。煤油属于
A.纯净物 B.混合物 C.氧化物 D.单质
2.下列物质不属于天然高分子化合物的是
A.淀粉 B.蚕丝 C.油脂 D.纤维素
3.据报道,某些建筑材料会产生放射性同位素氡,从而对人体产生伤害。该同位素原子的中子数与质子数之差是
A. 50 B. 136 C.86 D. 222
4.下列变化属于化学变化的是
A.拨云见日 B.剪纸成花 C.酿谷成酒 D.磨豆成浆
5.下列指定物质的主要成分与化学式对应不正确的是
A.水煤气——CO2、H2 B.磁性氧化铁——Fe3O4
C.漂白粉——Ca(ClO)2与CaCl2的混合物 D.生石灰——CaO
6.下列化学用语表示正确的是
A.乙酸的结构简式:C2H4O2
B.镁离子的结构示意图:
C.HF的电子式:
D.碳酸氢钠的电离方程式:NaHCO3 = Na++HCO3-
7.以下物质间的转化不能通过一步反应实现的是
A.NO →NO2 B.NO2 →NO C.NH3→NO D.N2 → NO2
8.某溶液与Al反应能放出H2,下列离子在该溶液中一定能大量共存的是
A.NH4+、Fe2+、NO3-、SO42- B.Na+、K+、Cl-、SO42-
C.Mg2+、H+、Cl-、NO3- D.K+、Ca2+、HCO3-、Cl-
9.下列气体中与NO气体的收集方法一定相同的是( )
A.N2 B.O2 C.NH3 D.NO2
10.下列物质中含有共价键的共价化合物是
A.NH4Cl B.MgBr2 C.N2 D.H2O
11. 下列有关物质应用的叙述中,正确的是
A.Na2CO3可用于治疗胃酸过多 B.水玻璃浸泡过的木材能防火
C.明矾用于饮用水消毒 D.晶体硅用于制造光导纤维
12.用NA表示阿伏加德罗常数的值。下列判断正确的是
A.常温常压下,28 g N2含有原子数为2NA
B. 5.6gFe与足量盐酸反应失去的电子数为0.3 NA
C.标准状况下22.4L水中含有的H2 O分子数为NA
D. 1 mol·L-1 Al2(SO4)3溶液中含SO42-数目为3NA
13.下列反应中热量变化与下图一致的是
A.CO 和 O2 反应
B.油脂在人体中氧化
C.NaOH 溶液和 HNO3 溶液反应
D.C 和 C O2反应
14.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3K2O+5Na2O+16N2↑,有关该反应说法正确的是
A.属于复分解反应 B.KNO3发生氧化反应
C.NaN3是还原剂 D.NaN3和KNO3中氮元素化合价均降低
15.下列反应的离子方程式书写正确的是
A.铁和稀硝酸反应: 2Fe+6H+=2Fe 3++3H 2↑
B.稀硫酸与氢氧化钡溶液反应: H++SO42一+Ba2++OH一=BaSO4↓+H2O
C.氯气与水反应: Cl2+H2O=2H++Cl-+ClO-
D.二氧化氮和水反应: 3NO2+H2O=2H++2NO3-+NO
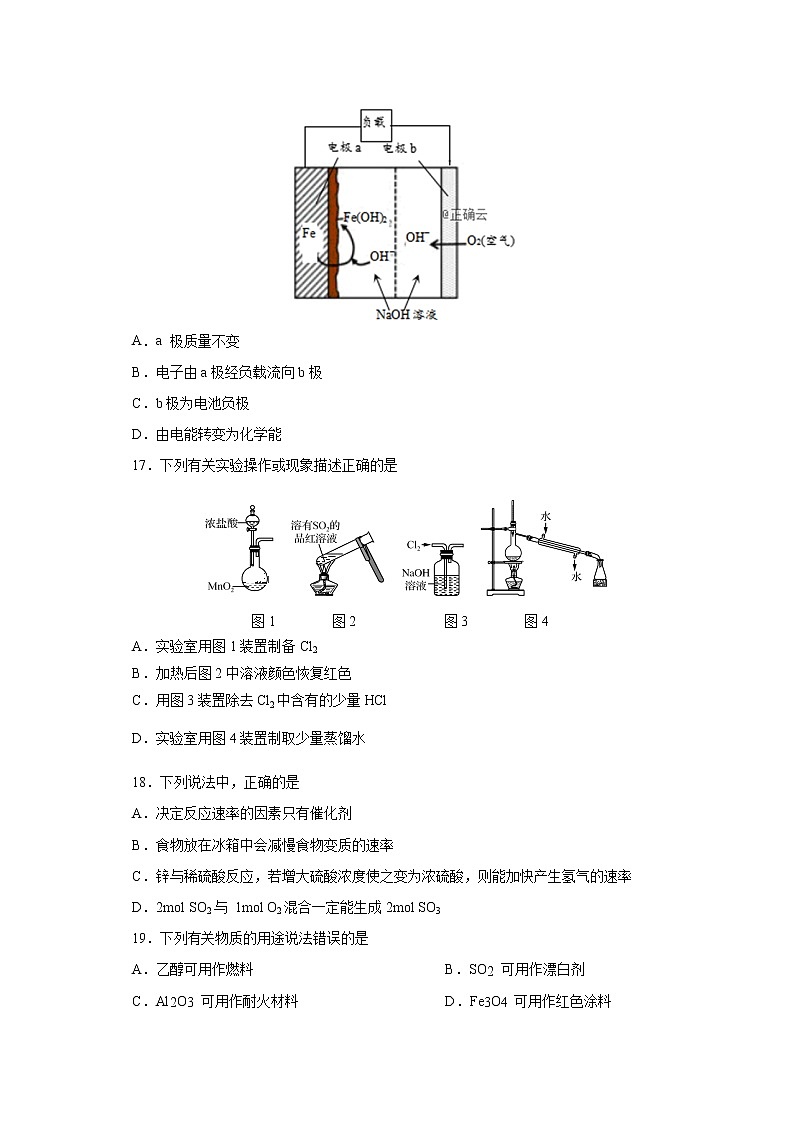
16.美国NASA曾开发一种铁-空气二次电池。该电池放电时,其原理如下图所示,电池反应为:2Fe+O2+2H2O=2Fe(OH)2。有关该电池放电时的说法正确的是
A.a 极质量不变
B.电子由a极经负载流向b极
C.b极为电池负极
D.由电能转变为化学能
17.下列有关实验操作或现象描述正确的是
图1 图2 图3 图4
A.实验室用图1装置制备Cl2
B.加热后图2中溶液颜色恢复红色
C.用图3装置除去Cl2中含有的少量HCl
D.实验室用图4装置制取少量蒸馏水
18.下列说法中,正确的是
A.决定反应速率的因素只有催化剂
B.食物放在冰箱中会减慢食物变质的速率
C.锌与稀硫酸反应,若增大硫酸浓度使之变为浓硫酸,则能加快产生氢气的速率
D.2mol SO2与 1mol O2混合一定能生成2mol SO3
19.下列有关物质的用途说法错误的是
A.乙醇可用作燃料 B.SO2 可用作漂白剂
C.Al2O3 可用作耐火材料 D.Fe3O4 可用作红色涂料
20.下列关于乙醇和乙酸的说法中,正确的是
A.乙醇和乙酸分子中都含有碳氧双键
B.乙醇和乙酸均能使紫色石蕊试液变红
C.乙醇和乙酸均不能使酸性高锰酸钾溶液褪色
D.乙醇和乙酸在一定条件下能发生酯化反应
21.下列化学方程式书写正确的是
A. CH2=CH2 + Br2 CH3CHBr2
B.
C.
D.
22.X、Y、Z、W是原子序数依次增大的短周期主族元素。Y与W同主族,Z所在的族序数等于周期数,X、Y最外层电子数之和为7;X、Z原子的电子数总和与Y、W原子的电子数总和之比为7∶12。下列说法正确的是
A.原子半径:r(X)<r(Y)<r(Z)<r(W)
B.Y的简单气态氢化物的热稳定性比W的弱
C. 常温下,Z的单质一定易溶于由X、Y、W三种元素组成的化合物的溶液
D.由X、Y组成的物质与由Y、W组成的物质化合,可能发生氧化还原反应
23.某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO、NH、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是 ( )
A. 一定存在SO42-、CO、NH,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO、NH、Cl-,一定不存在Na+、K+
C. c(CO)=0.01mol·L-1,c(NH)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
二、 非选择题(本部分3题,共31分)
24.A.《化学与生活》(15分)
(1)(5分)合理饮食和正确用药,是人体健康的重要保证。现有下列物质 A.新鲜的橙汁 B.葡萄糖 C.食盐 D.小苏打 E.青霉素,请按下列要求填空(填序号)。
应用最广泛的抗生素之一的是 ,可直接进入血液,补充能量的是 ,既可作为疏松剂,又可治疗胃酸过多的是 。
碱式碳酸铝[Mg3Al(OH)7CO3]是一种治疗胃酸的药物,不溶于水,但溶于胃酸。试写出其与胃酸反应的离子方程式:__________________________________。
(2)(5分)保护环境人人有责,化学也能让生活更美好。
①经过百姓和政府的努力,位于某规划区的一座大型钢铁厂搬迁后,附近居民将不再受到该厂产生的红棕色烟尘的困扰。你认为红棕色烟尘是________(填字母)。
A. CaCO3粉尘 B. P2O5粉尘 C. Fe2O3粉尘 D. SiO2粉尘
②全国各地的污水处理厂正在升级改造,处理废水时加入明矾可作为混凝剂以吸附水中的杂质,明矾的化学式为____________________;漂白粉可用来杀菌消毒,工业上利用氯气和石灰乳制取漂白粉的化学反应方程式是__________________________。
③为了确保空气质量的优良率,人们需要定时测定空气中各种污染物的浓度来计算出空气污染指数。因此,人们需要监测的空气污染物除了可吸入颗粒物(PM10)、二氧化硫以外,还有____________________。
(3)(5分)环境友好型城市建设是城市规划(2011~2020 年)重点之一。
①在机动车尾气系统中装置催化转化器,可将尾气中的 NO、CO 转化为可参与大气生态环境循环的无毒气体,写出NO和CO在一定条件下反应的化学方程式:___________。
②脱硫、脱碳是指将燃煤中产生的 SO2、CO2 去除,减少其排放的过程。向煤中加入适量生石灰,可大大减少 SO2 的排放,并可回收得到 ____ ; CO2 和 H2 在催化剂及高温、高压条件下可以合成乙醇,该反应的化学方程式为 。
25.(6分)在下图所示的物质转化关系中。D、E、H、J为常见单质,物质G是最常见的液体, B、G组成元素相同,C、K组成元素相同,C、D的相对分子质量相同,气体K能使湿润的红色石蕊试剂变蓝,F、K的水溶液酸碱性相同,气体L不能用排空气法收集。反应①是工业制取金属E的重要方法(部分反应条件未列出)。
请回答下列问题:
(1) C的化学式为______________。 (2) K的电子式为______________。
(3) 反应②的离子方程式为________________________________________。
(4) 反应③的化学方程式为________________________________________。
26.(10分)海带中含有丰富的碘。为了从海带中提取碘并测定海带中碘元素的百分含量,某研究性学习小组称量了1 000 g海带,设计并进行了以下实验:
(1) 步骤①中高温灼烧海带时,除需要三脚架、泥三角、酒精灯、玻璃棒外,还需要用的实验仪器是________。
(2) 步骤③的实验操作名称是______________。
(3) 步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:____________。
(4) 请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:____________。
(5) 在步骤④中加入5.000 g MnO2实验后又回收了3.260 g,通过计算求海带中碘元素的百分含量。
参考答案
一、单项选择题:共69分。
选项 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
答案 | B | C | A | C | A | D | D | B | A | D | B | A |
选项 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | / |
答案 | D | C | D | B | B | B | D | D | B | D | D | / |
二、非选择题:共31分。
24.(15分)A.化学与生活
(1)(共5分)E、B、D (各1分,共3分)
Mg3Al(OH)7CO3+9H+===3Mg2++Al3++8H2O+CO2↑(2分)
(2)(共5分)① C (1分)
② KAl(SO4)2·12H2O(1分)
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O (2分)
③二氧化氮(NO2) (1分)
(3)(共5分) ①2CO+2NO2CO2+N2 (2分)
②CaSO4或(CaSO4·2H2O)(1分)
2CO2+6H2 =高=温==、=加==压= CH3CH2OH+3H2O (2 分)
25.(6分)(1) N2H4 (1分) (2) (1分)
(3)2Al+2OH-+2H2O===2AlO+3H2↑(2分)
(4)4NH3+5O24NO+6H2O (2分)
26.(10分)
(1)坩埚(1分) (2)过滤(1分)
(3) 2I-+MnO2+4H+===Mn2++I2+2H2O (2分)
(4)取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明还有单质碘。 (2分)
(5)0.508%
加入5.000 g MnO2实验后又回收了3.260 g即实际参加反应的MnO2为1.74 g,设I元素的质量为x,根据离子方程式:
2I-+MnO2+4H+===Mn2++I2+2H2O
254 87
x 1.74
解得x=5.08 g,(2分)
则海带中碘元素的质量分数为×100%=0.508%。(2分)








