






高中人教版 (2019)第三节 化学键课文配套ppt课件
展开【学习目标与核心素养】
从元素周期表可以看出,到目前为止,已经发现的元素有一百多种。然而,由这一百多种元素的原子构成的物质已超过1亿种。那么,元素的原子之间通过什么作用形成如此丰富的物质呢?
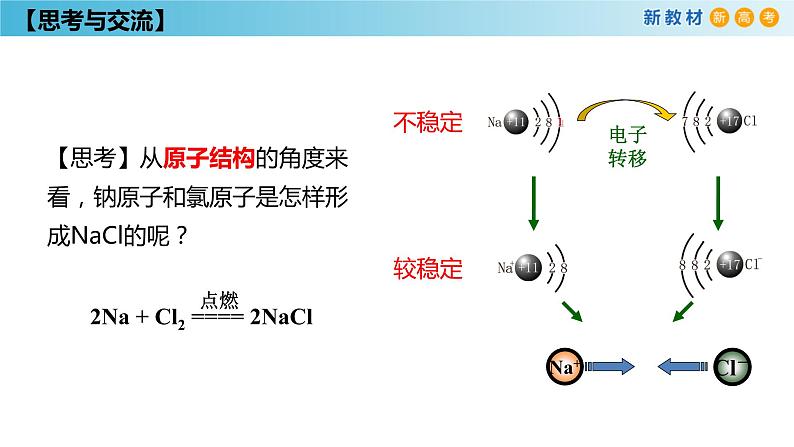
【思考】从原子结构的角度来看,钠原子和氯原子是怎样形成NaCl的呢?
带相反电荷离子之间的强烈相互作用
4. 原子形成离子键
静电作用(静电吸引和静电排斥的平衡)
5. 离子键成键的原因是原子间相互 电子达到 结构;体系的总能量 。
6. 离子化合物(1)离子化合物的概念是 。(2)请举例说明常见的离子化合物的类型:_______________________________ 。
活泼金属氧化物(如Na2O、MgO等);
绝大多数盐(如NaCl、K2SO4、CaCO3等);强碱[如NaOH、Ba(OH)2等]
离子键的三个“一定”和两个“不一定”(1)三个“一定”①离子化合物中一定含有 ;②含有 的物质一定是离子化合物;③ 中一定含有阴离子和阳离子。(2)两个“不一定”①离子化合物中不一定含有金属元素,如NH4Cl、NH4NO3等;②含有金属元素的化合物不一定是离子化合物,如AlCl3。
在元素符号周围用小黑点 · (或×)来表示原子的最外层电子的式子
(2)简单离子的电子式
在元素符号四个方向逐一放置电子
②相同离子不能合并, 同性电荷不直接相邻
①由阴、阳离子的电子式组成
1、写出下列微粒的电子式:硫原子、 溴原子、氟原子、 铝原子硫离子、 溴离子、氟离子、 铝离子
2、写出下列微粒的电子式:
(4)用电子式表示由原子形成离子化合物的过程
④右侧写离子化合物的电子式
②用弧形箭头表示电子转移的方向
3、下列用电子式表示化合物的形成过程正确的是( )
【思考】为什么2个氢原子结合成氢分子,2个氯原子结合成氯分子,而不是3个、4个呢?为什么1个氢原子和1个氯原子结合成氯化氢分子,而不是以其他的个数比相结合呢?
H2 + Cl2 = 2HCl
在HCl分子的形成过程中,没有发生电子的得失,而是通过共用电子对双方达到稳定结构
原子之间通过共用电子对所形成的强烈相互作用,叫共价键
不同原子之间以共用电子对形成分子的化合物。
(2) 多原子非金属单质
(3) 含根的离子化合物
含有共价键的化合物不一定是共价化合物
NaOH 、 Na2O2 、 NH4Cl 、NH4NO3
Cl2、 O3、 P4
HCl、 CO2 、NH3
共价键的两个“一定”和两个“不一定”
(1)两个“一定”①共价化合物中一定 共价键;②共价化合物中一定 离子键。
(2)两个“不一定”①含共价键的物质不一定是共价化合物,也可能是单质,如O2、N2、H2、Cl2等;②含共价键的化合物不一定是共价化合物,也可能是离子化合物,如NaOH中含有O—H共价键,Na2O2中含有O—O共价键,NH4Cl中含有N—H共价键,但它们都是离子化合物。
非极性键:共用电子对不发生偏移
极性键:共用电子对偏向某一方
①每个原子一般达到相对稳定结构
②不加中括号[ ],不标正负电荷数
③原子周围共用电子对数=8-原子最外层电子数
6、分子的电子式和结构式
(2)结构式
分别用“-、═、≡”表示一对、二对和三对共用电子对
【共价键形成的分子及其结构模型】
指出下列物质中的共价键类型
O2CH4CO2H2O2Na2O2NaOH
7、用电子式表示原子形成共价键
使离子或原子相结合的强烈相互作用
(3) 化学反应的实质
AgNO3 +NaCl = AgCl ↓ + NaNO3
旧化学键先破后立和新化学键的形成过程
离子化合物与共价化合物的比较
离子键或离子键与共价键
1、画出下列物质的电子式,后用线标出化学键种类
A、HCl B、N2 C、NaCl D、NaOH E、Na2O2 F、NH4Cl
Na O O Na
[ ]
2、判断以下说法的正误
A、离子化合物一定含离子键,共价化合物一定含共价键。 B、含离子键的化合物一定为离子化合物。C、金属元素与非金属元素之间一定形成离子键。D、由非金属元素组成的化合物一定不含离子键。E、有离子就一定可以形成离子键。
3、下列说法正确的是( ) A、含有金属元素的化合物一定是离子化合物 B、第ⅠA族和第ⅦA族原子化合时,一定生成离子键 C、由非金属元素形成的化合物一定不是离子化合物 D、活泼金属与非金属化合时,能形成离子键
4、下列说法正确的是( ) A.离子键就是使阴、阳离子结合成化合物的静电引力 B.所有金属与所有非金属原子之间都能形成离子键 C.在化合物CaCl2中,两个氯离子之间也存在离子键 D.钠原子与氯原子结合成氯化钠后体系能量降低
AlCl3为共价化合物
人教版 (2019)必修 第一册第三节 化学键获奖ppt课件: 这是一份人教版 (2019)必修 第一册第三节 化学键获奖ppt课件,共35页。PPT课件主要包含了核心素养,教学目标,Cl-,电子转移,离子键,电子式,直接用离子符号,简单阳离子,简单阴离子,1原子的电子式等内容,欢迎下载使用。
2020-2021学年第四章 物质结构 元素周期律第三节 化学键课文配套课件ppt: 这是一份2020-2021学年第四章 物质结构 元素周期律第三节 化学键课文配套课件ppt,共30页。PPT课件主要包含了力的作用,NaCl,金刚石,化学键,注意①直接相邻,②强烈的相互作用,离子键,共价键,金属键,氯气和金属钠的反应等内容,欢迎下载使用。
高中人教版 (2019)第四章 物质结构 元素周期律第三节 化学键教课ppt课件: 这是一份高中人教版 (2019)第四章 物质结构 元素周期律第三节 化学键教课ppt课件,共34页。PPT课件主要包含了Cl-等内容,欢迎下载使用。













