






人教版 (2019)必修 第一册第二节 金属材料获奖课件ppt
展开知识点一 铁合金1.合金
(1)定义:由两种或两种以上的_________或_________与__________熔合而成的具有_____________的物质。(2)性质:合金具有许多优良的物理、化学或机械性能,在许多方面不同于各成分金属。①硬度:合金的硬度一般_________成分金属。②熔点:合金的熔点多数_________成分金属。
合金钢,常见的是不锈钢
知识点二 铝和铝合金1.铝与氧化铝的化学性质
(1)Al与O2的反应:_____________________。(2)Al与盐酸的反应 _______________________________。Al2O3与盐酸的反应Al2O3+6HCl===2AlCl3+3H2O
4Al+3O2===2Al2O3
2Al+6HCl===2AlCl3+3H2↑
(3)Al与NaOH溶液的反应 ___________________________________________。Al2O3与NaOH溶液的反应________________________________。
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Al2O3+2NaOH===2NaAlO2+H2O
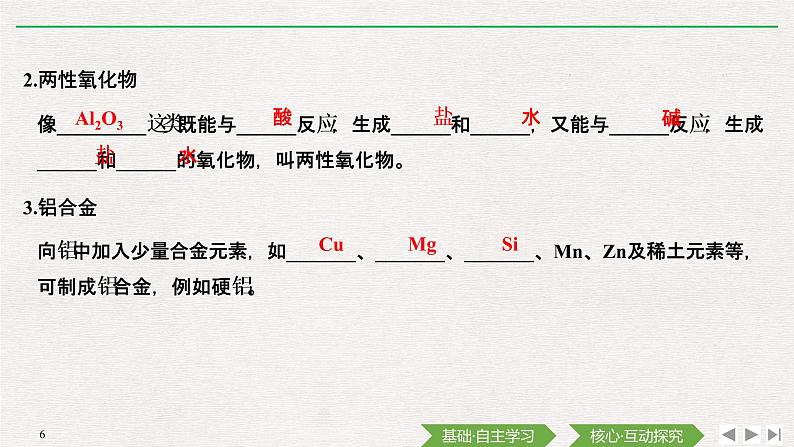
像_________这类既能与______反应,生成______和______,又能与______反应,生成______和______的氧化物,叫两性氧化物。
向铝中加入少量合金元素,如_______、_______、_______、Mn、Zn及稀土元素等,可制成铝合金,例如硬铝。
知识点四 物质的量在化学方程式计算中的应用1.物质的量与各物理量之间的关系
(1)已知物质的质量m:n=______(2)已知标准状况下气体体积V:n= ______(3)已知物质的粒子数N:n= ______(4)已知溶液中的物质的量浓度c:n= ______
2.物质的量在化学方程式计算中的应用
微判断(1)合金一定是不同金属熔合而成的具有金属特性的化合物。( )(2)生铁的熔点比铁低,但机械强度和硬度比铁高。( )(3)青铜比纯铜的硬度低。( )(4)生铁中的铁与纯铁的化学性质不同。( )答案 (1)× (2)√ (3)× (4)×
微训练1.镁铝合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )
A.不易生锈B.导电性好C.密度小D.强度高答案 B
2.制造货币,应该根据下列哪些性质而选材( )
A.从化学性质来看,金属材料化学性质应稳定B.从物理性质来看,金属材料应有较低的熔点C.从物理性质来看,金属材料应对强度、硬度无要求D.制造货币的金属本身的价值应高于货币的面值答案 A
3.对于铝和烧碱溶液的反应,下列说法错误的是( )
A.铝是还原剂B.该反应是氧化还原反应C.该反应说明所有金属都能与碱反应D.H2为还原产物解析 铝与烧碱溶液反应的化学方程式为:2Al+2NaOH+2H2O===2NaAlO2+3H2↑,分析元素化合价变化可知反应为氧化还原反应,铝是还原剂,H2为还原产物,A、B、D正确。铝能与烧碱溶液反应,并不能说明所有金属都能与碱反应,如镁、铁、铜等均不与碱溶液反应。答案 C
4.物质在发生化学反应时( )
A.它们的质量一定相等B.它们的物质的量一定相等C.它们的质量比等于化学方程式中化学计量数之比D.它们的物质的量之比等于化学方程式中化学计量数之比解析 发生化学反应时各物质的物质的量之比等于化学方程式中的化学计量数之比。答案 D
“化学反应前后质量是守恒的,那么物质的量也一定守恒。”这种说法正确吗?提示 错误。化学方程式中各物质的物质的量之比=各物质的化学计量数之比,所以化学反应前后物质的量可能增大,可能减小,也可能不变。
学习任务1 合金的性质
1.合金的性质是各成分金属的性质之和吗?提示 合金具有许多优良的物理、化学性质和机械性能,在物理性质、机械性能方面优于各成分金属,不是简单地加合;但一般认为在化学性质上,合金体现的是各成分金属的化学性质。2.已知铜的熔点为1 083 ℃,钠的沸点为883 ℃,试问铜与钠能否形成合金?提示 不能。当铜开始熔化时,钠已经气化,所以二者不能形成合金。
合金不一定全是金属元素
(1)合金中一定含有金属元素,可能含有非金属元素。(2)合金是混合物。(3)合金具有金属特性,如导电、传热等。(4)合金形成后会影响各成分金属的物理性质,如合金的熔点一般比成分金属低,而硬度、机械强度一般比成分金属高;但一般来说各成分金属均保持了其原有的化学性质。
【例题1】 下列关于合金的说法错误的是( )
A.合金是由两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质B.镁铝合金的熔点比镁和铝都高C.在合金中加入适量的稀土金属能大大改善合金的性能D.青铜、硬铝、钢都是合金
解析 合金是由两种或两种以上的金属或金属与非金属熔合而成的具有金属特性的物质,故A正确;镁铝合金的熔点比镁和铝都低,故B错误;在合金中加入适量稀土金属或稀土金属的化合物,就能大大改善合金的性能,故C正确;青铜、硬铝、钢都是由两种或两种以上的金属(或金属与非金属)熔合在一起形成的具有金属特性的物质,属于合金,故D正确。答案 B
变式训练1 合金相对于纯金属制成的金属材料来说优点是( )
①合金的硬度一般比它的各成分金属的大 ②一般合金的熔点比它的各成分金属的更低 ③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛A.①②③⑤B.②③④C.①②④D.①②④⑤解析 合金具有许多优良的物理、化学或机械性能,在许多方面优于各成分金属。例如,合金的硬度一般比其各成分金属的硬度大,多数合金的熔点比其各成分金属的熔点低,但合金的导电性比纯金属弱。答案 A
学习任务2 铝与盐酸、氢氧化钠溶液的反应
1.等量的铝分别与足量的盐酸和NaOH溶液反应,消耗HCl和NaOH的物质的量有什么关系?
提示 等量铝与足量盐酸、NaOH溶液反应,消耗HCl和NaOH的物质的量之比为3∶1。
2.等量的铝分别与足量的盐酸和NaOH溶液反应,生成H2的量有什么关系?提示 相同状况下,二者产生氢气体积比为1∶1。3.足量的铝与等物质的量浓度、等体积的盐酸和NaOH反应,生成H2的量又有什么关系?提示 足量铝与等物质的量的盐酸和NaOH溶液反应,相同状况下,产生H2体积比为1∶3。
1.铝与氢氧化钠溶液反应的实质
铝先与强碱溶液中的水反应生成H2和Al(OH)3,然后Al(OH)3再与NaOH反应生成H2O和NaAlO2,反应中铝作还原剂,水作氧化剂,NaOH无电子得失。用双线桥法和单线桥法分别表示为
2.铝与盐酸或氢氧化钠溶液反应中四种“量”的关系
(1)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗盐酸和氢氧化钠的物质的量之比为3∶1。(2)等量的铝分别与足量的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为1∶1。(3)足量的铝分别与等物质的量浓度、等体积的盐酸和氢氧化钠溶液反应,相同状况下,产生H2的体积比为1∶3。
【例题2】 取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,标准状况下均产生5.6 L气体,则两份铝片的质量之比为( )
A.一定为1∶1B.可能为2∶3C.一定为3∶2D.可能为1∶6解析 酸、碱均足量,则Al完全反应,且生成氢气的量相同,则H+得到的电子数相同,可知Al失去的电子数也相同,即参加反应的Al的量相同,两份铝片的质量之比为1∶1,A项正确。答案 A
变式训练2 用铝箔包裹0.1 ml金属钠,用针扎若干个小孔,放入水中,完全反应后,放出的气体体积(标准状况)为( )
A.无法确定 LC.大于1.12 LD.小于1.12 L解析 首先发生的反应是2Na+2H2O===2NaOH+H2↑,标准状况下0.1 ml Na与水反应产生的H2的体积为1.12 L,然后发生的反应是2Al+2NaOH+2H2O===2NaAlO2+3H2↑,此反应又能产生部分H2,故最后放出的H2的体积大于1.12 L。答案 C
学习任务3 (核心素养)物质的量应用于化学方程式的计算
一、知识要点1.化学计算的基本步骤
写——写出相关的化学方程式标——在方程式中有关物质的化学式下面标出已知物质和所求物质有关物理量的关系,遵循“左右相当,上下一致”原则并代入已知量和未知量列——列出比例式解——根据比例式求解答——简明地写出答案
2.物质的量应用于化学计算的基本方法
(1)把已知物质的物理量转化为物质的量;(2)根据化学方程式或关系式,根据已知物质的物质的量求出未知物质的物质的量,同时注意判断是否恰好反应,若某反应物量不足,用该物质进行求解;(3)把未知物质的物质的量转化为未知物的所求物理量。
3.有关物质的量的计算中的“三个规范”
(1)书写规范:各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量,“N”表示微粒数,而“n”表示物质的量。(2)符号规范:①设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应HCl溶液的体积为V[HCl(aq)]。②各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求溶质NaOH的质量时就写成:m(NaOH)=c(NaOH)×V[NaOH(aq)]×M(NaOH)。(3)单位规范:把已知量代入计算式中计算时都要带单位且单位要统一。
【素养解题】[典例示范] 将2.3 g钠投入到97.8 g水中,反应完毕后,得到100 mL溶液,求:
(1)产生的氢气在标准状况下的体积为________。(2)所得氢氧化钠溶液的溶质质量分数为________。(3)所得氢氧化钠溶液的物质的量浓度为________。(4)在K2Cr2O7+14HCl(浓)===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 ml电子转移时生成Cl2的体积为________(标准状况),被氧化的HCl的物质的量为________。
[物质的量应用于化学计算的解题思维模型]
答案 (1)1.12 L (2)4% (3)1 ml/L (4)3.36 L 0.3 ml
解析 设原溶液中H2SO4和CuSO4的物质的量分别为x、y。Fe + H2SO4===FeSO4+H2↑ Δm(固体质量减少)56 g 1 ml 56 g x 56xFe + CuSO4===FeSO4+Cu Δm(固体质量增加)56 g 1 ml 64 g 8 g y 8y
2.有关合金的叙述正确的是( )
A.合金的密度比各成分金属小B.多数合金比成分金属熔点低,硬度大C.合金的导电性能比成分金属强D.合金的抗腐蚀性能都很好解析 合金与成分金属相比某些性能增强,某些性能减弱。多数合金的熔点比各成分金属低。答案 B
3.只含有下列成分的物质一定不是合金的是( )
A.Fe、CB.Cu、ZnC.Al、CuD.C、Si解析 合金必须要含有金属,是两种或两种以上的金属(或金属跟非金属)熔合在一起所形成的具有金属特性的物质。答案 D
4.把1.1 g铁、铝混合物溶于200 mL 5 ml·L-1盐酸中,反应后盐酸的浓度变为4.6 ml·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量。(2)该混合物中铝、铁的物质的量。解析 (1)消耗HCl的物质的量:0.2 L×5 ml·L-1-0.2 L×4.6 ml·L-1=0.08 ml。(2)设Al、Fe的物质的量分别为x、y。2Al + 6HCl===2AlCl3+3H2↑ 2 6x 3x
答案 (1)0.08 ml(2)Al:0.02 ml;Fe:0.01 ml
人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料图片ppt课件: 这是一份人教版 (2019)必修 第一册第三章 铁 金属材料第二节 金属材料图片ppt课件,共29页。PPT课件主要包含了自主预习·悟新知,各物质的粒子数,各物质的物质的量,微点拨,合作探究·提素养,守恒法,随堂检测·精评价等内容,欢迎下载使用。
人教版 (2019)必修 第一册第二节 金属材料教学演示ppt课件: 这是一份人教版 (2019)必修 第一册第二节 金属材料教学演示ppt课件,共39页。PPT课件主要包含了自主预习·悟新知,合金和铁合金,铝铝合金,新型合金,合作探究·提素养,随堂检测·精评价等内容,欢迎下载使用。
化学必修 第一册第二节 金属材料课前预习ppt课件: 这是一份化学必修 第一册第二节 金属材料课前预习ppt课件,共55页。PPT课件主要包含了第二节金属材料,研习一铁合金,自读教材,要点归纳,题组训练等内容,欢迎下载使用。













