





高中化学人教版 (2019)必修 第一册第二节 金属材料优秀复习课件ppt
展开铁及其化合物 金属材料
五、Fe、Fe2+和Fe3+的转化
物质的量在化学方程式计算中的应用
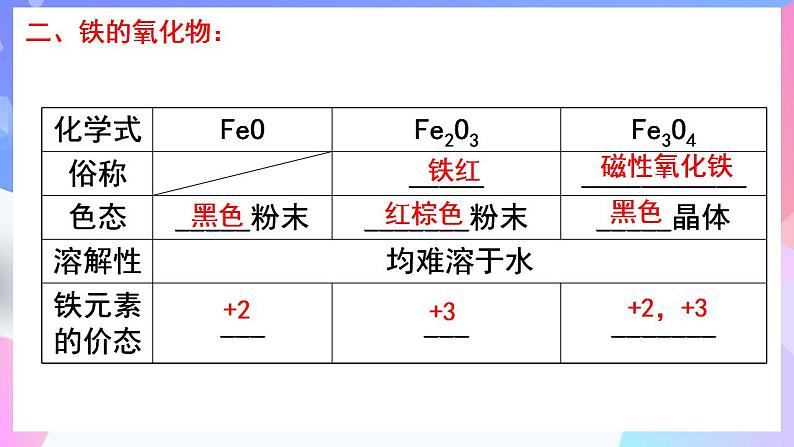
1.铁在地壳中含量仅次于氧、硅和 ,居第 位,主要以 价和 价化合物的形式存在。
3Fe+4H2O ====Fe3O4+4H2
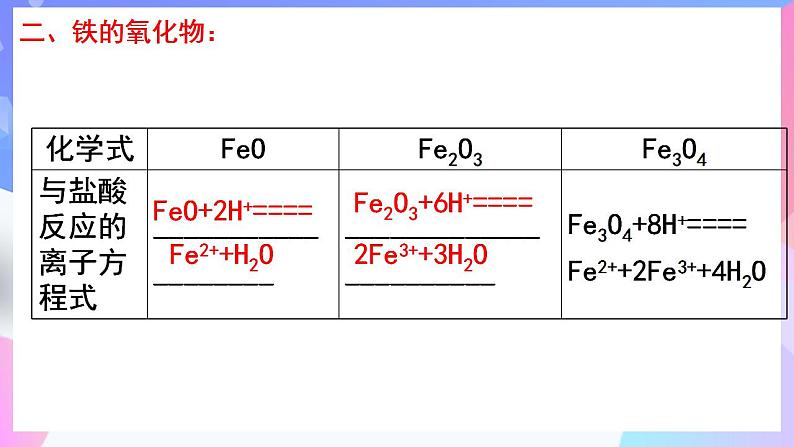
FeO+2H+====
Fe2O3+6H+====
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)2+2H+= Fe2++2H2O
Fe(OH)3+3H+= Fe3++3H2O
Fe3++3OH-=Fe(OH)3↓
Fe2+ 、Fe3+常用的检验方法 (1)Fe3+的检验:
a.观察颜色: Fe3+的溶液呈棕黄色b.加碱液: Fe3+ + 3OH = Fe(OH)3c.加KSCN溶液:Fe3 + 3SCN = Fe(SCN)3
Fe2+ 、Fe3+常用的检验方法 (2)Fe2+的检验:
a.观察颜色: Fe2+的溶液呈浅绿色b.加碱液: Fe2+ + 2OH = Fe(OH)2c.加铁氰化钾溶液:出现蓝色沉淀
2Fe2+ +Cl2=2Fe3+ +2Cl-
5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
Cu+2Fe3+===Cu2++2Fe2+
已知A是一种常见金属,F是一种红褐色沉淀。试根据图中转化关系,回答下列问题。
(1)写出A、C、F、G的化学式A.______ C.________ F.________ G.________。(2)保存C溶液时要加固体A的原因 _________________。(3)写出下列转化的离子方程式或化学方程式。①E―→F:_____________________________________。②C―→D:________________________________________
2Al+2NaOH+2H2O ==2NaAlO2+3H2 ↑
2Al + 6HCl == 2AlCl3 + 3H2 ↑
Al2O3是 氧化物,与 或 溶液都能反应生成盐和水。(1)与强酸反应的离子方程式: 。(2)与强碱反应的离子方程式: 。
Al2O3+6H+===2Al3++3H2O
Al(OH)3是 氢氧化物,与 或 溶液都能反应生成盐和水。(1)与强酸反应的离子方程式: 。(2)与强碱反应的离子方程式: 。
Al(OH)3+3H+===Al3++3H2O
Al(OH)3+OH-===AlO2-+2H2O
2、下列各种物质既能与强酸反应,又能与强碱反应的是 ( )。①Al ②AlCl3 ③Na2CO3 ④Al2O3 ⑤NaHCO3A.①③⑤ B.②③④ C.①③④ D.①④⑤
(含碳量在2%~4.3%之间,还含硅、锰及少量硫、磷 )
(含碳0.3%~0.6%)
(含碳0.03%~0.3%)
(含碳0.6%~2% )
合金钢:在碳素钢中加入铬、锰、钨、镍、钼、钴等合金元素(如不锈钢)
钢:用量最大,用途最广的合金
钢的含碳量越低,韧性越好,硬度越低;含碳量越高,韧性越差,硬度越高。
3、铁和铁合金是生活中常用的材料, 下列说法正确的是( )A.不锈钢是铁合金, 只含金属元素B.一定条件下, 铁粉可与水蒸气反应C.铁与盐酸反应, 铁合金不与盐酸反应D.铁合金的硬度和强度均低于铁
2Na + 2H2O= 2NaOH + H2↑
化学计量数之比:2 : 2 : 2 : 1
扩大NA倍 2×6.02×1023 : 2×6.02×1023 : 2×6.02×1023 : 1×6.02×1023
物质的量之比 2ml : 2ml : 2ml : 1ml
结 论: 化学方程式中各物质的化学计量之比等于各物质的粒子数之比,因而也等于各物质的物质的量之比。
物质的量与其它物理量之间的联系
结论:物质的量是联系各物理量的纽带,可以简便的进行各量之间的转换。
4、把足量的铁粉投入到硫酸和硫酸铜的混合溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为 ( )。 A.1∶4 B.2∶7 C.1∶2 D.3∶8
5、把1.1 g铁、铝混合物溶于200 mL 5 ml·L-1盐酸中,反应后盐酸的浓度变为4.6 ml·L-1(溶液体积变化忽略不计)。求:(1)反应中消耗HCl的物质的量。(2)该混合物中铝、铁的物质的量。
Al 0.02mlFe 0.01ml
铁及其化合物 金属材料
化学必修 第一册第二节 金属材料课前预习ppt课件: 这是一份化学必修 第一册第二节 金属材料课前预习ppt课件,共55页。PPT课件主要包含了第二节金属材料,研习一铁合金,自读教材,要点归纳,题组训练等内容,欢迎下载使用。
人教版 (2019)必修 第一册第一节 铁及其化合物复习ppt课件: 这是一份人教版 (2019)必修 第一册第一节 铁及其化合物复习ppt课件,共21页。PPT课件主要包含了图解激光打印机原理,沉淀法,是否有Fe3+剩余等内容,欢迎下载使用。
第三章 铁 金属材料【复习课件】-2020-2021学年高一化学单元复习一遍过(人教版2019必修第一册): 这是一份第三章 铁 金属材料【复习课件】-2020-2021学年高一化学单元复习一遍过(人教版2019必修第一册),共52页。PPT课件主要包含了考点一铁的单质,考点三金属材料,知识复习,题点呈现,铁的氧化物,铁的氢氧化物,铝和铝合金等内容,欢迎下载使用。













