













所属成套资源:人教版高中化学同步选择性必修第一册课件PPT+讲义+专练(新教材)
- 第三章 第三节 第5课时 溶液中粒子浓度大小比较--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第三章 第三节 第6课时 溶液中粒子浓度图像分析--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第三章 第四节 第2课时 沉淀溶解平衡的应用--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第三章 第四节 第3课时 Ksp的计算--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
- 第三章 第四节 第4课时 难溶电解质沉淀溶解平衡图像分析--人教版高中化学选择性必修第一册同步课件+讲义+专练(新教材) 课件 0 次下载
人教版 (2019)选择性必修1第四节 沉淀溶解平衡获奖课件ppt
展开
这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡获奖课件ppt,文件包含第三章第四节第1课时难溶电解质的沉淀溶解平衡pptx、第三章第四节第1课时难溶电解质的沉淀溶解平衡专练docx、第三章第四节第1课时难溶电解质的沉淀溶解平衡教师版docx、第三章第四节第1课时难溶电解质的沉淀溶解平衡学习笔记docx、溶解平衡swf等5份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
1.了解难溶电解质的沉淀溶解平衡,能通过实验证明难溶电解质沉淀溶解平衡 的存在,进一步发展粒子观、平衡观。2.理解外界因素对难溶电解质沉淀溶解平衡的影响。3.了解溶度积和离子积的关系,学会由此判断反应进行的方向。
核心素养 发展目标
一、难溶电解质的沉淀溶解平衡
难溶电解质的沉淀溶解平衡
1.25 ℃时,溶解性与溶解度的关系
特别提醒 大多数电解质的溶解度随温度升高而增大,但也有例外,如Ca(OH)2,温度越高,溶解度越小。
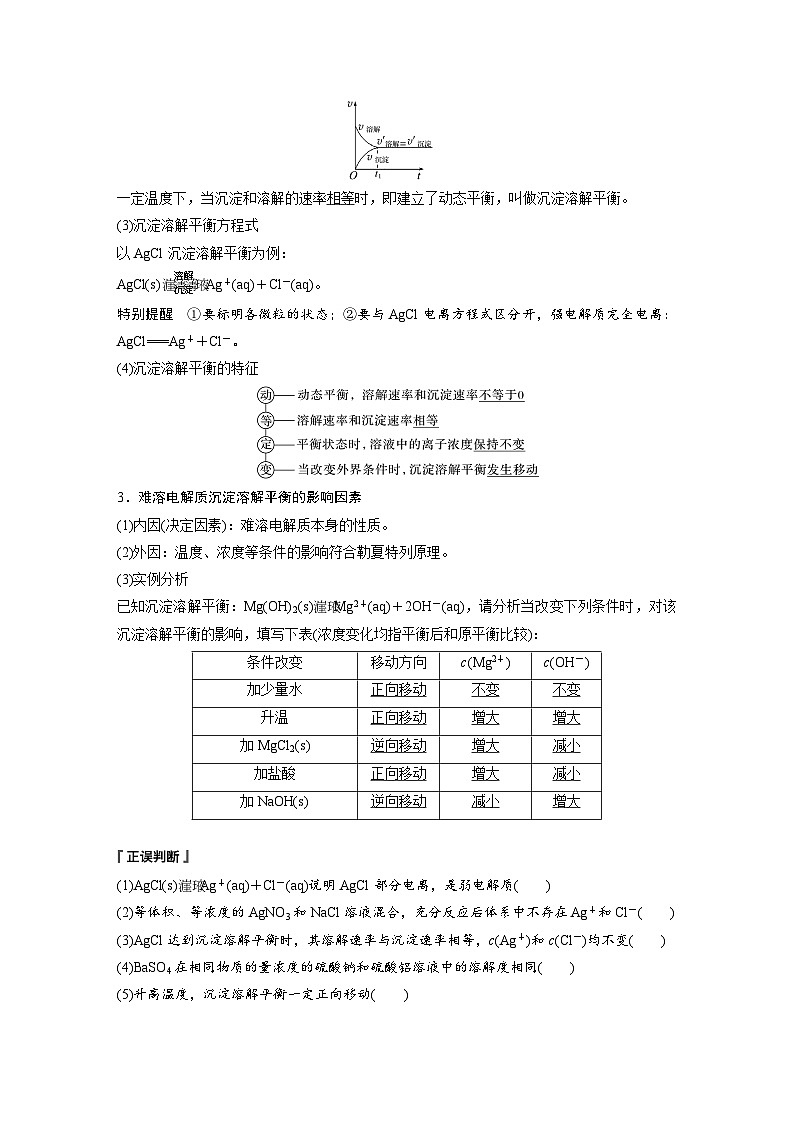
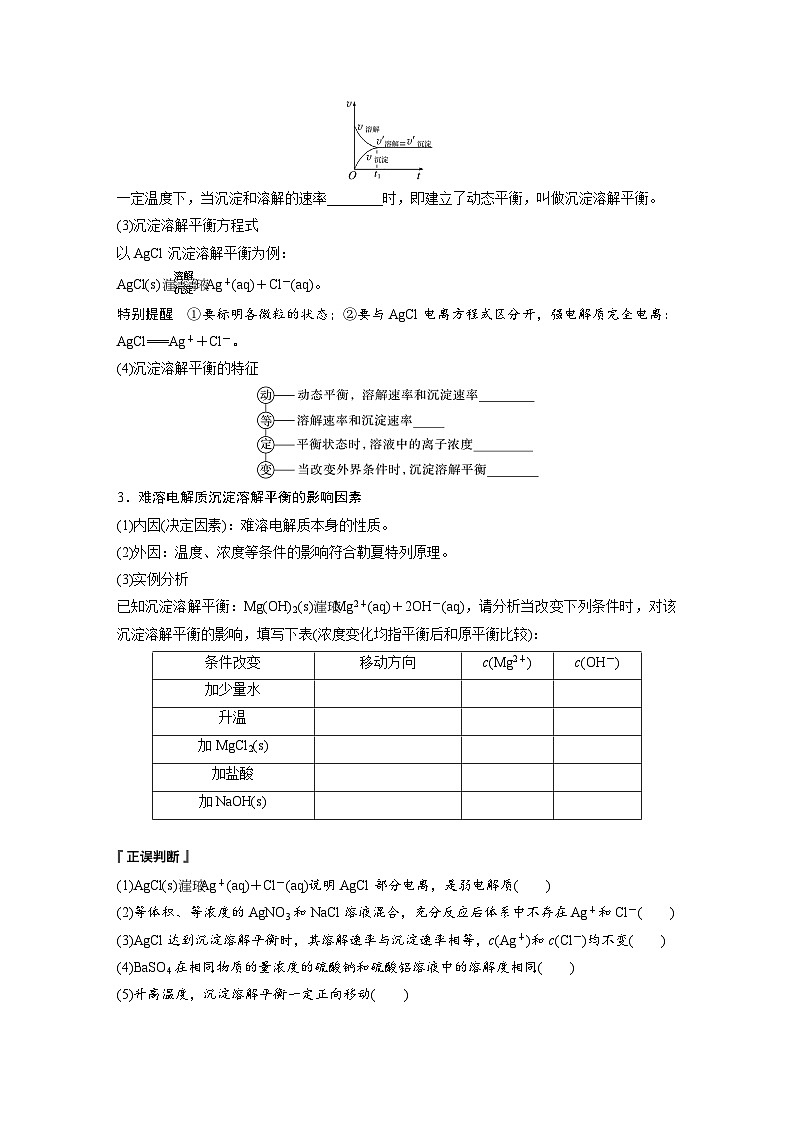
2.沉淀溶解平衡(以AgCl为例分析)(1)沉淀溶解平衡建立AgCl在溶液中存在下述两个过程:一方面,在水分子作用下,少量Ag+和Cl-脱离AgCl的表面进入水中,即 过程;另一方面,溶液中的Ag+和Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出,即 过程。在一定温度下,当沉淀和溶解的速率相等时,达到平衡状态,得到AgCl的 。
(2)沉淀溶解平衡的概念
一定温度下,当沉淀和溶解的速率 时,即建立了动态平衡,叫做沉淀溶解平衡。(3)沉淀溶解平衡方程式以AgCl沉淀溶解平衡为例:
特别提醒 ①要标明各微粒的状态;②要与AgCl电离方程式区分开,强电解质完全电离:AgCl===Ag++Cl-。
(4)沉淀溶解平衡的特征
3.难溶电解质沉淀溶解平衡的影响因素(1)内因(决定因素):难溶电解质本身的性质。(2)外因:温度、浓度等条件的影响符合勒夏特列原理。(3)实例分析已知沉淀溶解平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该沉淀溶解平衡的影响,填写下表(浓度变化均指平衡后和原平衡比较):
(1)AgCl(s) Ag+(aq)+Cl-(aq)说明AgCl部分电离,是弱电解质(2)等体积、等浓度的AgNO3和NaCl溶液混合,充分反应后体系中不存在Ag+和Cl-(3)AgCl达到沉淀溶解平衡时,其溶解速率与沉淀速率相等,c(Ag+)和c(Cl-)均不变(4)BaSO4在相同物质的量浓度的硫酸钠和硫酸铝溶液中的溶解度相同(5)升高温度,沉淀溶解平衡一定正向移动
(6)为减少洗涤过程中固体的损耗,最好选用稀硫酸代替H2O来洗涤BaSO4沉淀(7)向一定量的饱和NaOH溶液中加入少量Na2O固体,恢复到原来温度时,溶液中的Na+总数不变
1.对于:AgCl(s) Ag+(aq)+Cl-(aq) ΔH>0的平衡体系,改变条件:a.加热;b.加水;c.加入AgCl固体;d.加入NaCl晶体。平衡怎样移动?
提示 a.升高温度:平衡正向移动,溶解度增大;b.加水:平衡正向移动;c.加入AgCl固体:平衡不移动;d.加入NaCl晶体:平衡逆向移动。
2.牙齿表面有一层硬的成分为Ca5(PO4)3OH的物质保护,它在唾液中存在下列平衡: 。①饮用纯净水能否保护牙齿?为什么?
难溶电解质的溶解平衡与弱电解质的电离平衡的区别
1.(2022·北京首都师范大学附中高二期中)下列现象中主要用沉淀溶解平衡原理解释的是①热纯碱溶液洗涤油污的能力强 ②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用后,常用0.5%的Na2SO4溶液解毒 ③溶洞的形成 ④碳酸钡不能作“钡餐”而硫酸钡可以 ⑤泡沫灭火器灭火的原理A.①②③ B.②③④C.③④⑤ D.①②③④⑤
2.在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是A.加MgSO4固体 B.加HCl溶液C.加NaOH固体 D.加少量水
1.概念难溶电解质的沉淀溶解平衡也存在 ,称为 ,简称溶度积,符号为 。2.表达式AmBn(s) mAn+(aq)+nBm-(aq)Ksp= 。如:Fe(OH)3(s) Fe3+(aq)+3OH-(aq)Ksp= 。
cm(An+)·cn(Bm-)
c(Fe3+)·c3(OH-)
3.影响因素溶度积Ksp只与 的性质和 有关。特别提醒 一般温度升高,Ksp增大,但Ca(OH)2相反。4.Ksp的意义反映了难溶电解质在水中的溶解能力。特别提醒 ①对于同类型物质(如AgCl、AgBr、AgI等),可直接用溶度积比较难溶电解质的溶解能力,Ksp越大,难溶电解质在水中的溶解能力越强。②对于不同类型的物质,Ksp不能直接作为比较依据,而应通过计算将Ksp转化为饱和溶液中溶质的物质的量浓度确定溶解能力的强弱。
5.应用(1)判断是否达到沉淀溶解平衡,即在一定条件下沉淀能否生成或溶解。离子积(Q):对于AmBn(s) mAn+(aq)+nBm-(aq),任意时刻Q=cm(An+)·cn(Bm-)。①Q>Ksp,溶液过饱和, 沉淀析出,直至溶液饱和,达到新的平衡;②Q=Ksp,溶液饱和,沉淀与溶解处于 ;③Q<Ksp,溶液未饱和, 沉淀析出,若加入过量难溶电解质,难溶电解质溶解直至溶液 。
(2)用于比较生成沉淀的顺序。例如向含有等浓度Br-、Cl-和 的溶液中滴加AgNO3溶液,可利用AgBr、AgCl、Ag2CrO4三种银盐的Ksp计算出产生三种沉淀所需Ag+的浓度,从而确定三种阴离子形成沉淀的顺序。(3)计算使某离子沉淀完全时所需溶液的pH。中学化学中一般认为当离子浓度小于10-5 ml·L-1时即沉淀完全,因此可依据金属氢氧化物的Ksp求出当金属离子沉淀完全时溶液的pH。
(1)溶度积是沉淀溶解平衡时难溶电解质在溶液中的各离子浓度的乘积(2)溶度积受离子浓度大小的影响(3)改变外界条件使沉淀溶解平衡正向移动,Ksp一定增大(4)Ksp小的难溶电解质的溶解度一定小于Ksp大的难溶电解质的溶解度(5)可利用溶液混合后的Q与Ksp的相对大小来判断溶液混合后是否有沉淀生成
已知几种难溶电解质在25 ℃时的溶度积如表。
请思考下列问题:(1)25 ℃时AgCl(s)、AgBr(s)、AgI(s)溶于水形成的饱和溶液中,c(Ag+)大小关系能否直接判断?三种物质的溶解能力由大到小排序如何?
提示 能。溶解能力由大到小:AgCl>AgBr>AgI。
(2)AgCl、Mg(OH)2哪个更难溶?
提示 Ksp(AgCl)=c(Ag+)·c(Cl-)=c2(Ag+)=1.8×10-10,c(Ag+)≈1.34×10-5 ml·L-1,即AgCl的溶解浓度为1.34×10-5 ml·L-1;Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)=4c3(Mg2+)=5.6×10-12,c(Mg2+)≈1.12×10-4 ml·L-1,即Mg(OH)2的溶解浓度为1.12×10-4 ml·L-1,则AgCl更难溶。
1.已知几种难溶电解质的溶度积常数Ksp(25 ℃)见下表:
下列叙述不正确的是A.由溶度积常数可判断在相同条件下一些物质的溶解性大小B.Ksp(Ag2CrO4)<Ksp(AgCl),但AgCl的溶解度小于Ag2CrO4的溶解度C.向等浓度的NaCl和Na2CrO4的混合液中逐滴加入AgNO3溶液,AgCl 先沉淀D.向100 mL 0.1 ml·L-1 Na2SO4溶液中加入1 mL 0.1 ml·L-1 AgNO3溶 液,有白色沉淀生成
2.已知25 ℃时,Ksp[Cu(OH)2]=2×10-20。在pH=5,c(Cu2+)=2 ml·L-1的溶液中能否生成Cu(OH)2沉淀?(写出解答步骤)
题组一 沉淀溶解平衡及其影响因素1.某同学为了验证难溶的氯化银在水中也存在沉淀溶解平衡,设计了如下实验方案。下列说法正确的是A.步骤①中应加入过量的AgNO3溶液B.步骤①中应使NaCl溶液过量C.步骤②中现象是无沉淀产生D.步骤②中选用的AgNO3溶液的浓度 应小于步骤①
2.一定温度下,向含有AgCl(s)的饱和AgCl溶液中加水至固体恰好完全消失,下列叙述正确的是A.AgCl的溶解度增大B.AgCl的溶解度、Ksp均不变C.溶液中c(Cl-)变小D.溶液中n(Cl-)不变
3.25 ℃时,PbCl2固体在不同浓度盐酸中的溶解度如图。在制备PbCl2的实验中,洗涤PbCl2固体最好选用A.蒸馏水 ml·L-1盐酸 ml·L-1盐酸 ml·L-1盐酸
4.25 ℃时,在含有大量PbI2的饱和溶液中存在着平衡:PbI2(s) Pb2+(aq)+2I-(aq),加入KI固体,下列说法正确的是A.溶液中Pb2+和I-浓度都增大B.溶度积常数Ksp增大C.沉淀溶解平衡向右移动D.溶液中Pb2+浓度减小
5.一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是①20 mL 0.01 ml·L-1 KCl溶液 ②30 mL 0.02 ml·L-1 CaCl2溶液 ③40 mL 0.03 ml·L-1 HCl溶液 ④10 mL 蒸馏水 ⑤50 mL 0.05 ml·L-1 AgNO3溶液A.①>②>③>④>⑤B.④>①>③>②>⑤C.⑤>④>②>①>③D.④>③>⑤>②>①
题组二 溶度积及其应用6.下列有关沉淀溶解平衡的说法正确的是A.Ksp(AB2)小于Ksp(CD),说明AB2的溶解度小于CD的溶解度B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大C.可比较离子积Q与溶度积Ksp的相对大小来判断沉淀溶解平衡进行的方向D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡不移动
7.下列有关溶度积常数Ksp的说法正确的是A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小B.溶度积常数Ksp只受温度影响,温度升高Ksp减小C.难溶电解质的溶度积Ksp越小,则它的溶解度越小D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
8.(2022·辽宁辽河高二期中)已知25 ℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp(AgCl)=1.8×10-10,在该温度下,下列判断正确的是A.向0.001 ml·L-1 AgNO3溶液中滴入0.001 ml·L-1 KCl溶液,无沉淀析出B.向饱和AgCl溶液中加入NaCl溶液,Ksp(AgCl)减小C.在Mg(OH)2悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大D.Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小
9.已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 ml·L-1的Na2CO3溶液与CaCl2溶液等体积混合,若要产生沉淀,则所用CaCl2溶液的浓度至少应大于A.2.8×10-2 ml·L-1B.1.4×10-5 ml·L-1C.2.8×10-5 ml·L-1D.5.6×10-5 ml·L-1
10.(2022·大连高二检测)常温下几种难溶电解质的溶度积如表所示:
向含有等物质的量浓度的FeCl2、CuSO4、ZnSO4混合溶液中滴加0.01 ml·L-1Na2S溶液时,Fe2+、Cu2+、Zn2+沉淀的先后顺序为A.Fe2+、Zn2+、Cu2+ B.Cu2+、Zn2+、Fe2+C.Zn2+、Fe2+、Cu2+ D.Cu2+、Fe2+、Zn2+
11.下列说法正确的是A.含有AgCl和AgI固体的悬浊液中c(Ag+)>c(Cl-)=c(I-)B.25 ℃时,Cu(OH)2在水中的溶解度大于在Cu(NO3)2溶液中的溶解度C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大D.25 ℃时,AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
12.(2022·石家庄高二质检)已知20 ℃,Ksp[Mg(OH)2]=1.6×10-11,Ksp[C(OH)2]=6.4×10-15,C(OH)2为玫瑰红色难溶物。某同学进行下列实验,依据下述实验操作及现象,下列说法错误的是
下列说法错误的是A.镁条和水发生置换反应生成H2和Mg(OH)2B.NaCl增大了Mg(OH)2(s)在20 ℃水中的溶解度C.Mg(OH)2(s) Mg2+(aq)+2OH-(aq) ΔH>0D.加入适量CCl2溶液后,c(Mg2+)∶c(C2+)=2 500∶1
13.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是A.加入Na2SO4可以使溶液由a点变到b点B.通过蒸发可以使溶液由d点变到c点C.d点无BaSO4沉淀生成D.a点对应的Ksp大于c点对应的Ksp
14.已知25 ℃时,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgI)=8.5×10-17。(1)25 ℃时,氯化银的饱和溶液中,c(Cl-)=__________________,向其中加入NaCl固体,沉淀溶解平衡______(填“左移”“右移”或“不移动”),溶度积常数______(填“变大”“变小”或“不变”)。
1.3×10-5 ml·L-1
(2)25 ℃时,若向50 mL 0.018 ml·L-1的AgNO3溶液中加入50 mL 0.020 ml·L-1的盐酸,混合后溶液中的c(Ag+)=_________________,pH=____。
1.8×10-7 ml·L-1
(3)25 ℃时,氯化银的饱和溶液和铬酸银的饱和溶液中,Ag+浓度大小顺序为_______________,由此可得出______ 更难溶。
Ag2CrO4>AgCl
(4)将等体积的4×10-3 ml·L-1的AgNO3溶液和4×10-3 ml·L-1的K2CrO4溶液混合_____(填“有”或“没有”)Ag2CrO4沉淀产生。
15.Ⅰ.25 ℃时如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-的物质的量浓度的对数。回答下列问题:(1)向ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为___________________________。
Zn2++4OH-===[Zn(OH)4]2-
根据图像可知,向ZnCl2溶液中加入足量的氢氧化钠溶液生成[Zn(OH)4]2-,反应的离子方程式可表示为Zn2++4OH-===[Zn(OH)4]2-。
(2)从图中数据计算可得Zn(OH)2的溶度积Ksp=_______。
根据图中a点数据可知,c(Zn2+)=10-3 ml·L-1时c(OH-)=10-7 ml·L-1,溶度积Ksp[Zn(OH)2]=c(Zn2+)·c2(OH-)=10-3×(10-7)2=10-17。
(3)某废液中含Zn2+,为提取Zn2+可以控制溶液中pH的范围是_____________。
8.0<pH<12.0
根据图像可知,pH在8~12之间时以Zn(OH)2的形式存在,生成氢氧化锌沉淀可以提取Zn2+。
Ⅱ.25 ℃时,PbCl2浓度随盐酸浓度变化如下表:
(4)根据上表数据判断下列说法正确的是________(填字母)。A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大B.PbCl2固体在0.50 ml·L-1盐酸中的溶解度小于在纯水中的溶解度C.PbCl2固体可溶于饱和食盐水
相关课件
这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡备课课件ppt,共26页。PPT课件主要包含了沉淀溶解平衡,溶度积,温故知新,实验探究,思考与讨论,表达式,课堂小结等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第四节 沉淀溶解平衡背景图ppt课件,共15页。
这是一份高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡优秀课件ppt,文件包含高中化学新教材同步选择性必修第1册第21讲沉淀溶解平衡一难溶电解质的沉淀溶解平衡PPT课件pptx、高中化学新教材同步选择性必修第1册第21讲沉淀溶解平衡一难溶电解质的沉淀溶解平衡教师版docx、高中化学新教材同步选择性必修第1册第21讲沉淀溶解平衡一难溶电解质的沉淀溶解平衡学生版docx等3份课件配套教学资源,其中PPT共25页, 欢迎下载使用。










