


人教版 (2019)选择性必修1第四节 沉淀溶解平衡完整版ppt课件
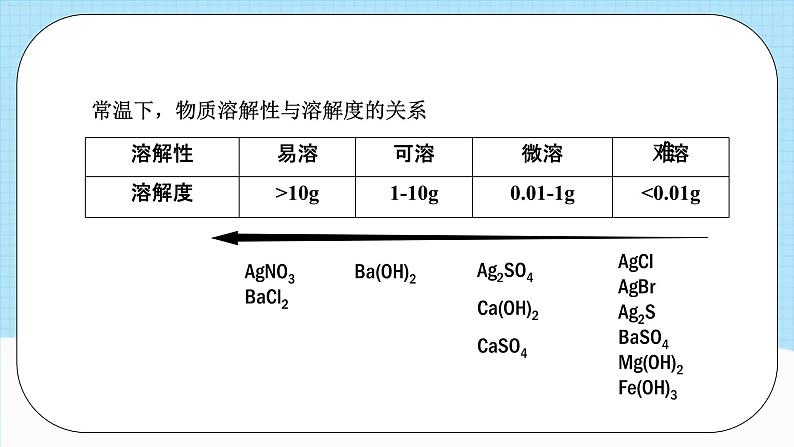
展开常温下,物质溶解性与溶解度的关系
Ag2SO4Ca(OH)2CaSO4
AgClAgBrAg2SBaSO4Mg(OH)2Fe(OH)3
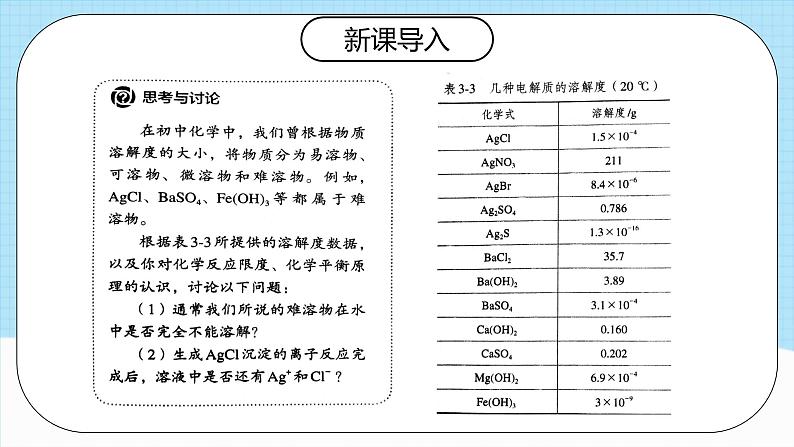
(1)通常所说的难溶物是指在常温下,其溶解度小于0.01g,并不是在水中完全不能溶解。
(2)生成AgCl沉淀的离子反应是指进行到一定限度,并不能完全进行到底,此时溶液中还有Ag+和Cl-。
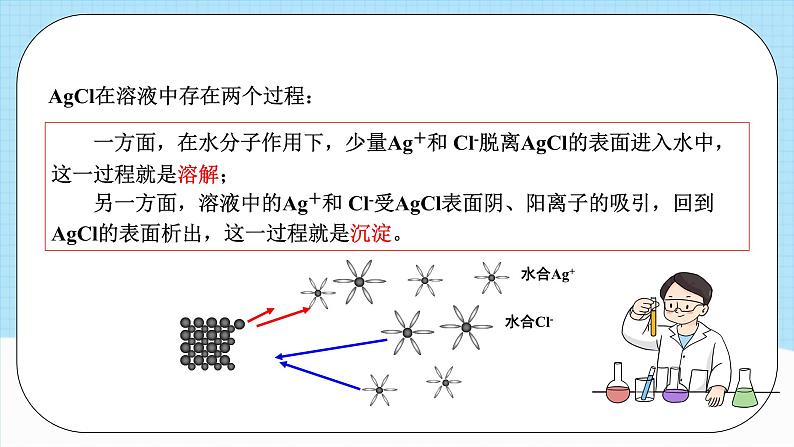
一方面,在水分子作用下,少量Ag+和 Cl-脱离AgCl的表面进入水中,这一过程就是溶解; 另一方面,溶液中的Ag+和 Cl-受AgCl表面阴、阳离子的吸引,回到AgCl的表面析出,这一过程就是沉淀。
AgCl在溶液中存在两个过程:
模块一 难溶电解质的沉淀溶解平衡
一、难溶电解质的沉淀溶解平衡
在一定温度下,当沉淀和溶解的速率相等时,得到AgCl的饱和溶液,即建立下列动态平衡:
0 时间
v(溶解)=v(沉淀)
得到饱和AgCl溶液,建立沉淀溶解平衡
人们把这种平衡称为沉淀溶解平衡。
(1)内因:难溶电解质本身的性质
①浓度:加水,平衡向溶解方向移动
升温,多数平衡向溶解方向移动(原因:溶解吸热);但少数向沉淀方向移动 (例:Ca(OH)2)
加入相同的离子,平衡向沉淀方向移动
加入与体系中某些离子反应的物质,产生气体或更难溶的物质,导致平衡向溶解的方向移动
与电离平衡、水解平衡一样,难溶电解质的沉淀溶解平衡也存在平衡常数,称为溶度积常数,简称溶度积,符号为Ksp。
对于溶解平衡:MmAn(s)
mMn+(aq)+nAm-(aq) 反应,
Ksp=[c(Mn+)]m·[c(Am-)]n
Ksp=c2(Ag+)·c(S2-)
Ksp=c(Ag+)·c(Cl-)
固体纯物质一般不列入平衡常数
Ksp反映了难溶电解质在水中的溶解能力,
例:Ksp(AgCl)=1.8×10-10 Ksp(AgBr)=6.3×10-15 说明S(AgCl)> S(AgBr)
对于同类型(阴、阳离子个数相同)的难溶电解质
在相同温度下,Ksp越大→S(溶解度)越大
Ksp与难溶电解质的性质和温度有关
升温,多数平衡向溶解方向移动, Ksp 增大。
特例:Ca(OH)2升温 Ksp 减小。
判断有无沉淀——溶度积规则
Q(离子积)= [c(Mn+)]m·[c(Am-)]n
Q>Ksp时,溶液中有沉淀析出
Q=Ksp时,沉淀与溶解处于平衡状态
Q
纵、横坐标通常是难溶物溶解后电离出的离子浓度。
①以氯化银为例,在该沉淀溶解平衡图像上,曲线上任意一点都达到了沉淀溶解平衡状态,此时Qc=Ksp。在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。
②曲线上方区域的点均为过饱和溶液,此时Qc>Ksp。③曲线下方区域的点均为不饱和溶液,此时Qc
①溶液在蒸发时,离子浓度的变化分两种情况:
A.原溶液不饱和时,离子浓度都增大;B.原溶液饱和时,离子浓度都不变。
①沉淀溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和溶液,此时有沉淀析出,曲线下方的任一点均表示不饱和溶液。
②从图像中找到数据,根据Ksp公式计算得出Ksp的值。
③比较溶液的Qc与Ksp的大小,判断溶液中有无沉淀析出。
④涉及Qc的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积。
A.图中a点对应的是T2温度下HgS的不饱和溶液B.图中p、q点对应的Ksp的关系为Ksp(p)
A.M表示Y2X的溶解平衡曲线B.常温下,Y2X的分散系在c点时为悬浊液C.向b点溶液中加入Na2X饱和溶液,析出ZX固体D.ZX(s)+2Y+(aq) ⇌Y2X(s)+Z2+(aq)的平衡常数K=1014
[解析]由Ksp(Y2X)=c2(Y+)·c(X2-),可得p(X2-)=-2p(Y+)-lg Ksp(Y2X),由Ksp(ZX)=c(Z2+)·c(X2-),可得p(X2-)=-p(Z2+)-lg Ksp(ZX),横坐标表示阳离子浓度的负对数,纵坐标表示阴离子浓度的负对数,根据两物质的阴阳离子个数比推知,M表示Y2X的溶解平衡曲线,N表示ZX的溶解平衡曲线,A正确;c点在M斜线上方,在金属阳离子浓度不变时,纵坐标越大,表示相应的阴离子浓度越小,因此c点Q=c2(Y+)·c(X2-)
c(Cl-)=(0.01×0.1) ÷0.101=9.9×10-3ml/L
c(Ag+)=(0.01×0.001) ÷0.101=9.9×10-5ml/L
QC =9.9×10-3×9.9×10-5=9.8×10-7>KSP
2. 在1L含1.0×10-3mlL-1 的SO42-溶液中,注入0.01ml BaCl2溶液(假设溶液体积不变)能否有效除去SO42- ?已知:Ksp(BaSO4)= 1.1×10-10
解:c(Ba2+)=0.01ml/L,c(SO42-)=0.001ml/L,生成BaSO4沉淀后,Ba2+过量,剩余的 c(Ba2+)=0.01-0.001=0.009ml/L.c(SO42-)=Ksp/c(Ba2+)= 1.1×10-10/9.0×10-3=1.2×10-8(ml/L)因为,剩余的c(SO42-)=1.2×10-8ml/L<1.0×10-5ml/L。所以, SO42-已沉淀完全,即有效除去了SO42-。
注意:当剩余离子即平衡离子浓度﹤10-5ml/L时,认为离子已沉淀完全或离子已有效除去。
3.若某溶液中Fe3+和Mg2+的浓度均为0.10 ml/L, 使Fe3+完全沉淀而使Mg2+不沉淀的pH条件是什么?已知:Ksp [Fe(OH)3]= 4×10-39 Ksp [Mg(OH)2]= 1.8×10-11
pH = -lg c(H+) = 3.2
Mg2+开始沉淀的pH值为:
pH = -lg c(H+) = 9.1
因此, 只要控制pH值在3.2 ~ 9.1之间即可使Fe3+定量沉淀而使Mg2+不沉淀。
Ksp (Mg(OH)2)= 1.8×10-11
高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡一等奖ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1<a href="/hx/tb_c4009323_t3/?tag_id=26" target="_blank">第四单元 沉淀溶解平衡一等奖ppt课件</a>,文件包含341沉淀溶解平衡与溶度积同步课件pptx、溶洞形成mp4等2份课件配套教学资源,其中PPT共43页, 欢迎下载使用。
高中化学第四节 羧酸 羧酸衍生物优秀ppt课件: 这是一份高中化学<a href="/hx/tb_c4002471_t3/?tag_id=26" target="_blank">第四节 羧酸 羧酸衍生物优秀ppt课件</a>,共47页。PPT课件主要包含了草酸乙二酸,柠檬酸,乙酸醋酸,甲酸蚁酸,课前导入,羧酸的结构,官能团,或COOH,羧酸的命名,-甲基丁酸等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡精品课件ppt: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002429_t3/?tag_id=26" target="_blank">第三章 水溶液中的离子反应与平衡第四节 沉淀溶解平衡精品课件ppt</a>,共27页。PPT课件主要包含了学习目标,模块三沉淀的转化,课前导入,模块一沉淀的生成,沉淀的生成,沉淀的溶解,沉淀的转化,有白色沉淀析出,白色沉淀转化为黄色,黄色沉淀转化为黑色等内容,欢迎下载使用。













