人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液教学设计
展开
这是一份人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液教学设计,共8页。教案主要包含了新课讲解,思考讨论,思维启迪,课堂达标等内容,欢迎下载使用。
课题
配制一定物质的量浓度的溶液
单元
2
学科
化学
年级
必修一
教材
分析
本节教学内容是人教版高中化学必修第一册第二章《海水中的重要元素——钠和氯》实验活动1《配置一定物质的量浓度的溶液》。该部分的教学内容涉及到了钠的物理和化学性质,钠的化合物的性质,氯的物理和化学性质,氯的化合物的性质,容量瓶相关概念以及容量瓶的使用方法,溶液的配制方法,稀释浓溶液的方法和步骤。从物质分类的角度系统研究钠及其化合物、氯及其化合物,可以定性认识物质的性质、变化和用途。通过学习一个新的物理量,建立宏观物质与微观粒子间的联系,可以帮助我们从定量的角度认识物质及其变化。本节安排了“容量瓶相关概念以及容量瓶的使用方法”、“溶液的配制方法”和“稀释浓溶液的方法和步骤”这三部分内容,是第二章中实验部分的知识点,引入了许多实验器材的相关概念和知识点。通过学习这部分知识,学生将学习容量瓶相关概念以及容量瓶的使用方法;掌握溶液的配制方法;学习和掌握稀释浓溶液的方法和步骤。
教学目标与核心素养
宏观辨识与微观探析:从宏观上观察化学物质的质量、体积、状态,从微观上学习化学物质的物理量物质的量,体会宏观物质与微观粒子间的联系。
证据推理与模型认知:通过化学仪器分类的基本方法,理解容量瓶、烧杯等化学仪器的区别,通过结合理论与实际感知化学学习的魅力,为后续的化学知识的学习奠定坚实的方法基础。
科学探究与创新意识:熟悉掌握多种化学仪器的使用方法,熟练掌握通过实验分析不同化合物的性质和用途的能力,体会化学研究过程中的科学方法。
科学精神与社会责任:通过对配置一定物质的量浓度的实验探究和学习,掌握更高效的学习方法,建立高效学习的科学精神。
重点
难点
学习容量瓶相关概念以及容量瓶的使用方法;掌握溶液的配制方法;学习和掌握稀释浓溶液的方法和步骤。
教学过程
教学环节
教师活动
学生活动
设计意图
导入新课
教师:实在实验室中,我们通常用托盘天平称量固体物质,用量筒称量液体物质。
教师:实验室中,可以直接用称量好的固体或液体试剂来配制一定物质的量浓度的溶液。但如果要求比较精确,就需要使用容积精确的仪器,如容量瓶。容量瓶是什么?容量瓶长什么样?
教师:引出本节课学习内容
跟随老师的思路思考。
通过提问,引出今天学习的新内容。
图文并茂,能够较快地让学生进入本节课堂学习。
通过思考,打开同学们的思路。
讲授新课
教师利用多媒体设备向学生投影出下面
【新课讲解】容量瓶
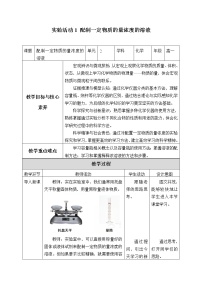
教师:容量瓶是细颈、梨形的平底玻璃瓶,瓶口配有磨口玻璃塞或塑料塞。由瓶体和瓶塞两个部分组成。容量瓶上标有容量的规格(常用的有50mL、100mL、250mL、500mL和1000mL等几种)、温度(一般标记温度为20℃),容量瓶瓶颈有一根刻度线。(展示图片)
【思考讨论】容量瓶的使用
教师:容器瓶常用于配制一定体积、一定浓度的溶液。当液体的凹液面与容量瓶颈部的刻度线相切时,表示在所指温度下,溶液体积恰好与瓶上标注的容积相等。
【新课讲解】使用容量瓶的注意事项
教师:(1)容量瓶瓶塞需用结实的细绳系在瓶颈上,以防止损坏或丢失。
(2)在使用前,首先要检查容量瓶是否完好,瓶口处是否漏水。经检查不漏水的容量瓶才能使用。
(3)容量瓶使用完毕,应洗净、晾干。(玻璃磨口瓶塞应在瓶塞与瓶口处垫一张纸条,以免瓶塞与瓶口粘连。)
【思考讨论】配制100mL1.00ml/L NaCl溶液。
(1)计算需要NaCl固体的质量:________g。
答案:利用物质的量浓度的定义,根据nB = cB·V计算出所需要的NaCl物质的量:0.1L×1ml/L=0.1ml;然后通过质量与物质的量的关系,根据m = n·M,求得NaCl的质量:0.1ml×58.5g/ml=5.85g。
(2)根据计算结果称量NaCl固体。
(3)将称好的NaCl固体放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使NaCl固体全部溶解。
(4)将烧杯中的溶液沿玻璃棒注入100mL容量瓶,并用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,将洗涤液也都注入容量瓶。轻轻摇动容量瓶,使溶液混合均匀。
(5)将蒸馏水注入容量瓶,当液面离容量瓶颈部的刻度线1~2cm时,改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
(6)将配置好的溶液倒入试剂瓶中,并贴好标签。
【思考讨论】① 为什么要用蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将洗涤液也都注入容量瓶?
解答:有些溶质会附着在烧杯和玻璃棒上,而溶质是定量量取的,所以要把洗涤液倒入容量瓶,以免使所制取的溶液浓度偏小。
【思考讨论】② 如果烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
解答:配制一定物质的量浓度的溶液,如果将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,则进入溶液的溶质质量m会减小,最后配成的溶液中溶质的实际浓度会偏小。
【思考讨论】③ 如果在读数时,俯视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的的大了还是小了?
解答:俯视时刻度线时,读数偏高,液体的实际体积<读数,配成的溶液中溶质的实际浓度>要求的浓度。
【思考讨论】④ 如果在读数时,仰视容量瓶上的刻度线,最后配成的溶液中溶质的实际浓度比所要求的大了还是小了?
解答:仰视时刻度线时,读数偏低,液体的实际体积 >读数,配成的溶液中溶质的实际浓度<要求的浓度。
【思维启迪】用固体试剂配制溶液的基本步骤
【新课讲解】稀释浓溶液
教师:实验室中不仅用固体物质配制溶液,还经常要将浓溶液稀释成不同浓度的稀溶液。用浓溶液配制稀溶液时,常用下面的式子计算有关的量。
在稀释浓溶液时,溶液的体积虽然发生了变化,但溶液中物质的量不变。即在溶液稀释前后,溶液中溶质的物质的量相等。
【课堂达标】
1.容量瓶由______和______两部分组成。容量瓶上标有容量的_____、____,容量瓶瓶颈有____条刻度线。
特别注意:①容量瓶不能用作物质___________的容器,也不能用作_________的
容器,热溶液需______后才能_______容量瓶中;
②选择容量瓶时,要使容量瓶的_____________________相对应。
③容量瓶在使用前要______,并检查瓶塞盖在瓶口上时是否______。
解析:由瓶体和瓶塞两个部分组成。容量瓶上标有容量的规格(常用的有50mL、100mL、250mL、500mL和1000mL等几种)、温度(一般标记温度为20℃),容量瓶瓶颈有一条刻度线。
①容量瓶不能用作物质反应或溶解的容器,也不能用作储存溶液的容器,热溶液需冷却后才能转移到容量瓶中;
②选择容量瓶时,要使容量瓶的规格与所配溶液的体积相对应。
③容量瓶在使用前要洗净,并检查瓶塞盖在瓶口上时是否漏液。
2. 下列对容量瓶的使用方法中正确的是( )
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中到刻度线齐平处
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
解析:选项A中,容量瓶使用前应检查它是否漏水,A正确;选项B中,容量瓶用蒸馏水洗净后,不能用待配溶液润洗,会使配制的溶液浓度偏大,B错误;选项C中,定容时,将蒸馏水小心倒入容量瓶中到距离刻度线1-2cm处,再改用胶头滴管逐滴加入至凹液面最低处与视线相平为止,C错误;选项D中,如果试样是液体,用哪个量筒量取试样后倒入烧杯中加水稀释,再转移到容量瓶中定容,D错误。故应选A。
3.实验室中需要配制2ml/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
A.950mL,111.2g
B.500mL,117g
C.1000mL,117g
D.任意规格,111.2g
解析:配制溶液时,只能配制容量瓶上规定体积的溶液,不能配制任意体积的一定物质的量浓度的溶液。计算时也要按配制的体积来计算所需溶质。与950mL最接近容量瓶的体积是1000mL,因此配制2ml/L的NaCl溶液1000mL需氯化钠的质量为:2ml/L×1L×58.5g/ml=117.0g。故应选C。
4. 在10mL2.4ml·L-1的NaOH溶液中加入50mL水,下列说法正确的是( )
A.稀释后溶液的浓度是0.4ml·L-1
B.稀释后溶液的体积是60L
C.稀释后溶液的浓度为0.33ml·L-1
D.以上答案均不正确
解析:分子中间有空隙,所以混合后的液体体积小于10ml+50ml=60ml,故选项A和B都错误;实际的溶液浓度应该略大于0.4ml/L,所以C错误。故应选D。
做好笔记,和老师一起学习概念。
老师和同学一起讨论,思考问题。
做好笔记,和老师一起学习概念。
老师和同学一起观察、讨论实验内容和过程。
同学们在老师的引导下,讨论。
同学们在老师的引导下,讨论。
记录笔记,在书中相应部位进行誊写,养成良好的学习习惯。
学生自行思考,完成课堂练习。
通过图文并茂的讲解,使同学们对知识点更加清晰。
通过讨论,帮助同学对知识点的掌握。
加深对知识点的映象,方便课后回顾。
通过讨论,帮助同学对知识点的掌握。
通过讨论,帮助同学对知识点的掌握。
通过讨论,帮助同学对知识点的掌握。
帮助同学们掌握知识点,并加深对知识点的印象。
通过对习题的解答,加深对知识点的巩固。
课堂小结
容量瓶:由瓶体和瓶塞两个部分组成。容量瓶上标有容量的规格(常用的有50mL、100mL、250mL、500mL和1000mL等几种)、温度(一般标记温度为20℃),容量瓶瓶颈有一根刻度线。
容量瓶的使用:① 瓶塞用结实的细绳系在瓶颈上,以防止损坏或丢失。
② 使用前检查容量瓶是否完好,瓶口处是否漏水。
③ 使用完毕,应洗净、晾干。
稀释浓溶液: c(浓溶液)·V(浓溶液) = c(稀溶液)·V(稀溶液)
学生和老师一起快速回顾本次课的学习内容。
通过对课堂学习知识的总结,帮助同学们加深印象。
板书
学生在笔记本上对板书进行誊写。
方便学生课后回顾。
相关教案
这是一份高中化学人教版 (2019)必修 第一册第二章 海水中的重要元素——钠和氯第三节 物质的量精品教学设计,共17页。教案主要包含了课后巩固等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第一册实验活动1 配制一定物质的量浓度的溶液教学设计,共8页。
这是一份高中实验活动1 配制一定物质的量浓度的溶液教学设计,共8页。