







所属成套资源:【开学摸底考试】2024-2025学年初中化学九年级下学期开学摸底考试卷(多版本 多地区)
- 九年级化学开学摸底考(徐州专用,沪教版2024第1~7章)-2024-2025学年初中下学期开学摸底考试卷.zip 试卷 0 次下载
- 九年级化学开学摸底考(成都专用,人教版2024第1~8单元)-2024-2025学年初中下学期开学摸底试卷.zip 试卷 0 次下载
- 九年级化学开学摸底考(武汉专用,人教版2024第1~8单元)-2024-2025学年初中下学期开学摸底考试卷.zip 试卷 0 次下载
- 九年级化学开学摸底考(沪教版2024,第1~7章)-2024-2025学年初中下学期开学摸底考试卷.zip 试卷 0 次下载
- 九年级化学开学摸底考(济南专用,鲁教版2024第1~11单元)-2024-2025学年初中下学期开学摸底考试卷.zip 试卷 0 次下载
九年级化学开学摸底考(无锡专用,人教版2024第1~8单元)-2024-2025学年初中下学期开学摸底考试卷.zip
展开
这是一份九年级化学开学摸底考(无锡专用,人教版2024第1~8单元)-2024-2025学年初中下学期开学摸底考试卷.zip,文件包含九年级化学开学摸底考全解全析docx、九年级化学开学摸底考考试版测试范围第18单元人教版2024A4版docx、九年级化学开学摸底考考试版测试范围第18单元人教版2024A3版docx、九年级化学开学摸底考参考答案docx、九年级化学开学摸底考答题卡A4版docx、九年级化学开学摸底考答题卡A4版pdf等6份试卷配套教学资源,其中试卷共41页, 欢迎下载使用。
一、选择题(本题共 20 小题,每小题只有一个选项符合题意。1~10 题每小题 1 分,11~20 题每小题 2 分,
共 30 分)
1.化学科学的发展促进了人类社会的进步,化学已日益渗透到社会生活的各个方面。下列对化学学科的认
识错误的是
A.化学的发展必然导致生态环境的恶化
B.合成药物的研发和使用,保障了人们的身体健康
C.新材料的研制和应用,提高了人们的生活品质
D.化肥的合理使用提高了农作物产量,缓解了人类粮食危机
【答案】A
【解析】A、化学的发展有利于人类对环境的保护,生态环境恶化是人为破坏造成的,所以错误;
B、利用化学可合成药物,以抑制细菌和病毒,能保障人体健康,所以正确;
C、利用化学可开发新能源和新材料,能改善人类的生活品质,所以正确;
D、利用化学可生产化肥和农药,以增加粮食产量,缓解了人类粮食危机,所以正确。
故选 A。
2.金秋十月,无锡鼋头渚景区举行了国庆水上音乐烟花大会,下列景象伴随化学变化的是
A.霓虹闪烁,流光溢彩
B.湖山音乐,余音绕梁
C.烟花绚烂,如诗如画
D.花瓣飘落,漫天飞舞
【答案】C
【解析】A 、霓虹灯发光是电能转化为光能,没有新物质生成,属于物理变化,不符合题意;
B 、声音传播过程中,没有新物质生成,是物理变化,不符合题意;
C、烟花燃烧爆炸过程中有新物质生成,属于化学变化,符合题意;
D、花瓣飘落只是位置的改变,没有新物质生成,属于物理变化,不符合题意。
故选 C。
3.化学是一门以实验为基础的科学,认识并了解与实验相关的图标对安全进行实验具有重要意义。以下是
与实验相关的图标,对于硫在空气和氧气中燃烧的实验,无须标注的图标是
1 / 19
A.①
B.③
C.④
D.⑤
【答案】D
【解析】硫燃烧生成二氧化硫,燃烧有明火且放热,需要当心明火、热烫;二氧化硫有毒,会污染空气,
则需要排风;做实验时要戴护目镜,且实验后要洗手;故应注意的是①②③④⑥;实验过程无锐器,不
需标注。
故选 D。
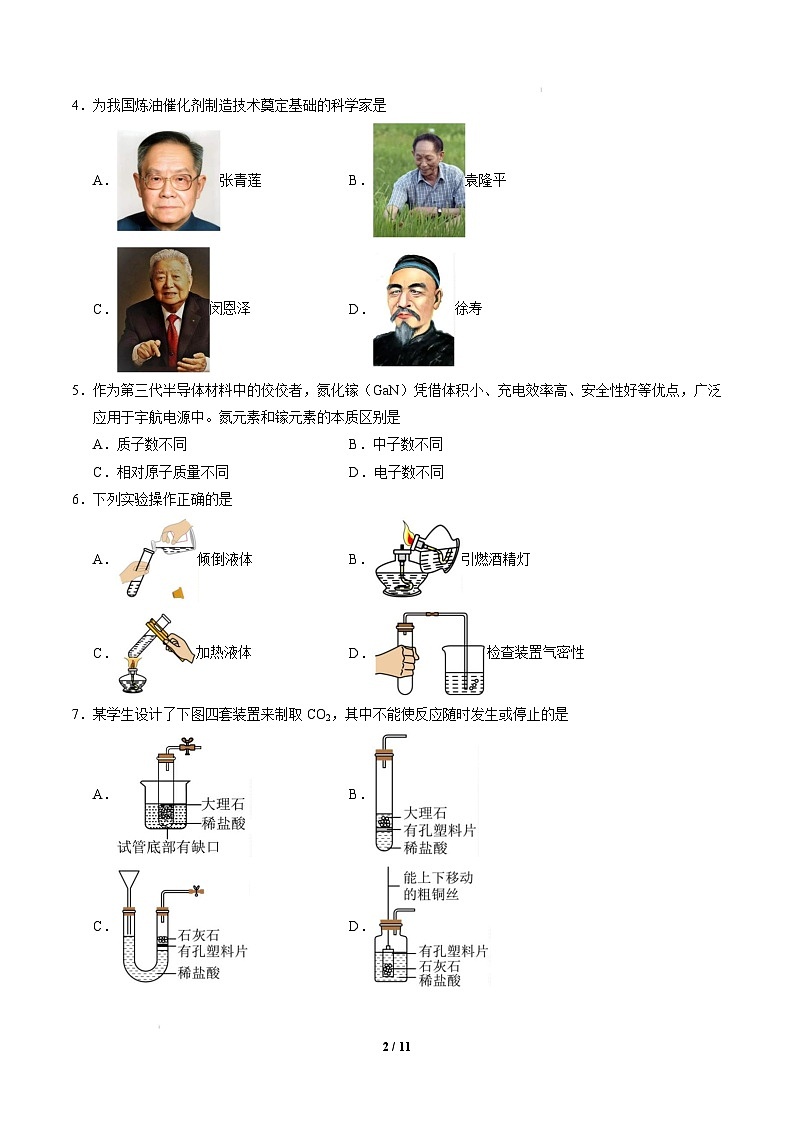
4.为我国炼油催化剂制造技术奠定基础的科学家是
A.
张青莲
B.
袁隆平
C.
闵恩泽
D.
徐寿
【答案】C
【解析】A、张青莲测定了铟、铱、铕等原子的相对原子质量的新值,为相对原子质量的测定做出了卓
越贡献,故选项错误。
B、袁隆平是中国杂交水稻育种专家,中国研究与发展杂交水稻的开创者,为我国杂交水稻高产稳产做
出了突出贡献,被誉为“世界杂交水稻之父”,故选项错误。
C、闵恩泽是中国炼油催化应用科学的奠基者,研发了多种用于石油化工生产的催化剂,故选项正确。
D、徐寿是我国近代化学的启蒙者,译有《化学鉴原》、《化学考质》等书,故选项错误。
故选:C。
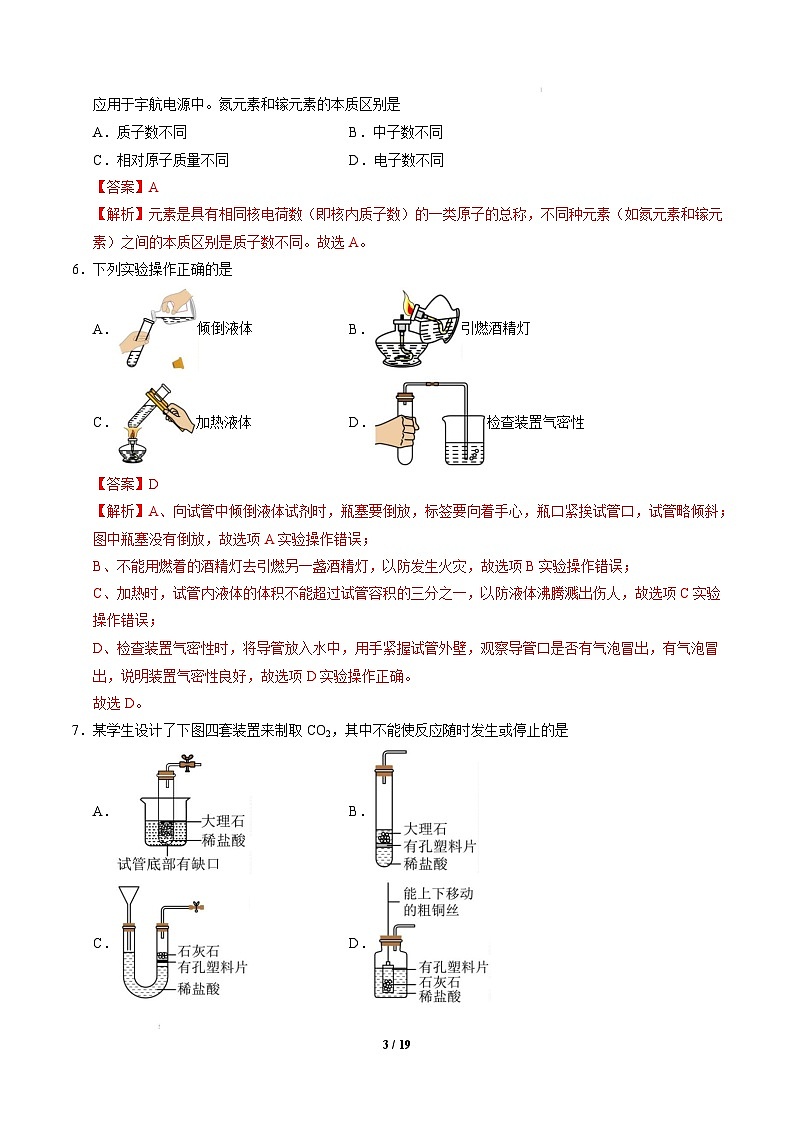
5.作为第三代半导体材料中的佼佼者,氮化镓(GaN)凭借体积小、充电效率高、安全性好等优点,广泛
2 / 19
应用于宇航电源中。氮元素和镓元素的本质区别是
A.质子数不同
C.相对原子质量不同
【答案】A
B.中子数不同
D.电子数不同
【解析】元素是具有相同核电荷数(即核内质子数)的一类原子的总称,不同种元素(如氮元素和镓元
素)之间的本质区别是质子数不同。故选 A。
6.下列实验操作正确的是
A.
倾倒液体
加热液体
B.
D.
引燃酒精灯
C.
检查装置气密性
【答案】D
【解析】A、向试管中倾倒液体试剂时,瓶塞要倒放,标签要向着手心,瓶口紧挨试管口,试管略倾斜;
图中瓶塞没有倒放,故选项 A 实验操作错误;
B、不能用燃着的酒精灯去引燃另一盏酒精灯,以防发生火灾,故选项 B 实验操作错误;
C、加热时,试管内液体的体积不能超过试管容积的三分之一,以防液体沸腾溅出伤人,故选项 C 实验
操作错误;
D、检查装置气密性时,将导管放入水中,用手紧握试管外壁,观察导管口是否有气泡冒出,有气泡冒
出,说明装置气密性良好,故选项 D 实验操作正确。
故选 D。
7.某学生设计了下图四套装置来制取 CO2,其中不能使反应随时发生或停止的是
A.
B.
C.
D.
3 / 19
【答案】B
【解析】A、试管底部有缺口,只要放入烧杯中,稀盐酸就可以随时进入试管产生气体,不用时可以随
时移出试管,所以可以控制反应随时发生或停止。A 不符合题意;
B、虽然有带孔的塑料片,但是稀盐酸总是浸没大理石,所以不能使反应随时发生或停止。B 符合题意;
C、石灰石在有孔塑料片上,用气体时,打开开关,装置的右边压强减小,稀盐酸就会浸没石灰石产生
气体,不用时关闭开关,压强增大盐酸又被压到塑料片以下,控制了反应随时发生或停止。C 不符合题
意;
D、原理同 A,可以上下移动铜丝,就移动了有孔的塑料瓶,因此可以控制反应随时发生或停止。D 不
符合题意。
综上所述:选择 B。
8.南京理工大学胡炳成团队用新方法制得了 NaN ·3H O。该化合物中含有 N -等微粒,已知 N 在元素周期
5
2
5
表中为 7 号元素,则下列有关 的说法正确的是
A. 是一种单质
B.1 个 共含有 35 个质子
D.1 个 共含有 35 个电子
C. 是由 5 个氮原子构成的分子
【答案】B
【解析】氮原子的质子数和电子数均为 7, 的质子数和电子数均为 7×5=35;
子得到的微粒,所以每个 中含有 35 个质子和 36 个电子。
中是 得到一个电
A、
是一种离子,带一个单位的负电荷,故错误;
中含有 35 个质子,故正确;
B、1 个
C、
是带 1 个单位的负电荷的阴离子,不是分子,故错误;
D、1 个
共含有 7×5+1=36 个电子,故错误。
故选:B。
9.下列化学用语表示正确的是
A.Fe—1 个氟原子
C.3H2—3 个氢分子
【答案】C
B.2Mg+2 —2 个镁离子
D.Al — 氯元素
【解析】A、Fe 为铁元素的化学符号,所以 1 个铁原子可表示为 Fe,故 A 错误;
B、离子的表示方法:在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正
负符号在后,带 1 个电荷时,1 要省略,若表示多个该离子,就在其元素符号前加上相应的数字,则 2
个镁离子表示为 2Mg2+,故 B 错误;
C、分子的表示方法:正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,3
个氢分子表示为 3H2,故 C 正确;
D、Al 为铝元素的符号,氯元素的符号为 Cl,故 D 错误。
4 / 19
故选 C。
10.学会观察实验现象是做好实验的基础,下列对实验现象的描述中,正确的是
A.蜡烛在空气中燃烧,生成了二氧化碳和水
B.硫在氧气中燃烧产生微弱的淡蓝色火焰
C.铁丝在氧气中剧烈燃烧、火星四射,产生黑色固体
D.红磷在空气中燃烧产生大量白色烟雾
【答案】C
【解析】A、蜡烛在空气中燃烧,生成了二氧化碳和水,属于实验结论,故选项错误;
B、硫在空气中燃烧产生微弱的淡蓝色火焰,在氧气中燃烧产生明亮的蓝紫色火焰,故选项错误;
C、铁丝在氧气中剧烈燃烧,火星四射,产生黑色固体,故选项正确;
D、红磷在空气中燃烧产生大量白烟,不是白色烟雾,故选项错误;
故选:C。
11.我国化学家徐光宪在稀土分离技术上做出了杰出贡献,稀土中钬元素在元素周期表中的信息如图,下
列说法正确的是
A.钬的相对原子质量为 164.9g
C.钬的元素符号为 HO
【答案】B
B.钬原子中核内质子数为 67
D.钬元素是非金属元素
【解析】A、根据元素周期表中的一格可知,汉字下面的数字表示相对原子质量,该元素的相对原子质
量为 164.9,相对原子质量单位是“1”,不是“g”,故选项说法错误。
B、根据元素周期表中的一格可知,左上角的数字表示原子序数,该元素的原子序数 67;根据原子中
原子序数=核电荷数=质子数=核外电子数,则钬原子中的质子数 67,故选项说法正确。
C、根据元素周期表中的一格可知,字母表示该元素的元素符号,钬的元素符号为 H,故选项说法错
误。
D、钬带“全”字旁,属于金属元素,故选项说法错误。
故选:B。
12.当水的温度和压强升高到临界点(T=374.3℃,P=22.05MPa)以上时,水就处于超临界状态,该状态的水
即称之为超临界水。超临界水具有通常状态下水所没有的特殊性质,它可以和空气、氧气及一些有机
物均匀混合。如果超临界水中同时溶有氧气和有机物,则有机物可迅速被氧化为二氧化碳、氮气、水
等小分子化合物。有关超临界水的叙述不正确的是
A.超临界水可处理有机废物
B.超临界水氧化技术不形成二次污染
5 / 19
C.超临界水是一种纯净物
【答案】D
D.水转化为超临界水属于化学变化
【解析】A. 如果超临界水中同时溶有氧气和有机物,则有机物可迅速被氧化为二氧化碳、氮气、水等
小分子化合物,所以超临界水可处理有机废物,此选项正确;
B. 超临界水可以将有机物迅速被氧化为二氧化碳、氮气、水等小分子化合物,所以超临界水氧化技术
不形成二次污染,此选项正确;
C. 超临界水是由一种物质组成的,所以属于纯净物,此选项正确;
D. 超临界水仍然是水,是水的一种特殊状态,没有新物质生成,属于物理变化,此选项错误;
故选 D。
13.研究和学习化学有许多方法,下列方法中所举示例正确的是
选项
A
方法
示例
分类法 根据所含物质种类,可将物质分为纯净物和混合物
观察法 物质变化中观察到有发光、放热现象即可说明发生了化学变化
类比法 试管可以直接加热,推测烧杯也可以直接加热
B
C
D
归纳法 水和二氧化碳都是由分子构成的,因此物质都是由分子构成
【答案】A
【解析】A、物质可以根据所含物质种类分为纯净物和混合物,选项正确;
B、电灯通电会发光、发热,但没有新物质生成,不属于化学变化,选项错误;
C、烧杯可以用于加热,其底面积过大,受热可能不均匀,不能直接用于加热,加热时需垫上陶土网,
选项错误;
D、物质并不都是由分子构成的,如铁是由铁原子构成的,氯化钠是由钠离子与氯离子构成的,选项错
误。
故选 A。
14.小明同学对所学部分化学知识归纳如下,其中完全正确的一组是
A、须辨清的现象
B、化学变化伴随的能量
①缓慢氧化——放热
①红磷在氧气中燃烧---发白光
②碳在氧气中燃烧---发淡蓝色火焰
③铁丝在氧气中燃烧---火星四射
②铁丝燃烧——吸热
③木炭燃烧——放热
C、用分子的观点解释
D、化学与环境
①水蒸发为水蒸气——分子体积变大
②墙内开花墙外香—分子在不断运动
①化学可以使世界变得更加绚丽多彩
②空气污染物主要是粉尘和有害气体
③一个水分子的质量约为 3×10-26kg——分子 ③大气中的二氧化碳含量上升,会导致温室效应增强,全球
质量小
气候变暖
6 / 19
【答案】D
【解析】A、红磷在氧气中燃烧产生大量白烟,该项错误;碳在氧气中燃烧发出白光,该项错误;铁丝
在氧气中剧烈燃烧、火星四射、生成黑色固体,该项正确,故 A 选项错误。
B、缓慢氧化属于放热反应,该项正确;铁丝燃烧,放出热量,该项错误;木炭燃烧,放出热量,该项
正确,故 B 选项错误。
C、水蒸发为水蒸气,体积增加因为水分子的间隔增大,该项错误;墙内开花墙外香,因为分子在不断
的运动,该项正确;一个水分子的质量约为 3×10-26kg 说明分子质量小,该项正确,故 C 选项错误。
D、化学可以使世界变得更加绚丽多彩,正确;目前计入空气污染指数项目的主要包括 SO2、CO、NO2
、臭氧、可吸入颗粒物等,空气污染物主要是粉尘和有害气体,正确;二氧化碳是温室气体,大气中
的二氧化碳含量上升,会导致温室效应增强,全球气候变暖,正确,该选项正确。
故选 D。
15.控制变量法是实验探究的重要方法,下列实验方法的设计中,能达到实验目的是
A.图甲比较铁、铜的金属活动性强弱
B.图乙探究金属的锈蚀是否需要水
C.图丙探究 MnO 对 H O 分解的催化作用
2
2
2
D.图丁探究可燃物的燃烧是否需要达到一定温度
【答案】B
【解析】A、由于酸的种类不同,因此无法比较铁和铜的金属活动性顺序,故选项错误;
B、实验可知铁钉在干燥的空气中不生锈,而在潮湿的空气中生锈,二者的控制因素是水,故选项正确;
C、要探究催化剂的影响,应该选择质量分数相同的过氧化氢溶液,故选项错误;
D、由于水中的红磷与氧气也不能接触,因此不能探究出温度的影响,故选项错误;
故选 B.
16.磷酸奥司他韦胶囊是治疗流感的特效药,奥司他韦的化学式可表示为 C H N O 。下列说法正确的是
16 28
2
4
A.从物质分类上看:C H N O 属于混合物
16 28
2
4
B.从宏观组成上看:C H N O 由碳、氢、氮、氧四种元素组成
16 28
2
4
C.从微观结构上看:C H N O 中有 1 个氮分子
16 28
2
4
D.从质量占比上看:C H N O 中碳元素和氢元素的质量比为 16:28
16 28
2
4
【答案】B
【解析】A、C H N O 中只含一种物质,属于纯净物,该选项说法不正确;
16 28
2
4
B、由化学式可知,C H N O 由碳、氢、氮、氧四种元素组成,该选项说法正确;
16 28
2
4
7 / 19
C、C H N O 中不含氮气,则不含氮分子,该选项说法不正确;
16 28
2
4
D、C H N O 中碳元素和氢元素的质量比为(12×16):(1×28)=48:7,该选项说法不正确。
16 28
2
4
故选 B。
17.某化肥厂生产丁时有下列转化。下列说法不正确的是
A.转化①、②均为化合反应
B.整个过程中共有 2 种氧化物
C.整个转化中,甲与丁的分子个数之比为 1︰1
D.丁中氮元素质量分数小于丙
【答案】A
【解析】A、转化①是由两种物质生成一种物质的反应,属于化合反应,转化②NH 和 CO 反应生成
3
2
CO(NH ) 和 H O,不属于化合反应,A 选项错误;
2
2
2
B、氧化物是由两种元素组成,其中一种元素是氧元素的化合物。整个过程中水和二氧化碳属于氧化物,
共有 2 种氧化物,B 选项正确;
C、转化①化学反应方程式为
,转化②的化学方程式为
,根据转化①、②化学方程式可知,整个转化中,甲与丁的分
子个数之比为 1:1,C 选项正确;
D、丁中氮元素质量分数为
,丙中氮元素质量分数为
,因此丁中氮元素质量分数小于丙,D 选项正确。
故选:A。
18.室温时,利用压强传感器研究质量相同的一块镁片和一块锌片分别与等浓度、等质量的稀盐酸反应的
实验如图甲,压强传感器测得装置内压强随时间的变化关系如图乙。下列说法正确的是(
)
8 / 19
A.根据压强变化推测两个反应都有热量放出
B.曲线①的压强上升比曲线②高,说明①产生 H2 总量更多
C.曲线②是 Mg 与稀盐酸反应的压强变化曲线
D.反应结束后 Zn 一定有剩余
【答案】A
【解析】A、镁、锌都能与稀盐酸反应生成氢气,根据图乙随着反应的进行,曲线①、曲线②的压强都
是先增大,后小幅下降,可推测两个反应过程中都有热量放出,故选项说法正确;
B、根据图乙,曲线①、曲线②最后压强相等,说明两者产生的氢气质量相等,故选项说法不正确;
C、镁的活动性比锌强,则曲线①是镁与稀盐酸反应的压强变化曲线,故选项说法不正确;
D、最终压强相等,说明反应后生成氢气质量相等,生成氢气质量相等时,消耗镁、锌的质量比是 24:65,
因此镁片一定有剩余,而锌片不一定有剩余,故选项说法不正确;
故选 A。
19.过氧化钠(Na O )是一种淡黄色固体,常温下与二氧化碳发生反应的化学方程式为:2Na O +2CO ═
2
2
2
2
2
2Na CO +O 。现将沾有过氧化钠固体的棉花放入烧杯中,再缓慢向烧杯中倒入适量稀硫酸,使之与杯
2
3
2
底的 Na CO 反应产生 CO 气体,发现蜡烛火焰熄灭,沾有过氧化钠固体的棉花燃烧起来。从实验获
2
3
2
得信息中,你认为不正确的是
A.棉花具有可燃性
B.CO2 不支持蜡烛燃烧,但能支持棉花燃烧
C.Na O 与 CO 反应放热,使温度达到棉花的着火点
2
2
2
D.棉花燃烧证明“可燃物、氧气、温度达到着火点”是燃烧必须同时具备的条件
【答案】B
【解析】A、沾有 Na O 固体的棉花燃烧起来,就说明棉花具有可燃性,故正确;
2
3
B、蜡烛火焰熄灭,是因为稀硫酸与杯底的 Na CO 反应产生 CO 气体,二氧化碳不支持燃烧,所以蜡
2
3
2
烛熄灭;而二氧化碳不支持燃烧是它的特性,并不因燃烧物的不同而改变,所以 CO2 不支持蜡烛燃烧,
同样不支持棉花燃烧,故错误;
C、沾有 Na O 固体的棉花之所以燃烧起来,就是因为 Na O 与生成的二氧化碳反应释放出热量,使棉
2
2
2
2
花达到着火点,所以棉花燃烧起来,故正确;
D、棉花能够燃烧就是因为棉花是可燃物,并与氧气(或空气)接触,稀硫酸与杯底的 Na CO 反应释
2
3
放的热量,使棉花达到了着火点。所以我们由此可知“可燃物、氧气、温度达到着火点”是燃烧必须同
时具备的条件,故正确。
9 / 19
故选 B。
20.科学工作者研发了一种 SUNCAT 系统,借助该系统利用如图所示的原理可持续合成氨。下列说法正确
的是
A.该系统中只有 Li、O 的化合价发生了改变
B.涉及的反应类型只有化合反应和分解反应
C.理论上,每合成 68gNH3,就需要消耗 56gN2
D.理论上,每消耗 28gN2,需额外补充 42gLi
【答案】C
【解析】A、由图可知,系统中涉及氮气、锂、氧气反应,单质中各元素的化合价为 0 价,化合物中元
素化合价不为 0,故该系统中氮元素、锂元素、氧元素的化合价均发生了改变,故 A 说法不正确;
B、①为氮气与 Li 反应生成 Li N,该反应符合多变一的特点,属于化合反应,②为 Li N 和 H O 反应
3
3
2
生成 NH3 和 LiOH,该反应的反应物与生成物都是两种,既不属于分解反应也不属于化合反应,③为
LiOH 通电生成 Li、氧气和水,该反应符合一变多的特点,属于分解反应,故 B 说法不正确;
C、由图可知,氮气中氮元素最终完全转化为氨气,即该系统中氮元素守恒,氨气中氮元素的质量等于
氮气中氮元素的质量,则 68g 氨气中氮元素的质量为:
56g,故 C 说法正确;
,则消耗氮气的质量为
D、由流程图可知,Li 可以循环使用,所以不需要额外补充 Li,故 D 说法不正确;
故选 C。
第 II 卷(非选择题 共 50 分)
21.(3 分)化学与我们的生活息息相关,请用符合要求的物质的序号填空。
①干冰
②活性炭
③生石灰
④金刚石
(1)天然存在的最硬的物质是
(2)可用于制造舞台云雾的是
(3)可用于做食品干燥剂的是
。
。
。
【答案】(1)④
(2)①
(3)③
10 / 19
【解析】(1)金刚石为天然存在最硬的物质,故填④。
(2)干冰为固体二氧化碳的俗称,干冰易升华吸热,则可用于制造舞台云雾,故填①。
(3)生石灰为氧化钙的俗称,能和水反应,则可用于做食品干燥剂,故填③。
22.(4 分)化学在人体保健、医疗工生、生活生产等方面做出了重大贡献。请用所学过的化学知识解答下
列问题。
(1)常见的温度计有水银温度计,其中水银是由
(2)食盐是维持人体正常生理活动必不可少的物质。测得某“低钠盐”样品中含有 NaCl 和 KCl 的质量
分数均为 50%。该样品中含量最多的离子是 。(填离子符号)
(3)油炸食物不宜多吃,因长时间煎炸会产生有毒物质-丙烯醛(C H O)。丙烯醛在空气中完全燃烧时
(填微粒名称)构成。
3
4
和酒精类似,请写出丙烯醛完全燃烧的化学方程式
【答案】(1)汞原子 (2)Cl- (3)
【解析】(1)水银是汞的俗称,汞是由汞原子构成的;
。
(2)NaCl 和 KCl 质量分数各占比 50%,两者都有 Cl-,该样品中含量最多的离子是 Cl-;
(3)丙烯醛完全燃烧生成二氧化碳和水,反应的化学方程式是
。
23.(3 分)“自热火锅”主要由料包和发热包(主要成分为生石灰、焙烧硅藻土、活性炭、铁粉、铝粉、碳
酸钠等)组成,使用方法如图所示。
(1)向发热包中加水后,会释放出大量的热,发热的原理之一是生石灰与水反应放热,此反应的化学
方程式是
(2)焙烧硅藻土、活性炭都有疏松多孔的结构,能起到
【答案】CaO+H2O=Ca(OH)2
吸附
。
作用。
【解析】(1)生石灰是氧化钙的俗称,氧化钙与水反应生成氢氧化钙,并放出大量的热,化学方程式
为 CaO+H O=Ca(OH) ;
2
2
(2)焙烧硅藻土、活性炭都有疏松多孔的结构,能起到吸附作用。
24.(8 分)结合下图回答问题。
11 / 19
(1)仪器名称:a
(2)用高锰酸钾制取氧气,可选用装置
置,反应的化学方程式为
(3)用如图装置验证固体 X 中是否含 CaCO3。
。
为发生装置(选填序号,下同)和装置
为收集装
。
资料:①X 是化工产品亚硫酸钙(CaSO3)。
②CaSO 和稀 HCl 反应产生 SO ,SO 能使紫红色 KMnO 溶液褪色,也能使澄清石灰水变浑浊。
3
2
2
4
实验:打开 K,观察实验现象。
①装置 F 相对于装置 B 的优点是
。
②若 G 中溶液褪色,H、I 中无明显变化,则 X 中
CaCO3(填“含”、“不含”)。若 G 中溶液褪色,
H 中无明显变化,I 中
【答案】(1)铁架台
(填实验现象),则 X 中含 CaCO3。装置 H 的作用是
。
(2)A
CD/DC
(3)控制反应的开始和停止
不含
澄清石灰水变浑浊
检验气体中是否还有残存的二氧
化硫
【解析】(1)由图可知 a 是铁架台。
(2)用高锰酸钾制取氧气,是固固加热型,故发生装置选 A,因为氧气密度大于空气且难溶于水,则
可以选用排水法和向上排空气法收集,收集装置选 C 或 D,加热高锰酸钾,生成锰酸钾,二氧化锰和
氧气,化学方程式为:
。
(3)①F 中的有孔隔板可以控制固体 X 和稀盐酸的接触,从而控制 X 与稀盐酸发生反应,控制反应的
开始和停止,而装置 B 无法控制反应的开始和停止。
②H 中无变化,说明二氧化硫已经被 G 完全吸收,I 中无变化,说明没有二氧化碳生成,所以 X 中不
12 / 19
含 CaCO3。
若 X 中含 CaCO3,则有二氧化碳生成,I 中澄清石灰水变浑浊。
I 中是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:Ca(OH) +CO =CaCO ↓+H O。
2
2
3
2
装置 H 是为了检验气体中是否还有残存的二氧化硫。
25.(7 分)Ⅰ.研究氢、利用氢,能减少碳排放,助力碳中和。该新方法的示意图如图所示。
(1)反应器 1:一定的 H 环境及较低温度下,CaCO 可与 H 反应生成 CaO、CO 和 H O。则 CO 与
2
3
2
2
H2O 的分子个数比为
。
(2)CaCO 还可以直接分解为 CaO 和 CO ,反应器 1 中 CO、CO 的含量随反应温度的变化如图所示,
3
2
2
℃时,抑制 CO2 生成的效果最好。
(3)反应器 2 中,CO 与 H 一定条件下发生化合反应生成甲醇(CH OH),则该反应的化学方程式
2
3
为
。
Ⅱ.镁基储氢材料(主要成分 Mg)是极具应用前景的储氢材料。储氢、释氢过程中涉及的部分物质转化
如下:
(4)释氢过程:ⅰ.方法 I 中,化合价发生改变的元素有
。
13 / 19
ⅱ.方法Ⅱ,产生 H2 的质量
ⅲ.与方法 I 相比,方法Ⅱ的优点是
【答案】(1)1:1
(填“”)参加反应的 MgH2 中氢元素的质量。
(答 1 条即可)。
(2)750
(3)
(4)Mg、H
>
反应条件低(或 MgH2 质量相同时,方法 2 产生氢气的质量比方法 1 的多)
【解析】(1)一定的 H 环境及较低温度下,CaCO 可与 H 反应生成 CaO、CO 和 H O,方程式为:
2
3
2
2
,故 CO 与 H2O 的分子个数比为 1:1;
(2)应器 1 中 CO、CO2 的含量随反应温度的变化如图所示,750℃时,CO 的含量最高,所以抑制 CO2
生成的效果最好;
(3)反应器 2 中、CO 与 H 一定条件下发生化合反应生成甲醇(CH OH),反应的化学方程式为:
2
3
;
(4)ⅰ.释氢过程中,反应前氢化镁中镁元素显+2 价,所以氢元素显-1 价,水中氢元素显+1 价,氧元
素显-2 价,反应后金属镁中镁元素化合价为 0,氢气中氢元素化合价为 0,氢氧化镁中镁元素显+2 价,
氧元素显-2 价,氢元素显+1 价,所以化合价发生改变的元素有 Mg、H;
ⅱ.由反应的方程式
、
,可知生
成的氢气有部分氢元素由水提供,所以生成氢气的质量大于参加反应的 MgH2 中氢元素的质量;
ⅲ.与方法 I 相比,方法Ⅱ在常温下就能发生反应,反应条件低。
26.(7 分)阅读下列短文,回答相关问题。
新型碳材料——环碳
碳是一种常见的元素,在自然界中有多种形式。其外在表现形式取决于每个碳原子周围与之连接的碳
原子数目。当每个碳原子与周围 4 个碳原子连接时,就形成了金刚石;当每个碳原子与周围 3 个碳原
子连接时,就形成了石墨;当每个碳原子与周围 2 个碳原子连接时,则形成环形纯碳分子(环碳 )。
同种元素组成的不同单质称为同素异形体,环碳、金刚石、石墨都是碳的同素异形体。环碳中碳原子
与碳原子之间的连接方式(也叫成键方式)有两种:一种是累积烯炔型,碳原子通过连续双键连接,
如
“
”;另一种是聚炔型,碳原子通过单键与叁键交替连接,如“
”。
2019 年,牛津大学的研究团队通过环氧碳分子 在 5K(K 是温度单位)温度下脱去 CO 制备环碳
,验证了
为聚炔型结构,转化过程如图所示。
14 / 19
2023 年我国同济大学用全氯化萘(
)和全氯化蒽(
)两种前驱体分子,在 NaCl 薄膜表面
上合成了两种环碳分子 。原子力显微镜显示,
和
和
均为累积烯炔型结构,如下图。
研究人员表示,该项研究提出的表面合成策略有望成为一种合成系列环碳的普适方法,合成的环碳有
望成为新型半导体材料,在分子电子器件中有广阔的应用前景。
(1)金刚石和石墨物理性质差异很大的原因是
。
(2)1 个全氯化萘(
已知苯的结构为
个氯原子。
)分子和 1 个全氯化蒽(
)分子中所含原子个数之比是
;
,结合全氯化萘和全氯化蒽的分子结构可推断,1 个全氯化苯分子中含有
(3)制备
(4)用
的转化过程中,碳元素的质量分数 (填“升高”、“降低”或“不变”)。
制备
的化学方程式为
(填序号)。
。
(5)下列叙述正确的是
a.
b.
c.
是碳的一种同素异形体
的分子中每个碳原子与周围 2 个碳原子连接
中碳原子的连接方式都是单键与叁键交替连接。
与
【答案】(1)碳原子的排列方式不同(或每个碳原子周围与之连接的碳原子数目不同)
(2)3:4
(4)
6
(3)升高
(5)ab/ba
【解析】(1)金刚石和石墨物理性质差异很大的原因是碳原子的排列方式不同(或每个碳原子周围与
之连接的碳原子数目不同);
(2)根据全氯化萘(C Cl )、全氯化蒽(C Cl )化学式可知,1 个全氯化萘(C C )分子和 1 个
10
8
14 10
10 l8
全氯化蒽(C14Cl10)分子中所含原子个数之比是(10+8):(14+10)=3:4;根据苯分子结构可知,1
个苯分子中含有 6 个碳原子,1 个全氯化苯分子中含有 6 个氯原子;
15 / 19
(3)根据“2019 年,牛津大学的研究团队通过环氧碳分子 C O 在 5K(K 是温度单位)温度下脱去
24
6
CO 制备环碳 C18”可知,C18 中,只有碳元素,制备 C18 的转化过程中,碳元素的质量分数升高;
(4)根据“2019 年,牛津大学的研究团队通过环氧碳分子 C O 在 5K(K 是温度单位)温度下脱去
24
6
CO 制备环碳 C ”可知,用 C O 制备 C 发生的反应是 C O 在 5K 条件下分解生成 C 和 CO,化学
18
24
6
18
24
6
18
方程式为:
;
(5)a.C60 是由碳元素组成的单质,是碳的一种同素异形体,正确;
b.根据题中图示可知,C10 的分子中每个碳原子与周围 2 个碳原子连接,正确;
c.根据题中图示可知,C18 中碳原子的连接方式都是单键与叁键交替连接,C14 中碳原子的连接方式都
是连续双键连接,错误。
故选 ab。
27.(8 分)碳酸钡(BaCO3)用于电子陶瓷、PTC 热敏电阻、电容器等多种电子元器件的制造。工业上以重
晶石(主要成分为 BaSO ,杂质为 Fe O )为原料生产碳酸钡的流程如图。
4
2
3
已知:焙烧温度为 1000-1200℃,BaS 易溶于水
(1)重晶石进入“焙烧”前需粉碎的目的是
。焙烧时,焦炭与杂质 Fe O 也会发生反应,实际
2
3
生产中必须加入过量焦炭,其目的是使重晶石充分反应,提高产率和
。
(2)焙烧时,温度和时间对硫酸钡转化率的影响如图,由此可知最佳的反应条件为
。
焙烧时生成 BaS,该反应的化学方程式为
。
(3)“沉钡”时,发生的反应为 BaS+(NH ) CO =BaCO ↓+ X,(NH ) CO 阳离子为
,“滤液 2”
4
2
3
3
4
2
3
中溶有的主要物质的化学式为
,该操作Ⅰ的名称是
。
【答案】(1)增大反应物的接触面积,加快反应速率,使反应更充分
(2) 1000℃反应 60min
提供热量
(3)
(NH ) S
过滤
4
2
16 / 19
【解析】(1)重晶石进入“焙烧”前需粉碎的目的是增大反应物的接触面积,加快反应速率,使反应更
充分。焙烧时,焦炭与杂质 Fe O 也会发生反应,通过加入过量焦炭,可使重晶石充分反应,同时焦炭
2
3
燃烧可以维持反应的高温热量,故填:提供热量。
(2)根据图像可知,在 1000℃时,硫酸钡转化率最高,故焙烧的最佳温度为 1000℃;时间在 60min
时,硫酸钡转化率最高,故焙烧的时间约为 60min。硫酸钡和碳在 1000-1200℃的条件下反应生成一氧
化碳和硫化钡,该反应的化学方程式为
。
(3)(NH ) CO 是由铵根离子和碳酸根离子构成的,其中铵根离子是阳离子,其离子符号为
,由
4
2
3
“沉钡”时的化学方程式,反应前钡、硫、氮、氢、碳、氧原子的个数分别为 1、1、2、8、1、3,反应
后钡、硫、氮、氢、碳、氧原子的个数分别为 1、0、0、0、1、3,则一个 X 的微粒中含有 1 个硫原子、
2 个氮原子和 8 个氢原子,故 X 的化学式为(NH ) S,碳酸钡难溶于水,而硫化铵能溶于水,故滤液 2”
4
2
中溶有的主要物质的化学式为(NH ) S 操作Ⅰ是将碳酸钡沉淀和溶液分离的操作,为过滤。
4
2 。
28.(10 分)金属锶(Sr)是一种银白色金属,化学性质活泼,在空气中极易被氧化,广泛应用于冶金、
航空航天、电池材料等领域。
Ⅰ.制备金属锶(Sr):工业上,常以菱锶矿(主要成分为 SrCO3)为原料,用金属铝热还原法制备金
属锶的流程如下:
【资料卡片】
① SrCO +2HNO =Sr(NO ) +H O+CO ↑
3
3
3
2
2
2
② Sr(NO ) 受热易分解生成 SrO、NO 和一种常见的气体单质。
3
2
2
(1)写出 Sr(NO ) 受热分解的化学方程式
。
3
2
(2)图中 a、b 两处的操作顺序为
A.a.高温加热 b.真空脱气
(填序号)
B.a.真空脱气 b.高温加热
(3)写出 Al 热还原 SrO 制 Sr 的化学方程式
。
Ⅱ.制备氮化锶(Sr N ):氮化锶广泛应用于生产荧光粉。实验室利用图 1 所示装置制取 N ,将图 1
3
2
2
和图 2 相连即可制得 Sr N 。
3
2
【资料卡片】
①碱石灰是氢氧化钠和氧化钙的混合物,可吸收二氧化碳和水。
②常温下,锶遇水即发生反应。氮化锶遇水剧烈反应。
17 / 19
(4)图 1 中玻璃管 a 的作用是
(5)图 2 中碱石灰的作用是
。
。
(6)计算实验室用 26.4 g 的金属锶最多可制备氮化锶的质量。(写出计算过程)
【答案】(1)2Sr(NO3)2 2SrO+4NO ↑+O ↑
2
2
(2)B
(3)2Al+3SrO
3Sr+Al2O3
(4)平衡上下压强,便于液体顺利下滴
(5)干燥 N2(除去水蒸气),防止锶、氮化锶与水反应
(6)解:设可制备氮化锶的质量为 x。
x=29.2g
答:最多可制得氮化锶 29.2g。
【解析】(1)根据“Sr(NO ) 受热易分解生成 SrO、NO 和一种常见的气体单质”和质量守恒定律可
3
2
2
知,该单质是氧气,Sr(NO ) 受热分解生成的化学方程式:2Sr(NO ) 2SrO+4NO ↑+O ↑;
3
2
3
2
2
2
(2)铝在高温条件易与空气中的氧气反应,图中 a、b 两处的操作顺序为真空脱气、高温加热。
故选 B;
(3)根据流程图可知,Al 热还原 SrO 制 Sr 的反应是 SrO 与 Al 在高温条件下反应生成 Sr 和 Al O ,反
2
3
应化学方程式:2Al+3SrO
3Sr+Al O ;;
2 3
18 / 19
(4)图 1 中玻璃管 a 的作用平衡上下压强,便于液体顺利下滴,仪器 b 的名称酒精灯;
(5)根据“常温下,锶遇水即发生反应。氮化锶遇水剧烈反应”可知,图 2 中碱石灰的作用干燥 N2(除
去水蒸气),防止锶、氮化锶与水反应;
(6)根据图 2 可知,Sr 与 N 在加热条件下生成 Sr N ,反应的化学方程式为 3Sr+N Sr N 。详见答
2
3
2
2
3
2
案。
19 / 19
相关试卷
这是一份九年级化学开学摸底考(长沙专用,人教版2024第1~8单元)-2024-2025学年初中下学期开学摸底考试卷.zip,文件包含九年级化学开学摸底考全解全析docx、九年级化学开学摸底考考试版测试范围第18单元人教版2024A4版docx、九年级化学开学摸底考考试版测试范围第18单元人教版2024A3版docx、九年级化学开学摸底考参考答案docx、九年级化学开学摸底考答题卡A4版pdf、九年级化学开学摸底考答题卡A4版docx等6份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
这是一份九年级化学开学摸底考(湖南专用,人教版2024第1~8单元)-2024-2025学年初中下学期开学摸底考试卷.zip,文件包含九年级化学开学摸底考全解全析docx、九年级化学开学摸底考考试版测试范围第18单元人教版2024A4版docx、九年级化学开学摸底考考试版测试范围第18单元人教版2024A3版docx、九年级化学开学摸底考答题卡A4版docx、九年级化学开学摸底考答题卡A4版pdf、九年级化学开学摸底考参考答案docx等6份试卷配套教学资源,其中试卷共31页, 欢迎下载使用。
这是一份九年级化学开学摸底考(湖北专用,人教版2024第1~8单元)-2024-2025学年初中下学期开学摸底考试卷.zip,文件包含九年级化学开学摸底考全解全析docx、九年级化学开学摸底考考试版测试范围第18单元人教版2024A4版docx、九年级化学开学摸底考考试版测试范围第18单元人教版2024A3版docx、九年级化学开学摸底考参考答案docx、九年级化学开学摸底考答题卡A4版docx、九年级化学开学摸底考答题卡A4版pdf等6份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。








