





高中化学人教版 (2019)选择性必修1第二节 电解池评课课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第二节 电解池评课课件ppt,共16页。PPT课件主要包含了电解饱和食盐水,氯碱工业的应用,拓展延伸离子交换膜,视频“电解精炼铜”,不相等,电冶金,MgCl2,课堂练习,ABC等内容,欢迎下载使用。
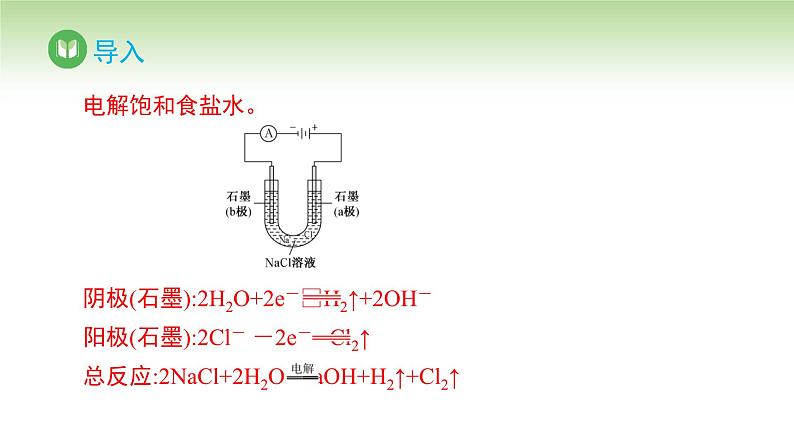
提问:大家还记得海水的综合利用吗? 通过对海水的处理,得到食盐,将食盐运用到氯碱工业,得到的产品可以用于纺织、轻工、冶金、化工等领域。那么工业上可通过什么反应来得到这些产品?
提问:反应过程中可能存在哪些副反应呢?
提问:如何防止副反应的发生呢?
提问:电解饱和食盐水需要解决的主要问题是什么?
(1)避免Cl2与 NaOH 溶液发生反应,使产品不纯。 (2)避免生成物 H2 和 Cl2 混合发生爆炸。
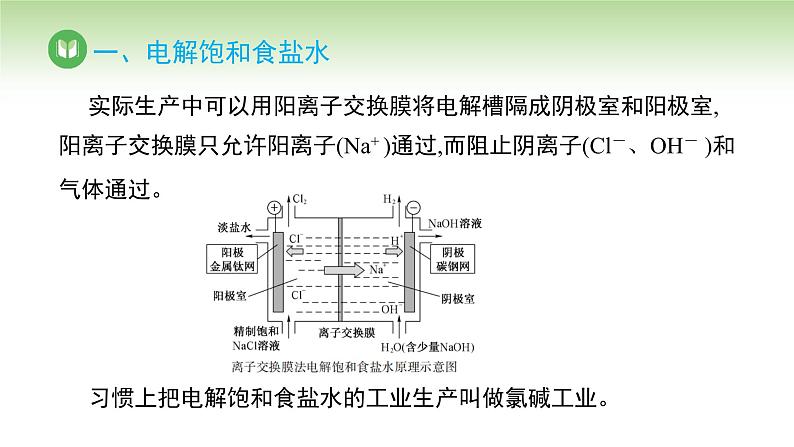
实际生产中可以用阳离子交换膜将电解槽隔成阴极室和阳极室,阳离子交换膜只允许阳离子(Na+ )通过,而阻止阴离子(Cl-、OH- )和气体通过。习惯上把电解饱和食盐水的工业生产叫做氯碱工业。
思考:(1)分析并书写电解饱和食盐水的电极反应及总反应。
思考:(2)阳离子交换膜的作用是什么?
提示:①阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过。②电解饱和食盐水的装置中,阳离子只允许 Na+ 、H+ 通过,而 Cl- 、OH- 和气体不能通过,故既可防止阳极生成的Cl2和阴极生成的 H2混合而引起爆炸,又能避免Cl2 和 NaOH 溶液发生反应。
思考:(3)阴极室加入含少量 NaOH 的水的目的是什么?(4)电解饱和食盐水装置中阴极区溶液为什么呈碱性?
提示:增强溶液导电性。
提示:放电的 H+ 来源于水的电离,其在阴极上得电子生成 H2,破坏了水的平衡,促进了水的电离,使溶液中c(OH- )>c(H+ ),使阴极区溶液显碱性。
小试牛刀 1.正误判断。(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e- Cl2↑。 ( )(2)向氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区。( )(3)电解饱和食盐水时,阳极和阴极都可以选择金属材料(如铁)。 ( )(4)电解饱和 NaCl 溶液可以制取金属钠。 ( )
小试牛刀 2.“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和食盐水,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。c、d都为石墨电极。回答下列问题:
小试牛刀 (1)a为电源的_____(填“正”或“负”)极,c为电解池的_____(填“阴”或“阳”)极。(2)d电极的电极反应式:_______________________,电解产生消毒液的总化学方程式为____________________________。
离子交换膜是“具有选择透过性能的网状立体结构的高分子功能膜或分离膜”,常运用于膜电解和电渗析等离子交换膜法技术中。它具有选择透过性、分离效率高、能耗低、污染少等特点,在水处理、环保、化工、冶金等领域都有广泛应用。离子交换膜的种类有阳离子交换膜、阴离子交换膜、质子交换膜等。
离子交换膜的作用:①隔离某些物质,防止阴极与阳极产物之间或产物与电解质溶液之间发生反应;②用于制备某些物质,通过离子定向移动使得阴极区或阳极区得到所制备的新物质;③对物质进行分离、提纯等。
提问:在日常生活中,我们经常看到一些美观的金属制品在使用一段时间后失去表面的光泽,如铁生锈等。我们应该怎么做才能避免或减缓这种现象的发生呢? 为什么要这么做?
(1)定义:电镀是一种利用电解原理在某些金属表面镀上一薄层其他金属或合金的加工工艺。(2)目的:使金属增强抗腐蚀能力,增加表面硬度和美观。(3)组成:电源、阴极(待镀的金属制品)、阳极(镀层金属)、电镀液。
提问:如何给铁制品镀铜,绘制出电镀铜的图示,并写出电极反应。思考电镀池中电解液的浓度有何变化。
电解精炼铜(粗铜含锌、银、金等杂质)
(2)阳极泥:粗铜中Cu变成Cu2+ 而溶解,金、银等杂质则沉积在电解槽底部形成阳极泥,阳极泥可作为提炼金、银等金属的原料。(3)电解质溶液的变化:Cu2+ 浓度减小。
小试牛刀 1.正误判断。(1)在Fe上电镀Zn,应用Zn作阳极,用ZnSO4溶液作电镀液。 ( )(2)电解精炼铜时,粗铜作阳极,活泼性比Cu弱的杂质金属成为阳极泥沉在阳极区。( )(3)电解精炼铜时,电解质溶液的成分不发生变化。 ( )(4)电镀过程相当于金属的“迁移”,属于物理变化。 ( )
小试牛刀 2.金属镍有广泛的用途。粗镍中含有少量 Fe、Zn、Cu、Pt 等杂质,可用电解法制备高纯度的镍,思考回答下列问题:(1)阳极发生______反应,其电极反应式:_______________________________________________________。(2)电解过程中,阳极减少的质量与阴极增加的质量________(填“相等”或“不相等”)。(3)电解后,溶液中存在的金属阳离子有___________、Ni2+ 等。(4)电解后,电解槽底部含有________等金属。
Fe2+ 、Zn2+
归纳总结(1)电解精炼过程中的“两不等”:电解质溶液浓度在电解前后不相等、阴极增加的质量和阳极减少的质量不相等。(2)电镀过程中的“一多,一少,一不变”:“一多”指阴极上有镀层金属沉积、“一少”指阳极上有镀层金属溶解、“一不变”指电镀液(电解质溶液)的浓度不变,且阴极增加的质量与阳极减少的质量相等。
提问:在人类数千年的文明发展历程中,人们陆续发现并制得了许多金属,但直到近三、四百年,Na、Mg、Al等活泼金属才被陆续发现和制得,这是什么原因呢?
对于一些活泼的金属,很难有还原剂能将它们从其化合物中还原出来。
(2)目的:冶炼金属,特别是钠、钙、镁、铝等活泼金属的冶炼。(3)组成:电源、阴极、阳极、熔融盐。
书写:电解熔融 NaCl的电极反应式、总反应式,并与电解食盐水作对比。
(2)电解食盐水得到的产物是氢气、氯气和氢氧化钠,电解熔融氯化钠得到的是金属钠和氯气。
特别提醒(1)由于 AlCl3 为共价化合物,熔融状态下不导电,故电解冶炼铝时,用熔点很高的 Al2O3,电解时为降低熔点,加入了助熔剂冰晶石(Na3AlF6);电解过程中,阳极生成的O2 会与石墨电极反应,故石墨电极需定期更换。其电极反应为:(2)因为 MgO的熔点高,工业上通过电解熔融的 MgCl2 制备 Mg。
小试牛刀 1.正误判断。(1)活泼的金属往往采用电解法冶炼。 ( )(2)工业上常用钠与熔融的氯化镁反应制取金属镁。 ( )(3)工业冶炼金属铝时,电解熔融态 AlCl3。 ( )
小试牛刀2.金属镁的工业制备是电解熔融________(填“MgCl2”或“MgO”),原因是__________________________________。
熔融氧化镁需要的温度较高、耗能较大
小试牛刀3.下列有关传统工业电解法生产金属铝的说法,错误的是 ( )A.铝土矿的主要成分是 Al2O3,电解铝的阴极和阳极材料均为碳B.加入冰晶石和少量CaF2 的目的是降低氧化铝的熔点C.将氧化铝转化为氯化铝再进行电解,目的是冶炼金属铝时可以节约大量能源D.冶炼过程中,阳极材料可能会因不断被消耗而需要定期更换
二、电镀2.电解精炼(粗铜含锌、银、金等杂质)阳极泥:粗铜中 Cu 变成 Cu2+ 而溶解,金、银等杂质则沉积在电解槽底部形成阳极泥。电解质溶液的变化:Cu2+ 浓度减小。
2.普通电解精炼铜的方法所制备的铜中仍含杂质,利用如图的双膜(阴离子交换膜和过滤膜)电解装置可制备高纯度的铜。下列有关叙述错误的是( )A.当电路中通过 1 ml 电子时,可生成 32 g 精铜B.电极a为粗铜,电极 b为精铜C.甲膜为阴离子交换膜,可阻止杂质阳离子进入阴极区D.乙膜为过滤膜,可阻止阳极泥及漂浮物杂质进入阴极区
3.降低能耗是氯碱工业发展的重要方向。(1)我国利用氯碱厂生产的 H2作燃料,将氢燃料电池应用于氯碱工业,其示意图如图所示。①a极为______(填“正”或“负”)极。②乙装置中电解饱和 NaCl溶液的化学方程式为_____________________________。
3.降低能耗是氯碱工业发展的重要方向。(1)我国利用氯碱厂生产的 H2作燃料,将氢燃料电池应用于氯碱工业,其示意图如图所示。③下列说法正确的是______(填序号,下同)。A.甲装置可以实现化学能向电能的转化B.甲装置中 Na+ 透过阳离子交换膜向a极移动C.乙装置中c极一侧流出的是淡盐水④结合化学用语解释d极区产生 NaOH 的原因:________________________________________________________________________________________________。
3.降低能耗是氯碱工业发展的重要方向。(1)我国利用氯碱厂生产的 H2作燃料,将氢燃料电池应用于氯碱工业,其示意图如图所示。⑤实际生产中,阳离子交换膜的损伤会造成 OH-迁移至阳极区,从而在电解池阳极能检测到 O2,产生O2的电极反应式为________________________________________。
3.降低能耗是氯碱工业发展的重要方向。(1)我国利用氯碱厂生产的 H2作燃料,将氢燃料电池应用于氯碱工业,其示意图如图所示。下列生产措施有利于提高 Cl2产量、降低阳极 O2含量的是________。A.定期检查并更换阳离子交换膜B.向阳极区加入适量盐酸C.使用Cl- 浓度高的精制饱和食盐水为原料
相关课件
这是一份高中人教版 (2019)第二节 电解池课文课件ppt,共16页。PPT课件主要包含了导入一,导入二,电解原理,电解规律,CuO或CuCO3,或124,课堂练习等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 电解池公开课课件ppt,共14页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第二节 电解池习题ppt课件,文件包含电解池第二课时-课件pptx、电解池第一课时-课件pptx、电解池第三课时-课件pptx、电解池第一课时-练习题docx、电解池第三课时-练习题docx、电解池第二课时-练习题docx等6份课件配套教学资源,其中PPT共126页, 欢迎下载使用。









