
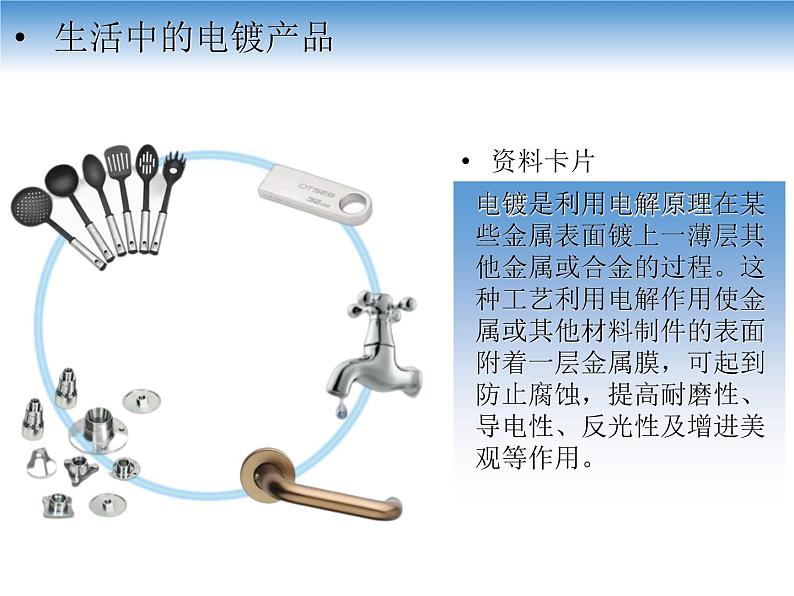
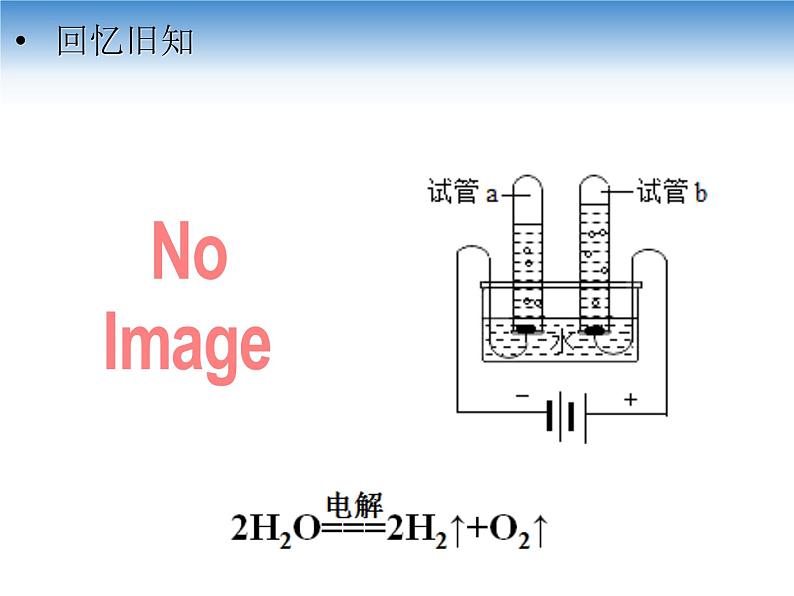

人教版 (2019)选择性必修1第二节 电解池说课课件ppt
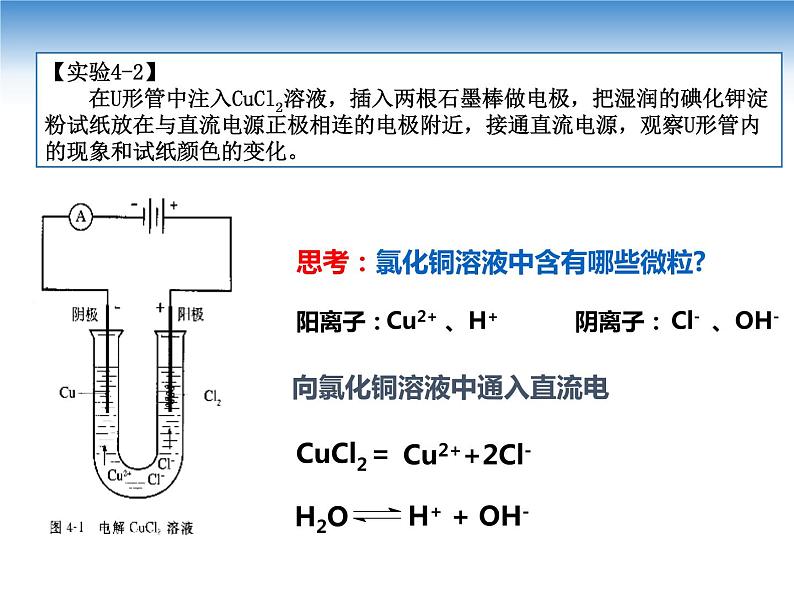
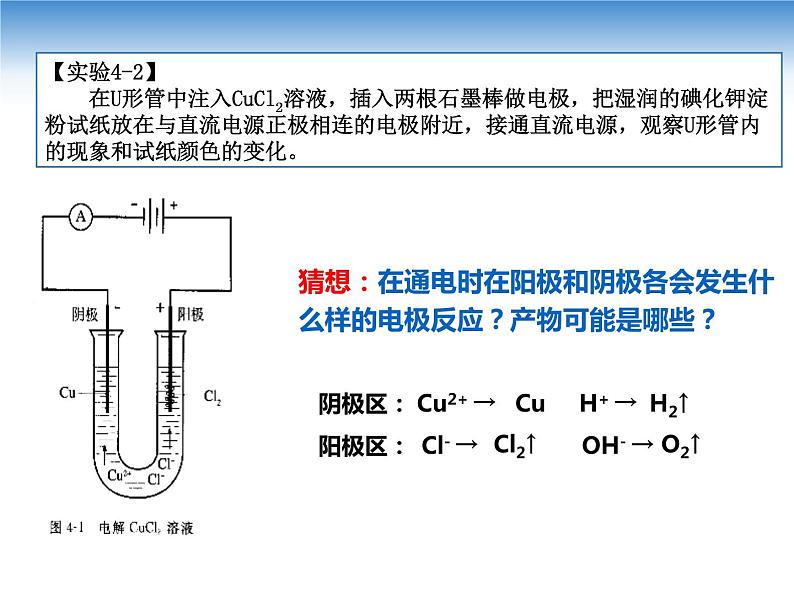
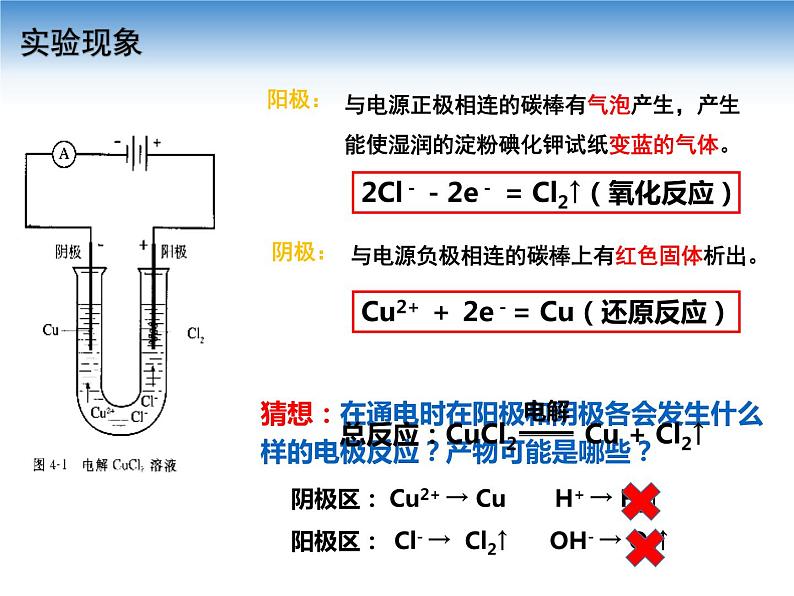
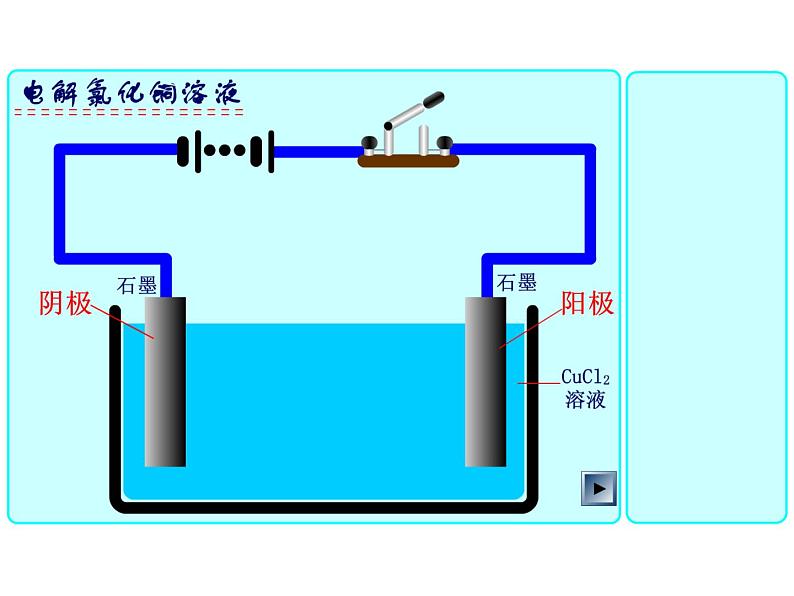
展开【实验4-2】 在U形管中注入CuCl2溶液,插入两根石墨棒做电极,把湿润的碘化钾淀粉试纸放在与直流电源正极相连的电极附近,接通直流电源,观察U形管内的现象和试纸颜色的变化。
思考:氯化铜溶液中含有哪些微粒?
阳离子: 阴离子:
向氯化铜溶液中通入直流电
Cu2+ 、H+ Cl- 、OH-
Cl- → OH- →
Cu2+ → H+ →
猜想:在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
Cl2↑ O2↑
Cu H2↑
与电源正极相连的碳棒有气泡产生,产生能使湿润的淀粉碘化钾试纸变蓝的气体。
与电源负极相连的碳棒上有红色固体析出。
2Cl--2e- = Cl2↑(氧化反应)
Cu2+ + 2e-= Cu(还原反应)
2.电解:电流通过电解质溶液(或熔融电解质)而在阴极、阳极引起氧化还原反应的过程。
3.电解池:将电能转化为化学能的装置。
1.放电:阴、阳离子到达电极,就失去或获得电子,发生氧化还原反应的过程。
阴极: 与电源 相连
阳极: 与电源 相连
③电解质溶液或熔融电解质
4.构成电解池的条件:
负极 (还原反应)
正极 (氧化反应)
电子从负极流向 , 再从 流回正极。
注意:电子不能在溶液中移动
阴极 经溶液离子导电, 阳极
阳离子→ 极移动阴离子→ 极移动
思考与交流: 阴极为什么是Cu2+最终放电,而不是H+ ,你的理由是什么?阳极呢?(从离子得、失电子的能力分析)
Cu2+ 氧化性比H+ 强,更容易得电子;Cl- 还原性比OH- 强,更容易失电子;
阳离子:Ag+>Hg2+>Fe3+>Cu2+>H+(酸中)Pb2+>Sn2+>Fe2+>Zn2+>H+(水中)Al3+>Mg2+>Na+>K+阴离子:S2->I->Br->Cl- >OH->含氧酸根 >F-
金属电极做阳极,金属本身被氧化(金、铂除外),溶液中的阴离子不放电。阴极电极不参与反应。
7.离子放电顺序(阴阳极全为惰性电极)
阳离子向阴极移动阴离子向阳极移动
电子从负极流向阴极,经溶液离子导电,再从阳极流回正极
高中化学人教版 (2019)选择性必修1第二节 电解池公开课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池公开课课件ppt,共14页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池课文内容ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池课文内容ppt课件,共40页。PPT课件主要包含了Cl-,OH-,Cl2,电解饱和食盐水,现象阳极阴极,第一个问题,混合遇火或遇强光爆炸,淡盐水,NaOH溶液,精制饱和NaCl溶液等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池课文内容课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池课文内容课件ppt,共16页。PPT课件主要包含了第二节电解池,电解和电解池,电解池的构成,④形成闭合回路,①外加直流电源,判断阳极方法,放电顺序,电解电解质型,通入HCl,溶液pH变化等内容,欢迎下载使用。













