


高中化学人教版 (2019)选择性必修1第二节 电解池课堂教学ppt课件
展开学习目标1. 会描述电解池的工作原理,能正确书写电解池的电极反应式和总反应方程式。2. 熟悉电解规律和电解产物的判断方法。
1. 电解质是指在_____________________能够导电的化合物。2. 电离是指电解质在_____________或__________状态下离解成____________________的过程。3. 原电池是_________________ 的装置 。4. 构成原电池的条件是
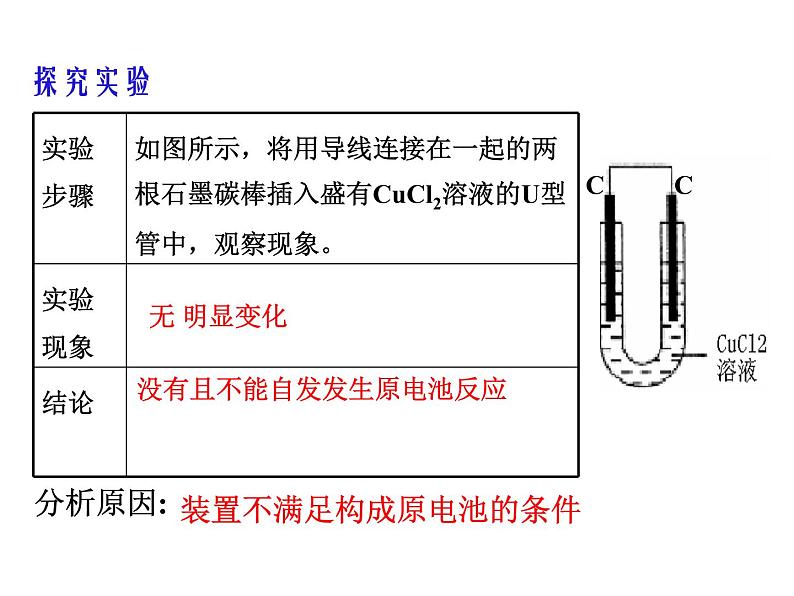
两个电极、电解质溶液、形成闭合回路、自发发生氧化还原反应
没有且不能自发发生原电池反应
装置不满足构成原电池的条件
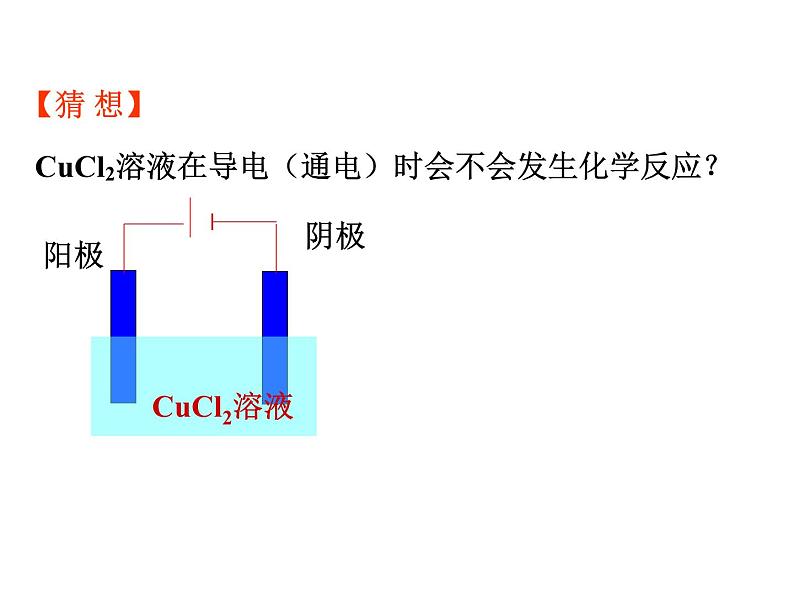
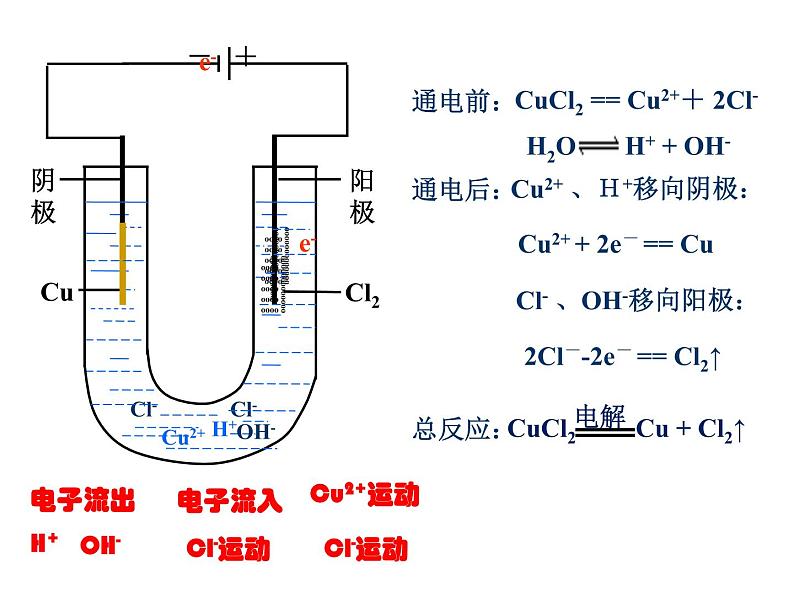
CuCl2溶液在导电(通电)时会不会发生化学反应?
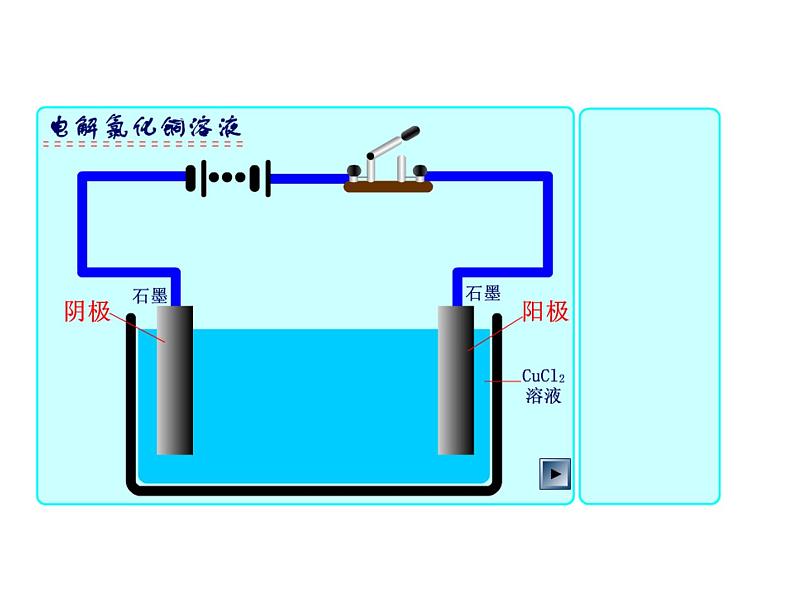
向氯化铜溶液中通入直流电
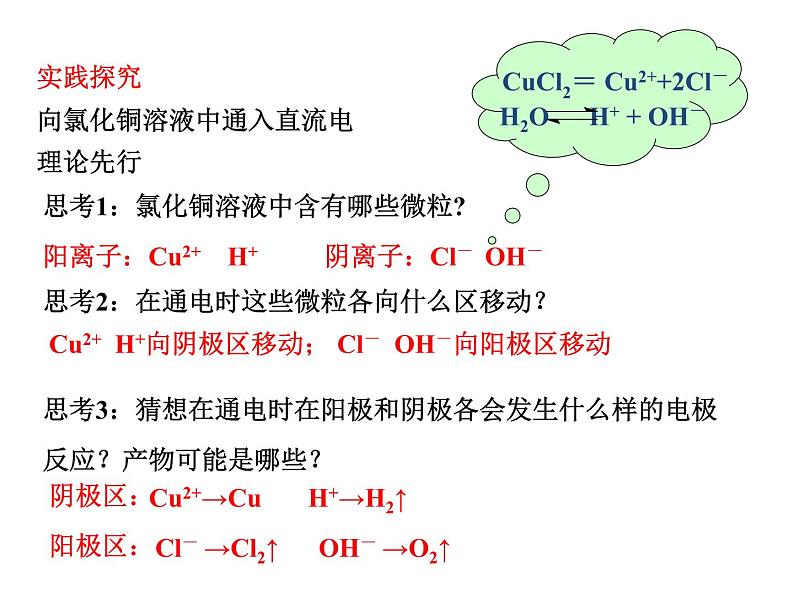
思考1:氯化铜溶液中含有哪些微粒?思考2:在通电时这些微粒各向什么区移动?思考3:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
阳离子:Cu2+ H+ 阴离子:Cl- OH-
Cu2+ H+向阴极区移动; Cl- OH-向阳极区移动
Cl- →Cl2↑ OH- →O2↑
H2O H+ + OH-
CuCl2= Cu2++2Cl-
Cu2+→Cu H+→H2↑
CuCl2 == Cu2++ 2Cl-
Cu2+ 、H+移向阴极:
2Cl--2e- == Cl2↑
Cu2+ + 2e- == Cu
Cl- 、OH-移向阳极:
Cu2+ + 2e- == Cu
2Cl- - 2e- == Cl2↑
构成电解池的条件是什么?
(1) 外接直流电源;
(3) 有电解质溶液或熔融态的电解质;
(4) 形成闭合回路。
使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的过程,叫做电解。
3.构成电解池的条件:
②电解质溶液或熔融电解质;
电能转变为化学能的装置。
② 阴离子移向该极,失电子,发生氧化反应。
① 与电源负极相连,电子流入;
② 阳离子移向该极,得电子,发生还原反应。
2Cl– – 2e– == Cl2↑
Cu2+ + 2e– == Cu
电子的流向: 电子从外加电源的负极流出,流到电解池的阴极,再从阳极流回电源正极。(注:电子只在外电路定向移动,不能从溶液中移动)
离子定向移动的方向:阳离子向 阴极移动, 阴离子向 阳极移动。
与电源正极连 +电源-与电源负极连氧化反应 还原反应2Cl- -2e-==Cl2 ↑ 阳极 惰性电极 阴极 Cu2++2e- ==Cu 阴离子移向 CuCl2溶液 阳离子移向
与外电源正极相连的电极,出电子,氧化反应。
与外电源负极相连的电极,进电子,还原反应。
C、Pt、Au 、Ti等,不论做阴极、阳极,本身都不反应。
Fe、Cu、Ag等,做阴极一般本身不反应;做阳极,本身被氧化溶解。
说明:得失电子的能力不同
4.电解池电极反应规律
(1)阴极:得电子,还原反应 ①(一般)电极本身不参加反应 ②一定是电解质溶液中阳离子“争”得电子
(2)阳极:失电子,氧化反应 ①若为金属(非惰性)电极,电极失电子 ②若为惰性电极,电解质溶液中阴离子“争”失电子
①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不容易在电极上放电。②用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由难到易)是:
S 2->SO32->I- >Br- >Cl- >OH- >NO3 ->SO42-(等含氧酸根离子)>F-
Ag+>Fe3+>Cu2+>H+(酸的溶液)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水提供)> Al3+>Mg2+>Na+>Ca+>K+注:电镀时通过控制条件, Fe2+和Zn2+得电子的能力强于H+
无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子在阴极上放电顺序是:
只在熔融状态下放电,在水溶液中永远不放电。
实验:用惰性(石墨)电极电解熔融的氯化钠
现象:阳极:有气泡,有刺激性气味,并能使 湿润的KI-淀粉试纸变蓝(Cl2)
电解过程不仅可以在电解质溶液中进行,也可以在熔融电解质中进行。
通电前:分析熔融电解质中的离子情况 阳离子:Na+ 阴离子:Cl- 做无规则运动
通电后:(必须直流电) (1)确定电极名称: 阳极(接电源正极) 阴极(接电源负极) 与电极材料无关
(2)判断电极产物并书写电极反应: 阳离子移向阴极放电,阴离子移向阳极放电阳极:2Cl- →Cl2↑ + 2e- 氧化反应阴极:2Na+ +2e- →2Na 还原反应 总式:
比较离子的放电能力,然后根据阴极还原、阳极氧化得出电极产物
【电解原理的学习方法】
1.分电极与电源正极相连的为阳极,与电源负极相连的为阴极。
2.析溶液分析溶液中存在的所有离子(水溶液中包括水的电离)、并分成阳离子组和阴离子组。
3.判流向阴离子定向移向阳极;阳离子定向移向阴极。
⑴用惰性电极电解电解质水溶液时,根据放电规律,阳离子在阴极发生还原反应,而阴离子在阳极发生氧化反应;
⑵若用金铂钛以外的金属作电极时:若为阴极,则金属不参加电极反应;若为阳极则首先是点击材料失电子,电极被溶解,溶液中的阴离子不能失电子。
5.先写电极式正确书写电极式,要注意得失电子守恒和离子来自何种电解质。
6.在写方程式将阴阳两极的电极反应式合并即可得总方程式,要注意条件,并用分子式表示弱电解质。
OH- SO42-
写出用石墨做电极电解CuSO4溶液的电极反应式及总的电解方程式。
③最后使得失数相等,两极半反应相加得总方程式;
4OH- -4e- ==O2↑+2H2O
2Cu2++4e- ==2Cu
H+ Cu2+
H2O H++OH-
CuSO4 == Cu2++ SO42-
①首先分析、比较出阴阳极的放电离子:
②然后写电极反应式 :
2Cu+O2↑+4H+
或2CuSO4+2H2O
2Cu+O2↑+2H2SO4
阳极:4OH-- 4e-== O2 ↑+ 2H2O阴极:4H+ + 4e- == 2H2↑
阳极:2Cl- - 2e- == Cl2↑阴极:2H+ + 2e- == H2↑
阳极: 2Cl- - 2e- == Cl2↑阴极:Cu2+ + 2e- == Cu
阳极: 2Cl- - 2e- == Cl2↑阴极:2H+ + 2e- == H2↑
阳极: 2Cu2++ 4e- == 2Cu阴极: 4OH-- 4e- == O2↑+2H2O
电解池与原电池有哪些异同
①两电极接直流电源②电解质溶液③形成闭合回路
①活泼性不同的两电极②电解质溶液③形成闭合回路
将电能转变成化学能的装置
将化学能转变成电能的装置
电解池与原电池有哪些异同(续)
电源负极→电解池阴极电解池阳极→电源正极
阳极:氧化反应,溶液中的阴离子失电子或电极金属失电子阴极:还原反应,溶液中的阳离子得电子
负极:氧化反应,金属失电子正极:还原反应,溶液中的阳离子得电子
阳极:与电源正极相连阴极:与电源负极相连
负极:较活泼金属正极:较不活泼金属(或能导电的非金属)
某同学在做电解水的实验时发现两极产生气泡的速率特别缓慢,(水是一种极弱的电解质,导电能力很差)你能否在不改变两电极产物的情况下,加入某种物质使其加快电解速率?
1. 下列关于电解池工作原理的说法中,错误的是 ( )A.电解池是一种将电能转变成化学能的装置B.电解池中发生的反应是非自发的氧化还原反应C.电解池工作时,阳极发生氧化反应,阴极发生还原反应D.电解池放电时,电极本身不会参加电极反应
2.用石墨作电极,电解下列物质的溶液,其实质不是电解水的是 ( )A.NaNO3 B.NaOH C.Na2SO4 D.NaCl
3. 如图所示,在U形管中装入滴有紫色石蕊溶液且混合均匀的某溶液,通直流电,一段时间后U形管内会形成一个倒立的“彩虹”,则U形管内的溶液可能为( )A.H2SO4溶液 B.NaOH溶液C.AgNO3溶液 D.Na2SO4溶液
4. 关于电解NaCl水溶液,下列叙述正确的是( )A.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色C.电解时在阳极得到氯气,在阴极得到金属钠D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
化学第二节 电解池图文ppt课件: 这是一份化学第二节 电解池图文ppt课件,共39页。PPT课件主要包含了拓展延伸,特别提醒等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池公开课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池公开课课件ppt,共14页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 电解池习题ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 电解池习题ppt课件,文件包含电解池第二课时-课件pptx、电解池第一课时-课件pptx、电解池第三课时-课件pptx、电解池第一课时-练习题docx、电解池第三课时-练习题docx、电解池第二课时-练习题docx等6份课件配套教学资源,其中PPT共126页, 欢迎下载使用。













