





高中化学人教版 (2019)选择性必修1第一节 电离平衡教课课件ppt
展开
这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡教课课件ppt,共36页。PPT课件主要包含了电离平衡常数,77×10-5,80×10-5,75×10-5,电离平衡常数的应用,下降得快,下降得慢,pHa+n7,课堂练习等内容,欢迎下载使用。
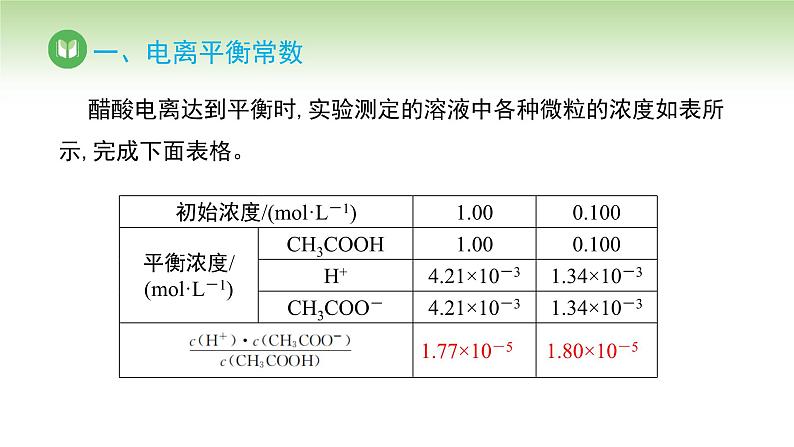
醋酸电离达到平衡时,实验测定的溶液中各种微粒的浓度如表所示,完成下面表格。
与其他化学平衡类似,在一定条件下,当弱电解质的电离达到平衡时,溶液里各组分的浓度之间存在一定的关系。对一元弱酸或一元弱碱来说,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数。通常用Ka、Kb分别表示弱酸、弱碱的电离平衡常数。
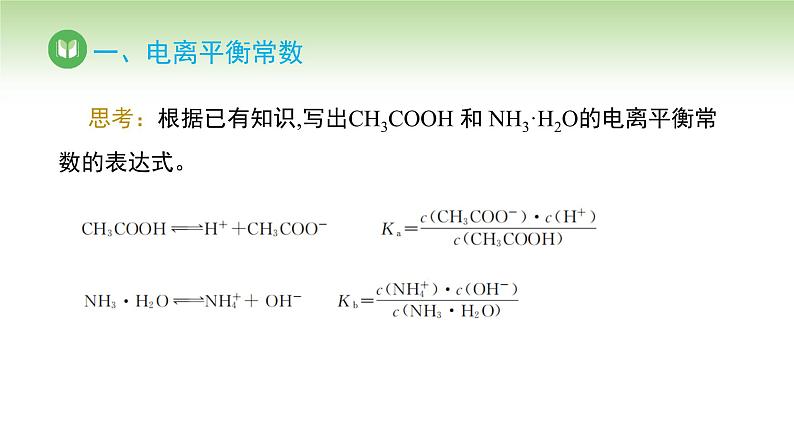
思考:根据已有知识,写出CH3COOH 和 NH3·H2O的电离平衡常数的表达式。
多元弱酸在水中的电离是分步进行的,各步电离常数依次用Ka1 、Ka2 等表示,例如 H2CO3 的电离平衡常数的表达式:
特别提醒(1)多元弱酸的各步电离常数的大小:Ka1>Ka2>Ka3>……(2)当Ka1≫Ka2时,计算多元弱酸中的c(H+ ),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。(3)多元弱碱的情况与多元弱酸类似,多元弱碱的电离比较复杂,高中阶段一般不讨论多元弱碱的电离常数Kb1、Kb2等。
思考:根据下面信息分析K 与弱电解质的电离程度的关系及影响K 的因素。(1)(2)水的电离平衡常数:K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。
(1)K 越大,弱电解质的电离程度越大,酸性越强。(2)K 首先由弱电解质的性质所决定;温度越高,K 越大。
影响电离常数的因素(1)内因:弱电解质本身的性质(主要因素)。相同条件下,弱酸(或弱碱)的酸性(或碱性)越强,电离常数越大。(2)外因:温度(次要因素)。电离为吸热过程,升高温度,电离常数增大。
电离平衡常数的意义电离平衡常数表示弱电解质的电离能力。不同弱电解质具有不同的电离常数,K 值越小,表明弱电解质越难电离,所以电离常数是表征弱电解质相对强弱的特征值,可以用于比较常见弱酸(或弱碱)在相同条件下的酸性(或碱性)强弱。
小试牛刀 正误判断。(1)改变条件,电离平衡正向移动,电离平衡常数一定增大。 ( )(2)同一弱电解质,浓度大的电离平衡常数大。 ( )(3)H2CO3 的电离常数表达式为 。 ( )
小试牛刀 2.已知T ℃时,CH3COOH 的Ka=1.75×10-5。(1)当向醋酸中加入一定量的盐酸时,CH3COOH 的电离常数________ (填“变大”“变小”或“不变”),理由是____________________。(2)T ℃时,将该溶液加水稀释10倍,则CH3COOH 的Ka=____________。
电离常数只与温度有关
二、电离常数的计算和应用
电离常数的计算———三段式法例:25℃时,a ml·L-1的CH3COOH 溶液
特别提醒:弱电解质的电离程度比较小,平衡时弱电解质浓度为(a−x)ml·L-1,一般近似为a ml·L-1。
观看视频“醋酸和碳酸钠的反应”,推测 CH3COOH 的 Ka 和 H2CO3 的 Ka1的大小。
醋酸能与碳酸钠反应,放出气体,说明醋酸的酸性强于碳酸,CH3COOH 的 Ka大于 H2CO3 的Ka1 。
(1)比较酸性(或碱性)的相对强弱相同温度下,等浓度弱酸(或弱碱)的电离常数越大,其酸性(或碱性)越强;同样,相同条件下,弱酸(或弱碱)的酸性(或碱性)越强,其电离常数越大。例如,25 ℃时,Ka(HClO)=4.0×10-8,Ka(HNO2)=5.6×10-4,则酸性:HNO2>HClO。
(3)比较酸根离子结合质子(H+ )的能力和弱碱阳离子结合 OH- 的能力相同条件下,酸性越弱,对应酸根离子结合质子(H+ )的能力越强;同样,相同条件下,碱性越弱,对应弱碱阳离子结合 OH- 的能力越强。例如,相同温度下,电离平衡常数大小为HNO2>CH3COOH>HCN,则酸根离子结合质子(H+ )的能力为CN- >CH3COO- >NO2- 。
小试牛刀 1.如何从定量的角度判断向醋酸溶液中加水稀释一倍后,电离平衡移动的方向?
小试牛刀 2.已知 25℃ 时,下列四种弱酸的电离常数:(1)试比较相同浓度的CH3COOH、HNO2、HCN、H2CO3 溶液的酸性强弱。
K 越大,酸性越强,故酸性:HNO2>CH3COOH>H2CO3>HCN。
小试牛刀 2.已知 25℃ 时,下列四种弱酸的电离常数:(2)向 HNO2 溶液中加入一定量的盐酸时,HNO2 的电离平衡向哪个方向移动? 此时HNO2 的电离常数是否发生变化? 为什么?
HNO2 溶液中存在电离平衡:HNO2 H+ +NO2- ,加入盐酸,c(H+ )增大,该平衡向逆反应方向移动;此时 HNO2 的电离常数不变;原因是电离常数只与温度有关,溶液温度不变,电离常数不变。
小试牛刀 3.在某温度时,溶质的物质的量浓度为 0.20 ml/L的醋酸溶液中,达到电离平衡时,已电离的CH3COOH 为1.7×10-3 ml/L,则该温度下CH3COOH 的电离常数Ka为 ( )A.1.7×10-6 B.1.0×10-14 C.2.9×10-5 ×10-5
三、一元强酸与一元弱酸的比较
提问:向两个锥形瓶中各加入 0.05 g 镁条,塞紧橡胶塞,然后用注射器分别注入 2 mL 2 ml/L 盐酸、2 mL 2 ml/L 醋酸,测得锥形瓶内气体的压强随时间变化如图所示。思考下列问题:(1)两个反应的反应速率及其变化有什么特点?
反应初期和反应过程中v(盐酸)比v(醋酸)大;反应过程中v(盐酸)减小的明显。
提问:向两个锥形瓶中各加入 0.05 g 镁条,塞紧橡胶塞,然后用注射器分别注入 2 mL 2 ml/L 盐酸、2 mL 2 ml/L 醋酸,测得锥形瓶内气体的压强随时间变化如图所示。思考下列问题:(2)反应结束时,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论?
与镁条反应的盐酸和醋酸中 H+ 的物质的量几乎相同,因而产生的 H2 的量几乎相同。
镁条与等浓度、等体积的盐酸、醋酸的反应的分析
一元强酸和一元弱酸的比较(1)同体积、同物质的量浓度的一元强酸与一元弱酸的比较(不考虑氧化性酸)
物质的量浓度相同、体积相同时,一元强酸和一元弱酸溶液中和碱的能力相同,都是二元强酸中和碱能力的一半。
一元强酸和一元弱酸的比较(2)同体积、同pH 的一元强酸与一元弱酸的比较(设pH=a)
a
相关课件
这是一份人教版 (2019)选择性必修1第一节 电离平衡多媒体教学ppt课件,共60页。PPT课件主要包含了电离平衡常数,离子浓度的乘积,未电离分子的浓度,弱电解质的,第一步电离,正误判断,思考交流,电离平衡常数的应用,相对强弱,H2O等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡集体备课课件ppt,共48页。PPT课件主要包含了各种离子浓度的乘积,未电离,分子的浓度,电离程度,2×10-7,不明显,正向移动,电离补充,消耗完全,都变为0等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡说课ppt课件,共51页。PPT课件主要包含了电离平衡常数,各种离子浓度的乘积,未电离分子的浓度,电离常数只与温度,75×10-5,电离程度,强酸与弱酸的比较,随堂演练·知识落实等内容,欢迎下载使用。










