人教版 (2019)选择性必修1第一节 电离平衡教案
展开
这是一份人教版 (2019)选择性必修1第一节 电离平衡教案,共4页。教案主要包含了知识回顾,新课引入,课堂练习,思考讨论1,思考讨论2,演示实验,思考讨论3,课堂小结等内容,欢迎下载使用。
课程基本信息
学科
化学
年级
高二
学期
秋季
课题
电离平衡
教科书
书 名:《化学选择性必修1:化学反应原理》
教学目标
1.关注水溶液体系的特点,结合实验现象、数据等证据素材,初步形成弱电解质存在电离平衡的基本概念。
2.会分析外界条件改变对电离平衡的影响,构建电离常数模型。
3.了解电离平衡常数的意义及影响因素;能正确书写电离平衡常数表达式。
4.能进行电离常数及氢离子浓度的简单计算;能用符号表征多元弱酸的电离平衡。
教学内容
教学重点:
弱电解质的电离平衡及影响因素;电离常数表达式及意义;电离平衡常数的有关计算。
教学难点:
弱电解质的电离平衡的影响因素。
教学过程
【知识回顾】强电解质和弱电解质概念
【新课引入】在一定温度下,向一杯水中加入一定量的冰醋酸,溶液中发生哪些变化?画出V~t图。建立弱电解质的电离平衡概念。
一. 弱电解质的电离平衡
1.定义:在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合生成分子的速率相等时,电离过程就达到了电离平衡状态。
2.电离平衡的特征
(1)逆:弱电解质的电离是可逆过程
(2)等:V电离 = V结合≠0
(3)动:电离平衡是一种动态平衡
(4)定:平衡时分子、离子的浓度不再变化
(5)变:条件改变时,电离平衡发生移动 (平衡移动规律—勒夏特列原理)
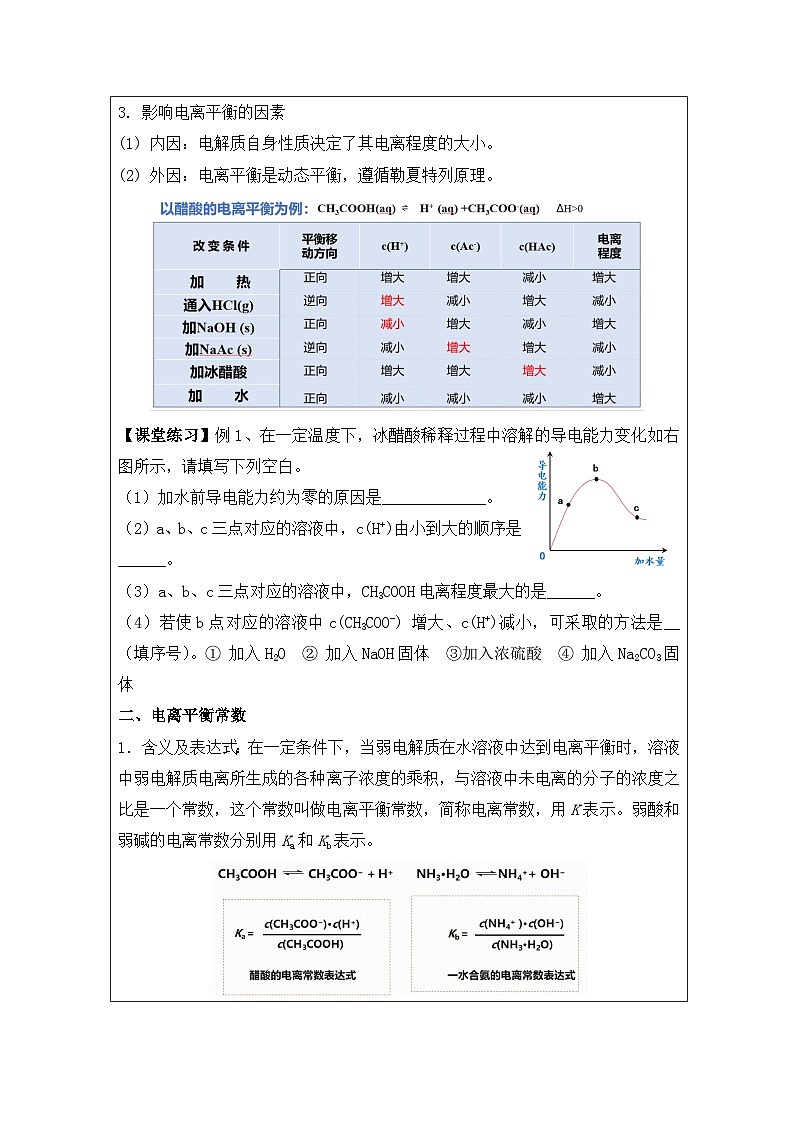
3. 影响电离平衡的因素
(1) 内因:电解质自身性质决定了其电离程度的大小。
(2) 外因:电离平衡是动态平衡,遵循勒夏特列原理。
【课堂练习】例1、在一定温度下,冰醋酸稀释过程中溶解的导电能力变化如右图所示,请填写下列空白。
(1)加水前导电能力约为零的原因是_____________。
(2)a、b、c三点对应的溶液中,c(H+)由小到大的顺序是______。
(3)a、b、c三点对应的溶液中,CH3COOH电离程度最大的是______。
(4)若使b点对应的溶液中c(CH3COO-) 增大、c(H+)减小,可采取的方法是__(填序号)。① 加入H2O ② 加入NaOH固体 ③加入浓硫酸 ④ 加入Na2CO3固体
二、电离平衡常数
1.含义及表达式:在一定条件下,当弱电解质在水溶液中达到电离平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离的分子的浓度之比是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K表示。弱酸和弱碱的电离常数分别用Ka和Kb表示。
【思考讨论1】观察下列几组表格数据,分析总结影响电离常数大小的因素
【结论】
① 相同温度下,弱电解质的种类不同,K值不同。Ka越大,酸性越强。
② 温度越高,同一弱电解质的Ka(或Kb)越大。
③ Ka只与温度有关,与浓度无关。
【思考讨论2】以碳酸为例,分析为什么多元弱酸一级电离常数最大,一般有Ka1≫Ka2≫Ka3……
答:H2CO3的一级电离,是从中性的H2CO3分子中电离出一个带正电的氢离子;H2CO3的二级电离,是从带负电的HCO3-中电离出一个带正电的氢离子;所以Ka1≫Ka2
2、重要规律:
(1)电离常数的大小由物质本身的性质决定,同一温度下,不同弱电解质的电离常数不同,K值越大,电离程度越大。对应弱电解质越易电离,相应的酸(或碱)性越强。
(2)同一弱电解质在同一温度下改变浓度时,其电离常数不变。
(3)电离常数K只随温度的变化而变化,升高温度,K值增大。
(4)多元弱酸电离常数:K1≫K2≫K3,其酸性主要由第一步电离决定,K值越大,相应酸的酸性越强。计算多元弱酸中的c(H+),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。多元弱碱的情况与多元弱酸相似。
【演示实验】实验3-2向盛有2 mL 1 ml·L-1醋酸的试管中滴加1 ml·L-1 Na2CO3溶液。观察现象。你能否由此推测CH3COOH的Ka和H2CO3的Ka1的大小?
分析:有无色气体产生,反应生成了CO2。
说明醋酸的酸性强于碳酸,即CH3COOH的Ka大于H2CO3的Ka1。
【思考讨论3】例2.向两个锥形瓶中各加入0.05g镁条,塞紧橡胶塞,然后用注射器分别注入2 mL 2 ml/L 盐酸、2 mL 2 ml/L醋酸,测得锥形瓶内的压强随时间的变化如图所示。请回答下列问题:
(1)两个反应的速率及其变化有什么特点?
(2)反应结束时,两个锥形瓶内气体的压强基本相等,由此你能得出什么结论?
3、电离平衡常数的计算(以弱酸HX为例)
【课堂练习】
例3、在某温度时,溶质的物质的量浓度为0.1 ml·L−1的醋酸中,达到电离平衡时,pH值约为3,试计算该温度下CH3COOH的电离常数Ka。
例4、在某温度时,溶质的物质的量浓度为0.2 ml·L−1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10−3 ml·L−1,试计算该温度下NH3·H2O的电离常数Kb。
例5、进一步计算该温度下,发生了电离的NH3·H2O占总NH3·H2O的多少?
【课堂小结】
相关教案
这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡教案设计,共4页。
这是一份2020-2021学年第一节 电离平衡教案,共5页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡教学设计,共3页。教案主要包含了导入新课,新课讲授等内容,欢迎下载使用。










