

人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH课后复习题
展开一、单选题
1.下列措施能使水的电离平衡正向移动的是( )
A.加入B.通入
C.加入D.降低温度
2.测定溶液中乙二醛(含少量硝酸)含量的方法如下。
i.取V mL待测溶液于锥形瓶中,加入2滴酚酞溶液,用浓度为NaOH溶液滴定至溶液恰好由无色变为粉红色,中和硝酸。
ii.向i所得溶液加入过量NaOH溶液mL,充分反应,使乙二醛反应生成。
iii.用硫酸滴定ii中溶液至终点,消耗硫酸体积为 mL。
下列说法不正确的是( )
A.根据结构分析,:
B.乙二醛反应生成属于氧化还原反应
C.待测溶液中乙二醛浓度为
D.若不进行步骤i,测得溶液中乙二醛浓度偏低
3.NaOH溶液滴定20.00mL溶液时,、各含磷元素微粒的和pH的关系如图。下列说法错误的是( )
A.的
B.水的电离程度:d>c>b>a
C.③为的与pH的关系
D.c点时,溶液中存在
4.下列说法错误的是( )
A.的溶液也可能是中性溶液
B.常温下将的硝酸加水稀释至,此时溶液的
C.在常温下,由水电离出的时,此溶液的或13
D.的盐酸和次氯酸各取并分别稀释至,所得盐酸的更大
5.实验室提供的玻璃仪器有试管、烧杯、锥形瓶、普通漏斗、胶头滴管、酒精灯、玻璃棒、表面皿等,选用上述仪器(非玻璃仪器任选)能完成的实验是( )
A.中和热的测定B.粗盐提纯C.中和滴定D.海带提碘
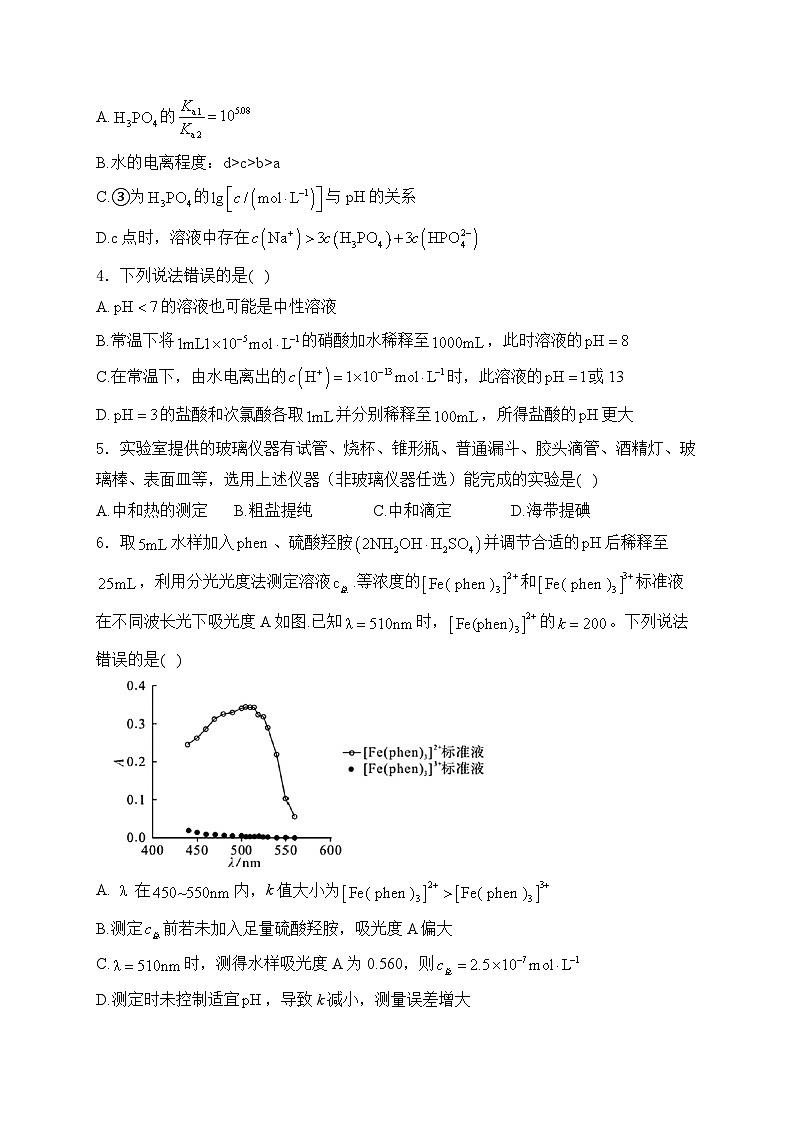
6.取水样加入、硫酸羟胺并调节合适的后稀释至,利用分光光度法测定溶液.等浓度的和标准液在不同波长光下吸光度A如图.已知时,的。下列说法错误的是( )
A.在内,k值大小为
B.测定前若未加入足量硫酸羟胺,吸光度A偏大
C.时,测得水样吸光度A为0.560,则
D.测定时未控制适宜,导致k减小,测量误差增大
7.常温下,向溶液中滴加的氨水,溶液的pH随氨水体积变化的曲线如图所示。下列说法不正确的是( )
A.HA的电离方程式为
B.B点时加入的氨水和HA恰好完全反应
C.A点所示溶液中:
D.C点所示溶液中:
8.下列有关实验装置、操作的描述中正确的是( )
A.AB.BC.CD.D
9.下列各组离子在指定条件下能大量共存的是( )
A.滴加酚酞试液显红色的溶液中:、
B.能与铝反应生成氢气的溶液中:、
C.滴加KSCN溶液显红色的溶液中:
D.常温下,由水电离出的的溶液中:
10.常温下四种溶液的pH如表,下列有关叙述不正确的是( )
A.③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.①与④混合,若混合后溶液pH=7,则
C.②和③两溶液等体积混合,所得溶液中
D.分别加水稀释10倍,四种溶液的pH:①>②>④>③
二、填空题
11.过碳酸钠是一种新型高效、环保的固体漂白杀菌剂,易溶于水,微溶于异丙醇,在高温、高湿或存在重金属离子和其他杂质污染时,容易发生分解反应,导致活性氧含量(即杀菌消毒时产生的氧气质量占过碳酸钠的质量分数)降低。某小组利用氧化还原滴定原理测定过碳酸钠的活性氧含量。
实验步骤:称取0.1 g试样放置于250 mL锥形瓶中,加入60 mL水使之溶解,再加入15mL硫酸,用标准溶液滴定,重复该操作4次,达到滴定终点时消耗标准溶液的体积分别为20.20 mL、。
(1)滴定时,高锰酸钾标准溶液盛装在_________(填“酸式”或“碱式”)滴定管,原因是_________。
(2)实验到达滴定终点的现象是_________。
(3)根据实验数据,计算该试样中活性氧含量为_________。
(4)下列操作将导致计算的活性氧含量偏高的是_________(填序号)。
A.到达滴定终点,仰视滴定管读数
B.滴定结束后,滴定管尖嘴处悬挂一滴液体
C.滴定前滴定管中没有气泡,滴定后有气泡
D.在滴定时摇晃锥形瓶过于剧烈,有少量溶液溅出
12.国家标准规定,酿造的食醋中醋酸的含量不得低于3.5 g/100mL。选择酚酞作指示剂,用标准NaOH溶液测定白醋中醋酸(假设白醋中的酸均为醋酸)的浓度,以检测白醋是否符合国家标准。测定过程如图所示:
(1)①滴定达到终点时的现象是滴入半滴标准NaOH溶液后,__________________。
②某次实验滴定开始和结束时,碱式滴定管中的液面如图甲所示,则消耗NaOH溶液的体积为________mL。
③已知实验所用标准NaOH溶液的浓度为,根据上述滴定结果可知该白醋________(填“符合”或“不符合”)国家标准。
(2)若用NaOH溶液分别滴定体积均为20.00 mL、浓度均为的盐酸和醋酸溶液,得到滴定过程中pH随加入NaOH溶液体积变化的两条滴定曲线如图乙所示。
①滴定醋酸溶液的曲线是_______(填“Ⅰ”或“Ⅱ”)。
②若25℃时,的醋酸溶液与的氢氧化钠溶液等体积混合显中性,则醋酸的电离常数为__________(用含a的代数式表示)。
13.硫代硫酸钠晶体(,)可用作定影剂、还原剂。回答下列问题:
(1)市售硫代硫酸钠中常含有硫酸根离子杂质,选用下列试剂设计实验方案检验并填写表中的空格。
试剂:稀盐酸、稀硫酸、溶液、溶液、溶液
写出加入过量稀盐酸的离子方程式:_____________________。
(2)利用标准溶液定量测定硫代硫酸钠的纯度,测定步骤如下。
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在_______中完全溶解,冷却至室温后,全部转移至100 mL____________中,加蒸馏水至____________。
②滴定:取的标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应,加入淀粉溶液作为指示剂,然后用硫代硫酸钠样品溶液滴定,发生反应,继续滴定,当最后半滴硫代硫酸钠样品溶液滴入,溶液________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为________%(保留1位小数)。
三、实验题
14.水合肼()是一种无色透明、具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为。回答下列问题:
实验一:制备NaClO溶液(实验装置如图所示)
(1)配制100mL10的NaOH溶液时,所需玻璃仪器除量筒外还有___________(填字母)。
A.玻璃棒
B.烧杯
C.烧瓶
D.干燥管
E.胶头滴管
(2)装置M的作用是___________。
实验二:制取水合肼(实验装置如图所示)
(3)①仪器A的名称为___________,冷凝管的水流方向为___________。
②反应过程中需控制反应温度,同时将A中溶液缓慢滴入三颈烧瓶中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学方程式:___________,A中盛装的溶液是___________(填字母)。
A.溶液
B.NaOH和NaClO溶液
③充分反应后,加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中水合肼含量
(4)称取馏分5.0g,加入适量固体,加水配成250mL溶液,取25.00mL该溶液置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.10的溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:)
①滴定时,碘的标准溶液盛放在_________(填“酸式”或“碱式”)滴定管中,本实验滴定终点的现象为。
②实验测得消耗溶液的平均值为18.00mL,馏分中水合肼()的质量分数为_________。
参考答案
1.答案:A
解析:A.向水中加入固体,盐电离产生的会与水电离产生的H结合形成弱酸,使水的电离平衡正向移动,A符合题意;B.通入,与水反应生成一水合氨,能电离出,抑制水的电离,B不符合题意;C.加入氯化钾,强酸强碱盐,对水的电离无影响,C不符合题意;D.水的电离是吸热过程,降低温度,水的电离平衡逆向移动,D不符合题意;故选A。
2.答案:D
解析:A.越小,酸性越强。氧元素电负性很大,中醇羟基的氧原子的作用可使羧基的O-H键极性增强,电离出变易。中甲基是推电子基团,可使羧基的O-H键极性减弱,电离出变难,因此: ,A正确;
B.醛基转化为羟基属于还原反应,醛基转化为羧基属于氧化反应,B正确;
C.根据步骤iii,与硫酸反应的NaOH物质的量为:,则与乙二醛反应的NaOH物质的量为:,根据步骤ii,乙二醛物质的也为,则待测液中乙二醛的浓度为,C正确;
D.如果不进行步骤i,在步骤ii时,除乙二醛消耗NaOH外,也消耗NaOH,会造成计算得出的与乙二醛反应的NaOH偏多,最后测得溶液中乙二醛浓度偏高,D错误;
故选D。
3.答案:D
解析:A.a点,,溶液中溶质为,即,;c点,,即,,,A正确;
B.a点的溶质为,水的电离被抑制,随着NaOH溶液的滴入,酸性减弱,生成可水解的盐,故水的电离逐渐增大,故水的电离程度:d>c>b>a,B正确;
C.由分析知,③为的与pH的关系,C正确;
D.溶液中存在电荷守恒,c点时,Na元素和P元素之间的关系为,则有,从图中信息可知,c点时,联立三个等式,有,此时溶液显碱性,则,D错误;
故选D。
4.答案:B
解析:的溶液也可能是中性溶液,如时为,的纯水,,,,呈中性,A项正确;酸溶液加水稀释不可能变成碱溶液,其不断接近于中性,故将的稀硝酸稀释至,所得溶液的,B项错误;常温下当水电离出的时,若溶液中,此溶液的,因水电离出的,若溶液中的,此溶液的,值为1,C项正确;的盐酸与次氯酸各取并分别稀释至,盐酸稀释100倍后,次氯酸是弱酸,稀释过程进一步电离出氢离子,所得次氯酸溶液的,D项正确。
5.答案:B
解析:A.中和热测定需要量取液体体积,需要用到的玻璃仪器有量筒,故A不符合题意;
B.粗盐的提纯需要用到的玻璃仪器为酒精灯、普通漏斗、玻璃棒,还需要用到瓷质的蒸发皿,则题给仪器可以完成粗盐的提纯的实验,故B符合题意;
C.中和滴定需要用到滴定管,C不符合题意;
D.海带提碘需要萃取,玻璃仪器需要用到分液漏斗,D不符合题意;
本题选B。
6.答案:B
解析:A.等浓度的和标准液在不同波长光下吸光度A,A=kc,,则k值大小为,A正确;B.硫酸羟胺具有还原性,能将还原为,若未加入足量硫酸羟胺,的浓度偏小,由图可知,吸光度A偏小,B错误;C.当时,测得水样吸光度A为0.560k=200,根据A=kc,则,C正确;D.测定时未控制适宜pH,pH较小时参与配位pH较大时生成沉淀,两种情况均会导致k减小,测量误差增大,D正确;故选B。
7.答案:B
解析:根据常温下溶液的,可知HA是强酸,所以HA完全电离,A正确;一水合氨是弱碱,若氨水和HA恰好完全反应,形成强酸弱碱盐,发生水解使溶液显酸性,题图中B点所示溶液,氨水过量,B错误;A点所示溶液中溶质成分为和HA,且二者物质的量之比为1:1,在此溶液中存在元素守恒:,C正确;C点所示溶液中溶质为和,且二者物质的量之比为1:1,根据溶液显碱性,可知电离程度大于水解程度,,D正确。
8.答案:A
解析:为了抑制的水解,需要在HCl氛围中加热,A正确;不能用pH试纸测量有漂白性的NaClO的,B错误;滴定管刻度从上往下增大,读数应该为11.80 mL,C错误;实验操作为碱式滴定管排气泡的操作,D错误。
9.答案:A
解析:滴加酚酞试液显红色的溶液中含有大量的,各离子间不反应,能够大量共存,A符合题意;能与铝反应生成氢气的溶液可能呈酸性也可能呈碱性,碱性溶液中的和生成沉淀而不能大量共存,酸性溶液中的发生氧化还原反应而不能大量共存,B不符合题意;滴加KSCN溶液显红色的溶液中含有大量的,和因发生氧化还原反应而不能大量共存,C不符合题意;常温下,由水电离出的的溶液可能是酸性溶液也可能是碱性溶液,碱性溶液中的和发生反应而不能大量共存,酸性溶液中的和可以发生反应而不能大量共存,D不符合题意。
10.答案:B
解析:醋酸溶液中存在电离平衡:,加入醋酸钠晶体后,溶液中增大,醋酸的电离平衡逆向移动,降低,pH增大;盐酸中加入适量的醋酸钠晶体,发生反应,降低,pH也增大,故A正确。是弱碱,HCl是强酸,弱碱部分电离,强酸完全电离,结合常温下,的氨水中,的盐酸中,可知题中氨水的浓度大于盐酸的浓度,若氨水和盐酸等体积混合,则氨水过量,溶液呈碱性,若混合后溶液,则混合时氨水体积小于盐酸体积,即,故B错误。的NaOH溶液中,的醋酸溶液中,NaOH是强碱,醋酸是弱酸,结合B项可知醋酸的浓度大于NaOH的浓度,醋酸溶液和NaOH溶液等体积混合时醋酸过量,溶液呈酸性,即,故C正确。强酸加水稀释10倍,下降为原来的十分之一,pH增大1,而弱酸加水稀释过程中会继续电离出,所以pH增大的值小于1,均为3的盐酸和醋酸溶液均加水稀释10倍,盐酸的,醋酸溶液的,同理,强碱加水稀释10倍,下降为原来的十分之一,pH减小1,而弱碱加水稀释过程中会继续电离出,所以pH减小的值小于1,pH均为11的氨水和NaOH溶液均加水稀释10倍,氨水的11>pH>10,NaOH溶液的pH=10,所以分别加水稀释10倍,四种溶液的pH:①>②>④>③,故D正确。
11.答案:(1)酸式;溶液具有氧化性,会腐蚀碱式滴定管的橡胶
(2)当滴入最后半滴标准溶液时,锥形瓶中的溶液由无色变为紫红色,且30s内不恢复原色
(3)8.08
(4)AB
解析:(1)高锰酸钾有氧化性,会腐蚀橡胶管,所以盛放在酸式滴定管中。
(2)高锰酸钾溶液为紫色溶液,因此实验达到滴定终点的现象是当滴入最后半滴标准溶液时,锥形瓶中的溶液由无色变为紫红色,且30s内不恢复原色。
(3)根据得失电子守恒、电荷守恒和原子守恒可知,反应的离子方程式为,依据题意可知消耗高锰酸钾溶液的平均体积为,其中21.45 mL误差大舍去,设产生的物质的量为,则有关系式:
求得。分解产生,反应的化学方程式为,则有关系式:
求得,氧气的质量为,由题意可知,活性氧含量为杀菌消毒时产生氧气的质量占过碳酸钠的质量分数,因此活性氧含量为。
(4)仰视读数会造成读出的标准液体积偏大,活性氧含量偏高,A符合题意;若滴定管尖嘴处悬挂一滴液体,会造成测量消耗标准液的体积偏大,活性氧含量偏高,B符合题意;若滴定前滴定管中没有气泡,滴定后有气泡,会造成读出的标准液体积偏小,活性氧含量偏低,C不符合题意;若在滴定时摇晃锥形瓶过于剧烈,有少量溶液溅出,会使消耗的标准液体积偏小,从而使得活性氧含量偏低,D不符合题意。
12.答案:(1)①溶液由无色变为浅红色,且半分钟内不恢复原色
②26.10
③符合109
(2)①Ⅰ
②
解析:(1)①滴入半滴标准NaOH溶液后,溶液由无色变为浅红色,且半分钟内不恢复原色,说明达到滴定终点。
②根据题图甲中所示滴定前后碱式滴定管液面可知,消耗标准NaOH溶液的体积为。
③实验所用标准NaOH溶液的浓度为,则稀释后溶液中醋酸浓度为,则白醋中醋酸浓度为,100 mL白醋中醋酸的质量为,故该白醋符合国家标准。
(2)①醋酸是弱酸,盐酸是强酸,相同浓度的盐酸和醋酸溶液,醋酸溶液的pH较大,则滴定醋酸溶液的曲线是Ⅰ。
②时,的醋酸溶液与的氢氧化钠溶液等体积混合,混合后溶液显中性,则,根据电荷守恒可得,,根据物料守恒可知,,则醋酸的电离常数。
13.答案:(1);产生白色沉淀;
(2)①烧杯容量瓶刻度线
②由蓝色变为无色且30s内不恢复原色;95.0
解析:(1)据分析可知,步骤③:静置,取上层清液滴入溶液,若实验现象为产生白色沉淀,则说明硫代硫酸钠中含有硫酸根离子。硫代硫酸钠加入过量稀盐酸生成氯化钠、硫单质、二氧化硫和水,离子方程式为
(2)①配制硫代硫酸钠溶液时,需要称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等操作,硫代硫酸钠具有还原性,还需防止其被氧化,故配制溶液时,称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中完全溶解,冷却至室温后,全部转移至100 mL容量瓶中,加蒸馏水至刻度线。
②淀粉遇碘单质呈蓝色,滴入硫代硫酸钠消耗碘单质,则当最后半滴溶液滴入,溶液由蓝色变为无色且30 s内不恢复原色,即为滴定终点。按题给离子方程式得到关系式:,则滴定中实际消耗的硫代硫酸钠为,则硫代硫酸钠溶液的浓度为,则样品纯度为。
14.答案:(1)ABE
(2)吸收逸散出的;导气、平衡压强
(3)分液漏斗;b进a出;[或];B
(4)酸式当加入最后半滴碘的标准液时,溶液出现蓝色且半分钟内不消失9%
解析:(1)配制100mL10的NaOH溶液时,所需玻璃仪器除量筒外,还有100mL容量瓶、玻璃棒、胶头滴管,故选ABE。答案为:ABE;
(2)装置M中装有碱石灰,且与锥形瓶和大气相连,其作用是吸收逸散出的;导气、平衡压强。答案为:吸收逸散出的;导气、平衡压强;
(3)①仪器A带有活塞,其名称为分液漏斗,冷凝管的水流方向为b进a出。
②因为NaClO受热后会发生分解,水合肼也会失水,所以反应过程中需控制反应温度;NaClO具有强氧化性,不仅能氧化尿素,还能氧化水合肼,所以需控制NaClO的用量,如果滴速过快则会导致产品产率降低,同时产生大量氮气,该过程的化学方程式:[或],则A中盛装的溶液是NaOH和NaClO溶液,故选B。答案为:分液漏斗;b进a出;[或];B;
(4)①因为碘单质会腐蚀橡胶,所以滴定时,碘的标准溶液盛放在酸式滴定管中;锥形瓶内的水合肼、的混合溶液呈无色,滴定终点时,稍过量的碘标准液使溶液呈蓝色(与淀粉作用),所以本实验滴定终点的现象为:当加入最后半滴碘的标准液时,溶液出现蓝色且半分钟内不消失。
②实验时,,依据反应,可得出,则250mL溶液中所含水合肼的物质的量为0.0009ml×=0.009ml,馏分中水合肼()的质量分数为==9%。答案为:酸式;当加入最后半滴碘的标准液时,溶液出现蓝色且半分钟内不消失;9%。
A制取无水
B测定NaClO溶液的pH
C记录滴定终点读数为12.20mL
D检查碱式滴定管是否漏液
序号
①
②
③
④
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
pH
11
11
3
3
实验步骤
现象
①取少量样品,加入除氧蒸馏水
固体完全溶解,得无色澄清溶液
②加入过量稀盐酸
出现乳黄色浑浊,有刺激性气体产生
③静置,取上层清液滴入_______溶液
____________
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH优秀第二课时课后测评: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002427_t7/?tag_id=28" target="_blank">第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH优秀第二课时课后测评</a>,共7页。试卷主要包含了室温下,将0等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH优秀第一课时当堂检测题: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002427_t7/?tag_id=28" target="_blank">第三章 水溶液中的离子反应与平衡第二节 水的电离和溶液的pH优秀第一课时当堂检测题</a>,共7页。试卷主要包含了25℃时,水的电离达到平衡,25℃时,在等体积的①0,下列溶液一定呈中性的是等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀第1课时同步达标检测题: 这是一份高中化学人教版 (2019)选择性必修1第二节 水的电离和溶液的pH优秀第1课时同步达标检测题,文件包含32水的电离和溶液的pH第1课时水的电离溶液的酸碱性与pH原卷版-高二化学同步素养目标精品讲义人教版选择性必修1docx、32水的电离和溶液的pH第1课时水的电离溶液的酸碱性与pH解析版-高二化学同步素养目标精品讲义人教版选择性必修1docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。













