




苏教版 (2019)选择性必修2第二单元 元素性质的递变规精品ppt课件
展开1.从微观层面理解原子的组成及结构,了解核外电子的排布规则,培养宏观辨识与微观探析的化学学科核心素养。2.能结合能量最低原理、泡利不相容原理和洪特规则书写和说明1~36号元素基态原子的核外电子排布式和轨道表示式,发展证据推理与模型认知的化学学科核心素养。
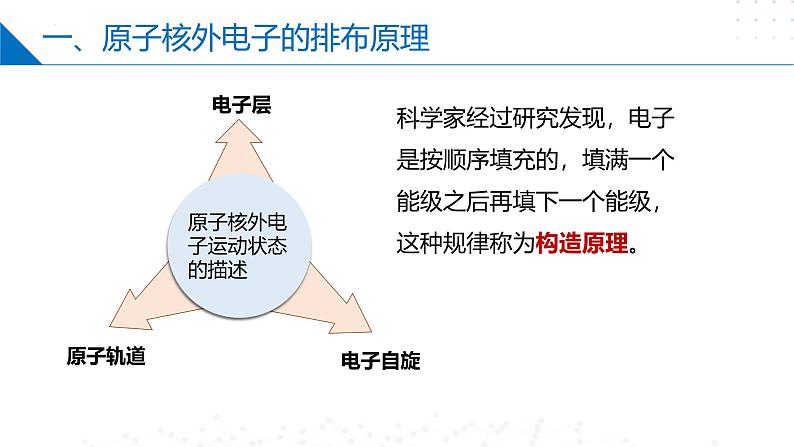
一、原子核外电子的排布原理
原子核外电子运动状态的描述
科学家经过研究发现,电子是按顺序填充的,填满一个能级之后再填下一个能级,这种规律称为构造原理。
原子核外电子的运动(也称原子核外电子的排布)遵循构造原理的三大内容
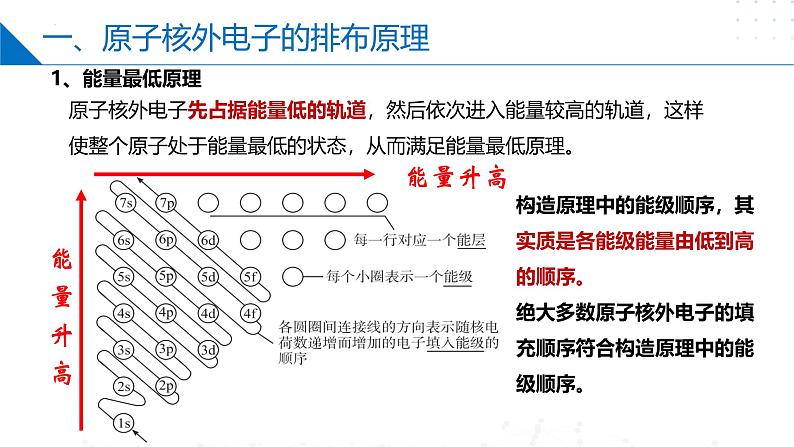
原子核外电子先占据能量低的轨道,然后依次进入能量较高的轨道,这样使整个原子处于能量最低的状态,从而满足能量最低原理。
构造原理中的能级顺序,其实质是各能级能量由低到高的顺序。绝大多数原子核外电子的填充顺序符合构造原理中的能级顺序。
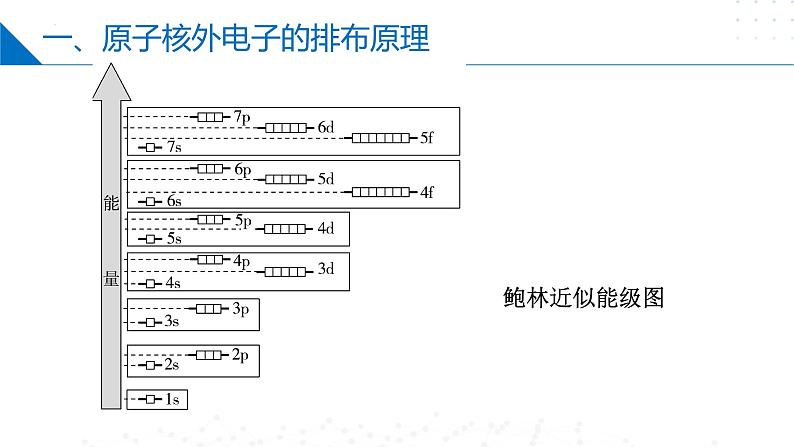
核 外 电 子 填 充 顺 序 图
1s---2s---2p---3s---3p--4s--3d—4p--5s--4d---5p---6s---4f---5d---6p---7s---5f—6d
电子所排的轨道顺序:1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
各轨道的能量高低顺序:ns<(n-2)f<(n-1)d
核外电子在能级中的排布顺序:
1s → 2s → 2p → 3s → 3p
电子首先填入能量最低的1s能级,直至将该能级填满。在1s、2s能级填满后,电子填入2p能级,直至2p能级填满……
根据核外电子在能层中的排布规律,画出K的原子结构示意图。分析K中电子填入的能量最高的能级,并说明判断的依据。
1s → 2s → 2p → 3s → 3p → 4s
是用核外电子分布的能级及各能级上的电子数来表示电子排布的式子。
例:基态原子电子排布式
1s22s22p2
“三步法”书写电子排布式
构造原理是书写基态原子电子排布式的依据。第一步:按照构造原理写出电子填入能级的顺序,1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s……第二步:根据各能级容纳的电子数填充电子。第三步:去掉空能级,并按照能层顺序排列即可得到电子排布式。
1s22s22p63s1
1s22s22p63s23p6
1s22s22p63s23p64s1
1、在书写电子排布式时,电子层序数小的能级要写在左边,不能按填充顺序写。
2、充入电子时按构造原理,而书写时按电子层次序!
Fe原子序数为26,如何写基态原子电子排布式?
1s2 2s22p6 3s23p6
3、如不特别注明,原子的电子排布式和轨道表示式都是表示基态原子的电子排布。
为了避免电子排布式书写过繁,可以把内层电子已达到稀有气体结构的部分写成“原子实”,以稀有气体的元素符号外加方括号表示。
1s22s22p63s23p63d64s2
每个原子轨道最多容纳两个自旋状态不同的电子。
每一种运动状态的电子只有一个(用“↑↓”表示)。
由于每一个原子轨道包括两种运动状态,所以每一个原子轨道最多只能容纳两个自旋方向相反的电子。
因为s、p、d、f轨道的原子轨道数分别为1,3,5,7个,所以s、p、d、f各原子轨道分别最多能容纳2,6,10,14个电子。
轨道表示式又称电子排布图,即将每一个原子轨道用一个方框表示,在方框内标明基态原子核外电子分布的式子,是表述电子排布的一种图式。
各轨道按照离核由近到远,从左到右依次排列。
方框(也可用圆圈)表示原子轨道
能量相同的原子轨道的方框相连
用箭头表示处于特定自旋方向的电子。
写出以下基态原子可能的轨道表示式
错,违背了泡利不相容原理
没有电子的轨道称为空轨道
原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占在不同的原子轨道上,且自旋状态相同,这样整个原子的能量最低,这个规则称为洪特规则。
写出基态碳原子可能的轨道表示式
全充满:p6、d10、f14
半充满:p3、d5、f7
全空:p0、d0、f0
光谱实验发现,能量相同的原子轨道在全满、半满和全空条件时,体系能量较低,原子较稳定。
3d 4s
只有一组全满的原子轨道
写出 24Cr 轨道表示式
24Cr 1s22s22p63s23p63d54s1
1s 2s 2p 3s 3p
1s22s22p63s23p63d104s1
写出Fe2+、Fe3+的轨道表示式
1s 2s 2p 3s 3p 3d 4s
阳离子是原子失去外围电子层轨道上的电子;阴离子是原子得到的电子填充在最外电子层的轨道上。
在化学反应中,一般是原子的外围电子(对于主族元素的原子而言,外围电子就是最外层电子)发生变化。所以,描述原子核外电子排布时,也可以仅写出原子的外围电子排布式(价层电子排布式)。
ⅰ对于主族元素和零族元素来说,价电子就是最外层电子
表示方法:nsx或nsxnpy
例如:Cl的价层电子排布式为3s23p5
ⅱ对于副族和第VIII族元素来说,价电子除最外层电子外,还可能包括次外层电子
表示方法:(n-1)dxnsy 或 ndx (钯4d10) 或 (n-2)fx(n-1)dynsz或(n-2)fxnsy
例如:Cr的价层电子排布式为3d54s1。
价层电子的轨道表示式:
1~36号元素的原子外围电子排布
找出Na、Al、Fe、Mn、Br、Kr价层电子排布式
13Al:3s2 3p1
25Mn:3d5 4s2
35Br:4s24p5
26Fe:3d64s2
36Kr:4s24p6
S:1s22s22p63s23p4
基态原子核外电子排布的表示方法
例1、下列对电子排布式或轨道表示式书写的评价正确的是( )
基态氢原子:处于能量最低状态的氢原子。
在通常情况下,原子核外电子的排布总是使整个原子处于能量最低的状态。
基态原子吸收能量,其中的电子会发生跃迁,由于电子跃迁,原子处于比基态能量高的状态,形成激发态原子。
不同原子的电子发生跃迁时可以吸收不同的光,用光谱仪可以摄取各种原子吸收光谱。
当电子从较高能量的状态跃迁至较低能量的状态,乃至基态时,会释放能量。
光是电子跃迁释放能量的重要形式之一。
不同原子的电子发生跃迁时可以发射不同的光,用光谱仪可以摄取各种原子的发射光谱。
各种原子的吸收光谱或发射光谱,总称为原子光谱。
原子核外电子排布遵循的原理和规则
原子核外电子排布的表示式
电子排布式、价电子排布式
轨道表示式(电子排布图)
全满、半满、全空相对稳定
原子核外电子的排布原理
能量最低原理泡利不相容原理洪特规则原子核外电子排布的表示式
1、写出下列基态原子或基态离子的电子排布式:(1)B:__________________________;V:________________________________;Ga:________________________________________;Ge:________________________________________。(2)N3-:________________________;Ni2+:____________________________;Cr3+:____________________________;Mn2+:___________________________。
1s22s22p1或[He]2s22p1
1s22s22p63s23p63d34s2或[Ar]3d34s2
1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1
1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2
1s22s22p6或[He]2s22p6
1s22s22p63s23p63d8或[Ar]3d8
1s22s22p63s23p63d3或[Ar]3d3
1s22s22p63s23p63d5或[Ar]3d5
选择性必修2第一单元 分子的空间结构优秀课件ppt: 这是一份选择性必修2<a href="/hx/tb_c4009342_t3/?tag_id=26" target="_blank">第一单元 分子的空间结构优秀课件ppt</a>,文件包含413分子的极性和手性分子同步课件pptx、微波炉加热的原理是什么实验mp4等2份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
高中化学苏教版 (2019)选择性必修2第四单元 分子间作用力 分子晶体评优课课件ppt: 这是一份高中化学苏教版 (2019)选择性必修2<a href="/hx/tb_c4009339_t3/?tag_id=26" target="_blank">第四单元 分子间作用力 分子晶体评优课课件ppt</a>,文件包含341分子间作用力分子晶体范德华力氢键同步课件pptx、1-分子间的作用力和氢键-480P清晰-AVCmp4、晶体中的氢键动画演示mp4等3份课件配套教学资源,其中PPT共43页, 欢迎下载使用。
化学选择性必修2第二单元 离子键 离子晶体优质课件ppt: 这是一份化学选择性必修2<a href="/hx/tb_c4009337_t3/?tag_id=26" target="_blank">第二单元 离子键 离子晶体优质课件ppt</a>,共38页。PPT课件主要包含了学习目标,离子键的形成,静电作用,静电引力,静电斥力,成键条件,离子化合物中的化学键,表示方法电子式,典例解析,离子晶体等内容,欢迎下载使用。













