

苏教版 (2019)选择性必修1专题1 化学反应与能量第一单元 化学反应的热效应精品课堂检测
展开一、能源的充分利用
1.概念
能源是可以提供 的自然资源,它包括 、阳光、风力、流水、潮汐等。
2.分类
(1)根据能源性质可分为 (如化石燃料等)和 (太阳能、风能、氢能、生物质能等)。
(2)我国目前使用的主要能源是化石燃料。
(3)新能源的特点:资源丰富、可再生、无污染或少污染。
3.能源危机的解决方法
降低能耗,开发 ,节约 ,提高能源的 。
4.燃料的选择
(1)生活中选择何种物质作为燃料,考虑 大小;
(2)考虑燃料的 、来源、价格、运输、对环境的影响、使用的安全性等多方面的因素。
二、标准燃烧热和热值
1.标准燃烧热
(1)概念。
在 下, 物质 燃烧的 叫做该物质的标准燃烧热。
(2)完全燃烧的标准。
N→ 、H→ 、C→ 。
(3)单位。
标准燃烧热是反应热的一种,单位为 或 。
注意:标准燃烧热是反应热的一种类型,标准燃烧热规定可燃物必须是 ,生成物必须是稳定产物。
标准燃烧热的热化学方程式以燃烧1 ml物质为标准来配平其余物质的化学计量数,故在其热化学方程式中常出现分数系数。
“表示标准燃烧热的热化学方程式”与“可燃物燃烧的热化学方程式”的书写不同。前者可燃物的化学计量数必须为1,后者不强调可燃物的物质的量,可为任意值。
2.热值
物质完全燃烧的反应热叫做该物质的热值。
3.标准燃烧热和热值的意义
标准燃烧热或热值可以衡量燃料燃烧放出热量的大小。
利用标准燃烧热可计算一定量燃料燃烧能放出多少热量:由标准燃烧热定义可知,25 ℃、101 kPa时,可燃物完全燃烧产生的热量=可燃物的物质的量×|其标准燃烧热|,即Q放= ;或变换一下求物质的标准燃烧热:ΔH=-eq \f(Q放,n(可燃物))。此公式中的ΔH是指物质的标准燃烧热,而不是指一般反应的反应热。
2.标准燃烧热和中和热的比较
课后分层练
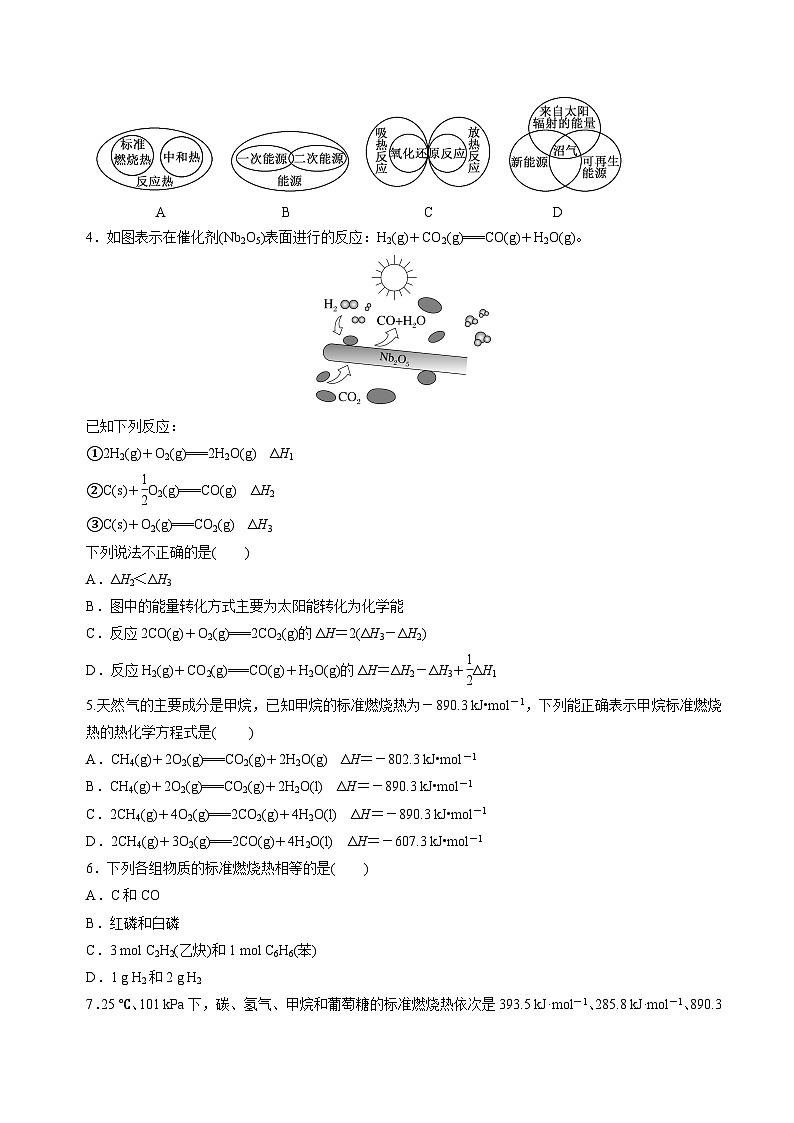
1.如图为“能源分类相关图”,四组能源选项中全部符合图中阴影部分的是( )
A.煤炭、石油、潮汐能
B.水能、生物质能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能
2.下列说法正确的是( )
A.1 ml硫酸与1 ml Ba(OH)2完全中和所放出的热量为中和热
B.25 ℃、101 kPa时,1 ml S和2 ml S的标准燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 ml碳燃烧所放出的热量为碳的标准燃烧热
3.下列图示关系错误的是( )
A B C D
4.如图表示在催化剂(Nb2O5)表面进行的反应:H2(g)+CO2(g)===CO(g)+H2O(g)。
已知下列反应:
①2H2(g)+O2(g)===2H2O(g) ΔH1
②C(s)+eq \f(1,2)O2(g)===CO(g) ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
下列说法不正确的是( )
A.ΔH2<ΔH3
B.图中的能量转化方式主要为太阳能转化为化学能
C.反应2CO(g)+O2(g)===2CO2(g)的ΔH=2(ΔH3-ΔH2)
D.反应H2(g)+CO2(g)===CO(g)+H2O(g)的ΔH=ΔH2-ΔH3+eq \f(1,2)ΔH1
5.天然气的主要成分是甲烷,已知甲烷的标准燃烧热为-890.3 kJ•ml-1,下列能正确表示甲烷标准燃烧热的热化学方程式是( )
A.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ•ml-1
B.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ•ml-1
C.2CH4(g)+4O2(g)===2CO2(g)+4H2O(l) ΔH=-890.3 kJ•ml-1
D.2CH4(g)+3O2(g)===2CO(g)+4H2O(l) ΔH=-607.3 kJ•ml-1
6.下列各组物质的标准燃烧热相等的是( )
A.C和CO
B.红磷和白磷
C.3 ml C2H2(乙炔)和1 ml C6H6(苯)
D.1 g H2和2 g H2
7.25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的标准燃烧热依次是393.5 kJ·ml-1、285.8 kJ·ml-1、890.3 kJ·ml-1、2 800 kJ·ml-1,则下列热化学方程式正确的是( )
A.C(s)+ eq \f(1,2)O2(g)===CO(g) ΔH=-393.5 kJ·ml-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=571.6 kJ·ml-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·ml-1
D. eq \f(1,2)C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·ml-1
8.标准状态下,1 ml纯物质的相对能量及解离为气态原子时所消耗的能量如下表所示:
下列说法正确的是( )
A.x=180
B.逐级断开CH4(g)中的每摩尔C—H所消耗的能量均为414 kJ
C.解离C(石墨,s)中的每摩尔碳碳键平均耗能为239 kJ
D.根据4NO(g)+CH4(g)===CO2(g)+2N2(g)+2H2O(g)的ΔH可计算出H—O键能
9.已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ/ml Na2O2(s)+CO2(g)===Na2CO3(s)+eq \f(1,2)O2(g) ΔH=-226 kJ/ml,根据以上热化学方程式判断,下列说法正确的是( )
A.CO的标准燃烧热为-566 kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ/ml
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
10.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是N2(g)和H2(g)反应生成1 ml NH3(g)过程中能量的变化示意图,请写出N2(g)和H2(g)反应的热化学方程式: 。
(2)若已知下列数据:
根据表中及图中数据计算N—H键的键能是 kJ•ml-1。
(3)用NH3催化还原NO,还可以消除氮氧化物的污染。已知:
4NH3(g)+3O2(g)===2N2(g)+6H2O(g)
ΔH1=a kJ•ml-1①
N2(g)+O2(g)===2NO(g)
ΔH2=b kJ•ml-1②
若1 ml NH3还原NO至N2,则该反应过程中的反应热ΔH3= kJ•ml-1(用含a、b的式子表示)。
11.液态肼(N2H4)和液态双氧水可作为火箭推进剂的原料,它们混合时发生反应,生成N2和水蒸气,并放出大量的热。已知1 g液态肼完全反应生成气态水放出的热量为20 kJ。
(1)H2O(l)===H2O(g) ΔH=44 kJ•ml-1,写出液态肼与液态双氧水反应生成N2和液态水的热化学方程式: 。
(2)以N2和H2为原料通过一定途径可制得N2H4,已知断裂1 ml N—N键、N≡N键、N—H键、H—H键所需的能量分别为193 kJ•ml-1、946 kJ•ml-1、390.8 kJ•ml-1、436 kJ•ml-1,试写出由N2、H2合成气态肼(N2H4)的热化学方程式为 。
(3)温度在150 ℃以上时,H2O2便迅速分解为H2O和O2,发射火箭时用过氧化氢作强氧化剂就是利用这个原理,已知:
①H2(g)+O2(g)===H2O2(l)
ΔH1=-134.3 kJ•ml-1;
②H2O(l)===H2(g)+eq \f(1,2)O2(g)
ΔH2=286 kJ•ml-1。
则反应③H2O2(l)===H2O(l)+eq \f(1,2)O2(g)的ΔH= 。
1.下面均是正丁烷与氧气反应的热化学方程式(25 ℃,101 kPa):
①C4H10(g)+ eq \f(13,2)O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·ml-1
②C4H10(g)+ eq \f(13,2)O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·ml-1
③C4H10(g)+ eq \f(9,2)O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·ml-1
④C4H10(g)+ eq \f(9,2)O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·ml-1
由此判断,正丁烷的标准燃烧热ΔH为( )
A.-2 878 kJ·ml-1 B.-2 658 kJ·ml-1
C.-1 746 kJ·ml-1 D.-1 526 kJ·ml-1
2.下列关于反应热的描述中不正确的是( )
A.氢气的标准燃烧热为-285.8 kJ•ml-1,则水电解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=571.6 kJ•ml-1
B.CO(g)的标准燃烧热是-283.0 kJ•ml-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=2×283.0 kJ•ml-1
C.反应热有正负之分,标准燃烧热ΔH全部是负值
D.HCl和NaOH反应的中和热ΔH=-57.3 kJ•ml-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3) kJ•ml-1
3.下列关于热化学反应的描述中正确的是( )
A.已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3)kJ·ml-1
B.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+ eq \f(1,2)O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·ml-1,则CH3OH(g)的标准燃烧热为192.9 kJ·ml-1
C.已知2H2O(g)===2H2(g)+O2(g) ΔH=+571.6 kJ·ml-1,则H2(g)的标准燃烧热是285.8 kJ·ml-1
D.葡萄糖的标准燃烧热是2 800 kJ·ml-1,则 eq \f(1,2)C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·ml-1
4.分析下表中的3个热化学方程式,下列说法正确的是( )
A.丙烷的燃烧热为-2 039 kJ/ml
B.等质量的氢气与丙烷相比较,充分燃烧时,丙烷放热更多
C.3CO2(g)+10H2(g)===C3H8(g)+6H2O(g) ΔH=-381 kJ/ml
D.3CO(g)+7H2(g)===C3H8(g)+3H2O(g)
ΔH=504 kJ/ml
5.下列热化学方程式正确的是(ΔH的绝对值均正确)( )
A.S(s)+O2(g)===SO2(g) ΔH=-269.8 kJ·ml-1(反应热)
B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)
ΔH=+57.3 kJ·ml-1(中和热)
C.C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)
ΔH=-1 367.0 kJ·ml-1(标准燃烧热)
D.2NO2===2NO+O2 ΔH=+116.2 kJ·ml-1(反应热)
6.下列热化学方程式中,ΔH能表示对应物质的标准燃烧热的是( )
A.2C8H18(l)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-11 828.0 kJ•ml-1
B.CO(g)+eq \f(1,2)O2(g)===CO2(g)
ΔH=-283.0 kJ•ml-1
C.C(s)+eq \f(1,2)O2(g)===CO(g)
ΔH=-110.5 kJ•ml-1
D.H2(g)+eq \f(1,2)O2(g)===H2O(g)
ΔH=-241.8 kJ•ml-1
7.下列说法正确的是( )
A.1 g H2和4 g O2反应生成液态水时放出71.45 kJ热量,则氢气的标准燃烧热为-142.9 kJ•ml-1
B.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ•ml-1,若将含0.5 ml H2SO4的浓硫酸与含1 ml NaOH的氢氧化钠溶液混合,放出的热量大于57.3 kJ
C.盐酸和NaOH溶液反应的中和热ΔH=-57.3 kJ•ml-1,则H2SO4溶液和KOH溶液反应的中和热ΔH=2×(-57.3 kJ•ml-1)
D.1 ml甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的标准燃烧热
8.下列说法正确的是( )
A.H2的标准燃烧热ΔH=-285.8 kJ•ml-1,则2H2O(g)===2H2(g)+O2(g) ΔH=571.6 kJ•ml-1
B.测定中和反应反应热的实验中,混合溶液的温度不再变化时,该温度为终止温度
C.碳中和涉及多种形式的化学反应吸收CO2气体,全部是吸热反应
D.已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH1=-57.3 kJ•ml-1,稀醋酸和稀氢氧化钠溶液反应生成1 ml水时的反应热为ΔH2,则ΔH1<ΔH2
9.根据能量变化示意图,下列说法错误的是( )
A.相同质量的N2H4(g)和N2H4(l),前者具有的能量较高
B.相同质量的NO2(g)和N2O4(g),后者的总键能较大
C.ΔH5=ΔH1+ΔH2+ΔH3+ΔH4
D.N2H4(l)+NO2(g)===eq \f(3,2)N2(g)+2H2O(l) ΔH,则ΔH>ΔH4
10.下列关于如图所示转化关系(X代表卤素)的说法不正确的是( )
A.ΔH3<0
B.ΔH1=ΔH2+ΔH3
C.按照Cl、Br、I的顺序,ΔH2依次增大
D.途径Ⅰ生成HCl放出热量比生成HBr的多,说明HCl比HBr稳定
11.已知H2的标准燃烧热为-285.8 kJ•ml-1,CO的标准燃烧热为-282.8 kJ•ml-1。现有H2和CO组成的混合气体56.0 L(标准状况),经充分燃烧后,共放出热量710.0 kJ,并生成液态水。下列说法正确的是( )
A.CO标准燃烧热的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-282.8 kJ•ml-1
B.H2标准燃烧热的热化学方程式为H2(g)+eq \f(1,2)O2(g)===H2O(g) ΔH=-285.8 kJ•ml-1
C.燃烧前的混合气体中,H2的体积分数为40%
D.混合气体燃烧后与足量的过氧化钠反应,电子转移总数为2NA
12.俄罗斯用“质子-M”号运载火箭成功将“光线”号卫星送入预定轨道,发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂。已知如图条件,下列说法正确的是( )
A.2 ml H2(g)与1 ml O2(g)所具有的总能量比2 ml H2O(g)所具有的总能量低
B.氢气的标准燃烧热为ΔH=-285.8 kJ•ml-1
C.火箭中液氢燃烧的热化学方程式为2H2(l)+O2(l)===2H2O(g) ΔH=-483.6 kJ•ml-1
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
13.(1)在标准状况下的11.2 L甲烷完全燃烧生成CO2和液态水放出444.8 kJ热量,能表示其标准燃烧热的热化学方程式是 。
(2)氨是制备氮肥、硝酸等的重要原料。
已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ•ml-1
N2(g)+O2(g)2NO(g) ΔH=180 kJ•ml-1
2H2(g)+O2(g)2H2O(l) ΔH=-571.6 kJ•ml-1
试写出NH3(g)燃烧生成N2(g)和H2O(l)的热化学方程式: 。
14.已知下列两个热化学方程式:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1
C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=-2 220 kJ·ml-1
请根据上面两个热化学方程式,回答下列问题:
(1)H2的标准燃烧热为_________________,C3H8的标准燃烧热为________________。
(2)1 ml H2和2 ml C3H8组成的混合气体完全燃烧释放的热量为____________________。
(3)现有H2和C3H8的混合气体共5 ml,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是________________。
15.已知下列两个热化学方程式:
2H2(g)+O2(g)===2H2O(l)
ΔH=-571.6 kJ•ml-1
C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220 kJ•ml-1
请根据上面两个热化学方程式,回答下列问题:
(1)H2的标准燃烧热为 ,C3H8的标准燃烧热为 。
(2)1 ml H2和2 ml C3H8组成的混合气体完全燃烧释放的热量为 。
(3)现有H2和C3H8的混合气体共5 ml,完全燃烧时放热3 847 kJ,则在混合气体中H2和C3H8的体积比是 。
16.热化学循环分解水制H2是在水反应体系中加入一种中间物,经历不同的反应阶段,最终将水分解为H2和O2,如图是热化学循环制氢气的流程。
(1)实验测得,1 g H2燃烧生成液态水放出142.9 kJ的热量,则能表示氢气标准燃烧热的热化学方程式为 。
(2)整个流程参与循环的物质是 (填化学式,下同)和 ,最难进行的反应是 (填序号)。
(3)乙醇氧化重整或水蒸气重整都可以制取氢气:
氧化重整:C2H5OH(l)+eq \f(3,2)O2(g)===2CO2(g)+3H2(g) ΔH=-554.0 kJ•ml-1
水蒸气重整:C2H5OH(l)+3H2O(g)===2CO2(g)+6H2(g) ΔH=174.2 kJ•ml-1
①反应C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(g)的ΔH<(填“>”“<”或“=”)-554.0 kJ•ml-1。
②实际生产中采用氧化、水蒸气联合重整,为维持热平衡,理论上参加水蒸气重整的乙醇与参加氧化重整的乙醇的物质的量之比为 。
(4)合成氨用的H2可以甲烷为原料制得。有关化学反应的能量变化如图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为 。
标准燃烧热
中和热
相同点
能量变化ΔH及其单位
放热反应
ΔH<0,单位均为kJ·ml-1
不同点
反应物的量
1 ml
不一定为1 ml
生成物的量
不确定
生成水的量为1 ml
表示方法
标准燃烧热为a kJ·ml-1或ΔH=-a kJ·ml-1
中和热为57.3 kJ·ml-1或ΔH=-57.3 kJ·ml-1
物质
O2(g)
N2(g)
NO(g)
C(石墨,s)
CH4(g)
CO2(g)
相对能量/
(kJ •ml-1)
0
0
x
0
-75
-393.5
解离总耗
能/kJ
498
946
632
717
1 656
y
化学键
H—H
N≡N
键能/(kJ •ml-1)
436
946
2022年北京冬奥会“飞扬”火炬的燃料
H2
①2H2(g)+O2(g)===2H2O(g)
ΔH=-484 kJ/ml
2008年北京奥运会“祥云”火炬的燃料
C3H8
②C3H8(g)+5O2(g)===3CO2(g)+4H2O(g)
ΔH=-2 039 kJ/ml
③2C3H8(g)+7O2(g)===6CO(g)+8H2O(g)
ΔH=-2 380 kJ/ml
苏教版 (2019)选择性必修1第一单元 化学反应的热效应综合训练题: 这是一份苏教版 (2019)选择性必修1<a href="/hx/tb_c4009310_t7/?tag_id=28" target="_blank">第一单元 化学反应的热效应综合训练题</a>,文件包含113化学反应中的热效应能源的充分利用原卷版pdf、113化学反应中的热效应能源的充分利用解析版pdf等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
苏教版 (2019)选择性必修1第一单元 化学反应的热效应同步达标检测题: 这是一份苏教版 (2019)选择性必修1第一单元 化学反应的热效应同步达标检测题,共24页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应课时练习: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应课时练习,共4页。试卷主要包含了单选题,填空题,实验探究题等内容,欢迎下载使用。













