






高中化学第一单元 化学反应的热效应优秀ppt课件
展开核心素养 发展目标
1.宏观辨识与微观探析:能从宏观和微观的角度理解化学反应中能量变化的本质,正确认识和判断放热反应和吸热反应。
2.变化观念与平衡思想:能辨识化学反应中的能量转化形式,形成能量可以相互转化的观念,正确理解反应热和焓变的概念。
3.模型认知:建立从定性到定量描述化学反应中的能量变化的思维模型,会正确书写热化学方程式。
三、从微观角度解释化学反应中的能量变化
1.体系与环境被研究的物质系统称为 ,体系以外的其他部分称为 或外界。2.内能与焓(1)内能体系内物质的各种能量的总和,受 、 、物质的聚集状态和组成的影响。内能的变化可以通过变化过程中体系吸收(或放出)的 和对内(或对外)所做的 的形式表现出来。(2)焓:与内能有关的物理量,用符号“ ”表示。
3.化学反应的两大基本特征
变化:获得新物质
变化
主要表现形式是 或释放的 ,能量的转换以发生化学变化的物质为基础,遵循 守恒定律
4.焓变和反应热的概念(1)反应热在化学反应过程中,当反应物和生成物具有相同温度时,___________ 称为化学反应的热效应,也称反应热。(2)焓变
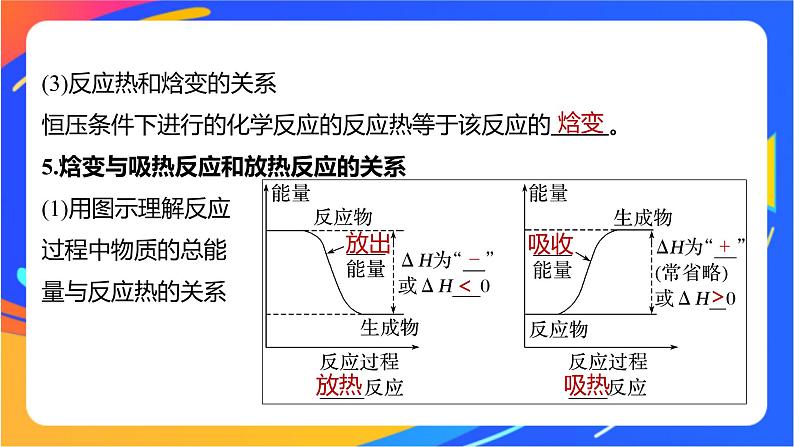
(3)反应热和焓变的关系恒压条件下进行的化学反应的反应热等于该反应的 。5.焓变与吸热反应和放热反应的关系(1)用图示理解反应过程中物质的总能量与反应热的关系
(2)化学反应的分类(以反应过程中能量变化为依据)
(1)相同质量的同种物质,在不同状态下其焓是相同的( )(2)化学反应的反应热就是该反应的焓变( )(3)化学变化中的能量变化都是化学能与热能间的相互转化( )(4)化学反应的焓变和反应物及生成物的内能有关,和反应条件无关( )(5)一个化学反应中,当反应物的总能量大于生成物的总能量时,ΔH>0( )(6)放热反应的ΔH<0;而吸热反应的ΔH>0( )(7)吸热反应一定需要加热或点燃( )(8)放热反应在常温下一定可以发生( )
1.常见化学反应的能量变化如图a、b所示:
某些常见的热效应:①浓硫酸溶于水;②CaO溶于水;③水高温分解;④硝酸铵溶于水;⑤NaOH溶于水。(1)上述热效应中,属于图a的为 ,属于图b的为 。
(2)试说明①~⑤中,既不属于图a,也不属于图b的理由?
①浓硫酸溶于水;②CaO溶于水;③水高温分解;④硝酸铵溶于水;⑤NaOH溶于水。
提示 有热量放出未必是放热反应,放热反应和吸热反应必须是化学变化。浓硫酸溶于水、硝酸铵溶于水、NaOH溶于水属于物理变化,不是化学变化。
2.一定条件下,石墨转化为金刚石要吸收能量。在该条件下,下列结论正确的是A.金刚石比石墨稳定B.金刚石转化为石墨是吸热反应C.1 ml C(金刚石)比1 ml C(石墨)的总能量高D.等质量的金刚石和石墨完全燃烧释放的热量相同
石墨转化为金刚石要吸收能量,则金刚石具有的能量高,物质具有的能量越高越不稳定,所以石墨更稳定,故A错误;石墨转化为金刚石要吸收能量,则金刚石转化为石墨是放热反应,故B错误;石墨转化为金刚石要吸收能量,说明1 ml C(金刚石)比1 ml C(石墨)的总能量高,故C正确;金刚石具有的能量高,等质量的金刚石和石墨完全燃烧时,金刚石释放的能量比石墨多,故D错误。
1.在日常生活和学习中,我们经常接触到下列反应:①化石燃料燃烧 ②强酸、强碱的中和反应③用C和H2O(g)在高温下制水煤气 ④锌和盐酸反应制氢气 ⑤氢氧化钡晶体和氯化铵晶体研磨放出氨气 ⑥煅烧石灰石其中焓变为负值的有 (填序号,下同),焓变为正值的有 。
2.利用含碳化合物合成新燃料是发展低碳经济的重要方法,已知CO(g)+2H2(g) CH3OH(g)的反应过程中能量的变化情况如图所示。下列判断正确的是A.生成1 ml CH3OH(g)吸收91 kJ能量B.用碳制备原料气CO、H2的反应属于放热反应C.反应物的总能量大于生成物的总能量D.如果该反应生成液态CH3OH,则释放的热量更少
A项,根据图示,反应物的总能量大于生成物的总能量,该反应是放热反应,错误;B项,碳与水蒸气在高温条件下反应生成CO、H2的反应属于吸热反应,错误;D项,CH3OH由气态变为液态要释放热量,故生成液态CH3OH时释放的热量更多,错误。
(1)一个化学反应是吸热还是放热取决于反应物总能量和生成物总能量的相对大小,而与反应开始前是否需要加热无关,若加热后开始反应,停止加热后反应继续进行,则该反应为放热反应,如铝热反应、Fe与S的反应、NH3的催化氧化等。(2)绝大多数吸热反应需在加热条件下进行,但也有部分吸热反应不加热也能进行,如Ba(OH)2·8H2O与NH4Cl的反应;放热反应虽然会有能量放出,但有的放热反应需要加热才能进行,通过加热,可以引发放热反应,如C+O2 CO2。
(3)若某反应为吸热反应,则该反应的逆向反应为放热反应,如H2O分解生成H2和O2为吸热反应,H2与O2化合生成H2O为放热反应。(4)吸热反应和放热反应均是化学反应。NaOH固体溶于水、浓H2SO4稀释等属于放热过程,但不属于放热反应;NH4NO3固体溶于水、碘升华等属于吸热过程,但不属于吸热反应。
1.热化学方程式的概念及意义(1)概念:能够表示 的化学方程式。(2)意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的 变化。2.热化学方程式与普通化学方程式的区别
3.热化学方程式的书写方法(1)写出相应的化学方程式。热化学方程式中各物质化学式前的化学计量数只表示其 ,可以是整数或简单分数。(2)标注反应的温度和压强。没有特殊说明则是指25 ℃(即298 K)、101 kPa。不用标明反应条件(如“加热”“高温”“催化剂”等)。(3)标注各物质的聚集状态。在物质后面用括号标注各物质的聚集状态:气体用“ ”,液体用“ ”,固体用“ ”,水溶液用“ ”。
(4)标注ΔH的正负。化学方程式后面空一格标注ΔH,若为放热反应,ΔH为“ ”;若为吸热反应,ΔH为“ ”(“+”可省略不写)。(5)计算ΔH的数值。根据化学方程式中的化学计量数计算写出ΔH的数值。ΔH的单位是 。
(1)25 ℃、101 kPa时,0.5 ml CH4完全燃烧生成CO2气体和液态H2O时,放出445 kJ的热量。①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-445 kJ·ml-1( )②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=890 kJ·ml-1( )③CH4+2O2===CO2+H2O ΔH=-890 kJ·ml-1( )④CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·ml-1( )
(2)若H2(g)+Cl2(g)===2HCl(g) ΔH=-92.3 kJ·ml-1,则2HCl(g)===H2(g)+Cl2(g) ΔH=92.3 kJ·ml-1( )
1.氢气与碘蒸气化合反应的能量(或热量)变化,可用热化学方程式表示如下:
(1)它与化学方程式H2+I2 2HI相比较,有哪些主要特点?
提示 ①指明了反应时的温度和压强;若在25 ℃、101 kPa时进行的反应,可以不注明;②注明了各物质反应时的状态:s(固体)、l(液体)、g(气体)或aq(水溶液);③在化学方程式的右边注明了ΔH的数值、符号及单位。
(2)请你说明题述热化学方程式所表示的意义。
提示 在200 ℃、101 kPa下,1 ml H2(g)与1 ml I2(g)反应,生成2 ml HI(g)放出的热量是14.9 kJ。(热化学方程式中的化学计量数只表示物质的物质的量,可以是整数也可以是分数)
2.下面是25 ℃、101 kPa条件下的四个热化学方程式:
③2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1
(1)①②相比,反应热数值不同的原因是_______________________。
(2)②③相比,若化学方程式的化学计量数扩大一倍,则反应热_______ 。
(3)①④相比,可得出的结论是正向、逆向反应的焓变数值 ,符号 。
ΔH=46 kJ·ml-1
该反应是可逆反应,不能进
3.已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·ml-1,请写出1 ml NH3分解对应的热化学方程式: 。若1 ml N2(g)和3 ml H2(g)在一定条件下发生反应,放出的热量 92 kJ(填“大于”“小于”或“等于”),理由是________________________________ 。
(1)热化学方程式中化学式前面的化学计量数必须与ΔH相对应,若化学计量数加倍,则ΔH的数值也要加倍。(2)当反应逆向进行时,其反应热与正反应的反应热的数值相等,符号相反。(3)ΔH的单位为kJ·ml-1,它并不是指每摩尔具体物质反应时伴随的能量变化是多少千焦,而是指给定形式的具体反应以各物质的化学计量数来计量其物质的量时伴随的能量变化是多少千焦。
(4)可逆反应的ΔH和实际吸收或放出热量的区别:不论化学反应是否可逆,热化学方程式中ΔH都表示反应按照化学计量数所表示的物质的量完全反应所放出或吸收的热量。如2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·ml-1是指2 ml SO2(g)和1 ml O2(g)完全转化为2 ml SO3(g)时释放的热量为197 kJ。若在相同的温度和压强下,向某容器中加入2 ml SO2(g)和1 ml O2(g),反应达到平衡时释放的热量为Q,因反应不能进行彻底,故Q<197 kJ。
1.N2H4是一种高效清洁的火箭燃料。0.25 ml N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式正确的是A. N2H4(g)+ O2(g)=== N2(g)+H2O(g) ΔH=267 kJ·ml-1B.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·ml-1C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=534 kJ·ml-1D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-133.5 kJ·ml-1
2.根据所给信息,书写对应的热化学方程式。(1)11.2 L(标准状况)H2在足量Cl2中燃烧生成HCl气体,放出91.5 kJ的热量,其热化学方程式: 。(2)已知1 ml C(石墨,s)与适量H2O(g)反应生成CO(g)和H2(g),吸收131.3 kJ的热量,请写出该反应的热化学方程式:_____________________________________________________。
H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·ml-1
C(石墨,s)+H2O(g)===CO(g)
+H2(g) ΔH=131.3 kJ·ml-1
(3)1.7 g NH3(g)发生催化氧化反应生成气态产物,放出22.67 kJ的热量,其热化学方程式:___________________________________________________。(4)25 ℃、101 kPa下,强酸、强碱的稀溶液发生中和反应生成1 ml H2O(l)时,放出57.3 kJ的热量,其热化学方程式:______________________________________________。
H+(aq)+OH-(aq)===
H2O(l) ΔH=-57.3 kJ·ml-1
从微观角度解释化学反应中的能量变化
1.实例分析化学反应的焓变(1)N2(g)和O2(g)反应生成NO(g)过程中的能量变化如图所示:
180 kJ·ml-1
化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:
其中,E1可看作反应物断裂化学键吸收的总能量,E2可看作生成物形成化学键放出的总能量,E1与E2的差值表示 。题述反应过程表示该反应为 反应。
(2)焓变计算公式:ΔH=E(反应物的总键能)-E(生成物的总键能)。
2.化学变化中的能量变化可为人的生命活动提供能量(1)为人体提供所需能量的三大营养物质是 、 和 ,其中 的热值最大。(2)糖类中只有 能直接给人体提供热量。写出180 g葡萄糖在人体内与氧气作用,产生2 803 kJ能量的热化学方程式:_________________________________________________________。
C6H12O6(s)+6O2(g)
===6H2O(l)+6CO2(g) ΔH=-2 803 kJ·ml-1
提示 断裂1 ml H—H键需吸收436 kJ的能量,断裂1 ml Cl—Cl键需吸收243 kJ的能量;形成1 ml H—Cl键会释放431 kJ的能量;所以反应总体上会放出183 kJ的能量。
反应H2(g)+Cl2(g)===2HCl(g)的微观过程及其能量变化如图所示。(1)根据图中提供的键能数据,计算1 ml H2(g)与1 ml Cl2(g)作用生成2 ml HCl(g)的热效应。
提示 从微观角度看,化学反应中能量变化的主要原因是断裂化学键所吸收的能量和形成化学键所放出的能量不相等。断裂化学键所吸收总能量(反应物键能总和)大的是吸热反应,形成化学键所放出总能量(生成物键能总和)大的是放热反应。
(2)从微观角度看,化学反应中能量变化的主要原因是什么?如何判断反应是放热反应还是吸热反应?
1.如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法正确的是A.在通常情况下,O2比N2稳定B.吸热反应一定需要加热才能发生C.1 ml N2(g)和1 ml O2(g)具有的总能量小于2 ml NO(g)具有的总能量D.1 ml N2(g)和NA 个 O2(g)充分反应生成2 ml NO(g)放出的能量为180 kJ
据图可知1 ml N2(g)中化学键断裂吸收的能量大于1 ml O2(g)中化学键断裂吸收的能量,所以N2更稳定,故A错误;吸热反应不一定需要加热才能发生,例如Ba(OH)·8H2O和NH4Cl的反应,故B错误;
由图中数据可得反应物断键吸收(946+498)kJ=1 444 kJ的能量,生成物成键放出2×632 kJ=1 264 kJ的能量,故该反应是吸热反应,即
1 ml N2(g)和1 ml O2(g)具有的总能量小于2 ml NO(g)具有的总能量,故C正确;NA个O2(g)即1 ml O2(g),根据C项可知1 ml N2(g)和NA 个 O2(g)充分反应生成2 ml NO(g)吸收的能量为1 444 kJ-1 264 kJ=180 kJ,故D错误。
2.已知一些化学键的键能数据如表所示:
请根据键能数据书写CH4(g)和F2(g)反应生成CF4(g)和HF(g)的热化学方程式:______________________________________________________。
CH4(g)+4F2(g)===CF4(g)+4HF(g) ΔH=-1 940 kJ·ml-1
首先根据反应物和生成物写出化学方程式,注明各物质的状态,化学反应的反应热等于断裂旧化学键吸收的能量和形成新化学键放出的能量的差,根据键能数据可知,所求反应的反应热ΔH=414 kJ·ml-1×4+155 kJ·ml-1×4-489 kJ·ml-1×4-565 kJ·ml-1×4=-1 940 kJ·ml-1。
题组一 焓变和反应热概念的理解与判断1.下列说法不正确的是A.恒压条件下进行的反应焓变等于该反应的热效应B.焓变的符号是ΔHC.焓变的单位常用kJ·ml-1D.浓硫酸溶于水是吸热反应
浓硫酸溶于水不是化学变化,是物理变化,且该过程放热。
2.下列关于ΔH的说法正确的是A.反应过程中,消耗的反应物越多,ΔH越大B.ΔH>0时反应放热,ΔH<0时反应吸热C.ΔH越大,说明反应放出的热量越多D.能量变化如图所示的化学反应为放热反应,ΔH为负值
C项,反应热有正、负,反应放出的热量越多,ΔH越小,反应吸收的热量越多,ΔH越大,错误;D项,由于反应物的总焓大于生成物的总焓,故由反应物转化为生成物时,该反应为放热反应,ΔH为负值,正确。
A项,ΔH与化学方程式中的化学计量数有关,与反应物的用量无关,错误;B项,ΔH>0时反应吸热,ΔH<0时反应放热,错误;
3.下列说法正确的是A.浓硫酸溶于水放出大量的热,是放热反应B.碳酸钙受热分解的反应中生成物总能量高于反应物总能量C.反应C(石墨)→C(金刚石)的ΔH>0,则金刚石比石墨稳定D.气态水比液态水稳定
浓硫酸溶于水是物理变化,未发生化学变化,是放热过程,A项错误;碳酸钙受热分解在高温条件下进行,反应物吸收能量转化为生成物,因此生成物的总能量高于反应物的总能量,B项正确;金刚石和石墨互为同素异形体,其中能量越低的物质越稳定,即石墨比金刚石稳定,C项错误;液态水转化为气态水时要吸收能量,能量低的液态水稳定,D项错误。
4.一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中•和代表不同元素的原子。下列关于此反应说法错误的是A.一定属于吸热反应B.一定属于可逆反应C.一定属于氧化还原反应D.一定属于分解反应
根据示意图可知该反应的反应物是一种,生成物是两种。A项,该反应属于分解反应,
一般的分解反应是吸热反应,但也有的分解反应如2H2O2===2H2O+O2↑是放热反应,错误;B项,根据图示可知有一部分反应物未参加反应,所以该反应是可逆反应,正确;C项,该反应中有元素化合价的变化,属于氧化还原反应,正确。
题组二 化学反应中能量变化图像的识别5.利用太阳光在新型复合催化剂表面实现高效分解水,其主要过程如图所示,则下列说法错误的是A.该过程中实现了光能转化为化学能B.氢能资源丰富,属于可再生能源C.过程Ⅰ吸收能量,过程Ⅱ释放能量D.2H2O 2H2↑+O2↑的能量 变化如图所示
由题意可知,太阳能使水分解,则实现了光能向化学能的转化,故A正确;氢气燃烧产物是水,太阳能光解水可得氢气,则氢能资源丰富,属于可再生能源,故B正确;过程Ⅰ断裂O—H键、吸收能量,过程Ⅱ形成O—O键、释放能量,故C正确;
氢气燃烧是放热反应,光解水是吸热反应,吸热反应的反应物的总能量低于生成物的总能量,图中反应是放热反应,故D错误。
6.参照反应Br·+H2―→HBr+H·的能量与反应过程的示意图,判断下列叙述正确的是A.正反应为吸热反应B.正反应为放热反应C.反应物的总能量高于生成物的总能量D.断裂反应物中化学键吸收的能量小于形成生成物中化学键放出的能量
反应中,反应物的总能量低于生成物的总能量,为吸热反应,A项正确,B、C项错误;反应为吸热反应,断裂化学键吸收的能量大于形成化学键放出的能量,D项错误。
7.下列图像分别表示有关反应的反应过程与能量变化的关系。
据此判断下列说法正确的是A.石墨转变为金刚石是吸热反应B.白磷比红磷稳定C.S(g)+O2(g)===SO2(g) ΔH1 S(s)+O2(g)===SO2(g) ΔH2, 则ΔH1>ΔH2D.CO(g)+H2O(g)===CO2(g)+ H2(g) ΔH>0
由图像可知石墨的能量比金刚石的低,因此由石墨转变为金刚石是吸热反应,A正确;白磷具有的能量比红磷的高,根据能量越低越稳定的原理可知,红磷比白磷稳定,B错误;|ΔH1|>|ΔH2|,由于ΔH1、ΔH2均小于零,故ΔH1<ΔH2,C错误;
反应CO(g)+H2O(g)===CO2(g)+H2(g)为放热反应,ΔH<0,D错误。
题组三 反应热的概念与计算8.下列过程伴随的能量变化中,属于反应热的是A.形成1 ml H—Cl键放出的能量B.石墨转化为金刚石吸收的能量C.1 ml O2形成2 ml O吸收的能量D.水蒸气变成液态水放出的能量
当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为反应热,化学反应的实质是旧键的断裂和新键的形成。形成1 ml H—Cl键,只有化学键的形成,故其能量的变化不属于反应热,A错误;石墨转化为金刚石既有旧键的断裂,又有新键的形成,故其能量的变化属于反应热,B正确;1 ml O2形成2 ml O,只有化学键的断裂,没有化学键的形成,故其能量的变化不属于反应热,C错误;水蒸气变成液态水是物理变化,故其能量的变化不属于反应热,D错误。
9.如图为反应2H2(g)+O2(g)===2H2O(g)的能量变化示意图,下列说法正确的是A.形成2 ml H2 (g)和1 ml O2 (g)中的化学 键,共吸收1 370.8 kJ能量B.1 ml H2 (g)和0.5 ml O2 (g)生成1 ml H2O (l)放出240.2 kJ能量C.2 ml H2(g)和1 ml O2 (g)反应生成2 ml H2O(g),共放出480.4 kJ能量D.2 ml H2(g)和1 ml O2 (g)的总能量低于2 ml H2O(g)的总能量
由图可知,4 ml H(g)和2 ml O (g)形成2 ml H2 (g)和1 ml O2 (g)中的化学键,共放出1 370.8 kJ能量,故A错误;
由图可知,反应2H2(g)+O2(g)===2H2O(g)的焓变ΔH=1 370.8 kJ·ml-1-1 851.2 kJ·ml-1=-480.4 kJ·ml-1,则H2(g)+ O2(g)===H2O(g) ΔH=-240.2 kJ·ml-1,H2O(g)→H2O(l)放热,所以1 ml H2 (g)和0.5 ml O2 (g)生成1 ml H2O(l)放出热量大于240.2 kJ,故B错误;
由B项分析可知,2 ml H2(g)和1 ml O2 (g)反应生成2 ml H2O(g),共放出480.4 kJ能量,故C正确;
由图可知,该反应是放热反应,则2 ml H2(g)和1 ml O2 (g)的总能量高于2 ml H2O(g)的总能量,故D错误。
题组四 热化学方程式10.下列说法错误的是A.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据B.热化学方程式中各物质化学式前的化学计量数不表示分子个数,只代 表物质的量C.同一化学反应,化学计量数不同,ΔH不同;化学计量数相同而物质 的聚集状态不同,ΔH也不相同D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
热化学方程式未注明温度和压强时,ΔH表示在25 ℃、101 kPa条件下测定的数据,故A错误;热化学方程式中的化学计量数只表示反应物或生成物的物质的量,不表示微粒数,系数可以用分数表示,故B正确;化学反应的焓变(ΔH)只与反应体系的始态和终态有关,而与反应的途径无关,ΔH与热化学方程式的化学计量数成正比,对于同一化学反应,当化学计量数不同时,其ΔH不同,只要热化学方程式的化学计量数一定,ΔH值一定,化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比,故C、D正确。
11.已知热化学方程式:2SO2(g)+O2(g) 2SO3(g) ΔH=-Q kJ·ml-1(Q>0)。下列说法正确的是A.相同条件下,2 ml SO2(g)和1 ml O2(g)所具有的能量小于2 ml SO3(g)所具有的能量B.将2 ml SO2(g)和1 ml O2(g)置于一密闭容器中充分反应后,放出热量 为Q kJC.此反应为放热反应,不需任何条件就能发生D.如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则 此过程中有2 ml SO2(g)被氧化
该反应是放热反应,相同条件下,2 ml SO2(g)和1 ml O2(g)所具有的能量大于2 ml SO3(g)所具有的能量,故A错误;将2 ml SO2(g)和1 ml O2(g)置于一密闭容器中充分反应后,达到化学平衡,反应物不能全部转化,放出热量小于Q kJ,故B错误;反应吸热还是放热与反应条件无关,C错误;如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,参加反应的二氧化硫为2 ml,故一定有2 ml SO2(g)被氧化,故D正确。
12.现有如下3个热化学方程式:H2(g)+ O2(g)===H2O(g) ΔH1=-a kJ·ml-1①H2(g)+ O2(g)===H2O(l) ΔH2=-b kJ·ml-1②2H2(g)+O2(g)===2H2O(l) ΔH3=-c kJ·ml-1③
则由下表所列的原因能推导出后面结论的是
①②中由于生成的水的状态不同,故ΔH不同,即a、b也不同,B项错误;①③中由于气态水转化为液态水要放热,故c>2a,C项错误;②③中因ΔH3=2ΔH2,且ΔH2、ΔH3均为负值,故ΔH2>ΔH3,D项错误。
13.根据你的认识和理解,结合所给提示写出下列有关反应的热化学方程式。(1)1 ml CaCO3(s)分解生成CaO(s)和CO2(g),吸收178.2 kJ热量:___________________________________________________。(2)N2(g)与H2(g)反应生成1 ml NH3(g),放出46.1 kJ热量:_______________________________________________。(3)1 g甲烷在空气中燃烧,恢复至常温下测得放出55.625 kJ热量:_________________________________________________________。
===CaO(s)+CO2(g) ΔH=178.2 kJ·ml-1
===NH3(g) ΔH=-46.1 kJ·ml-1
+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·ml-1
(4)P(红磷,s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 ml产物的数据)。试回答下列问题:
①写出P(红磷,s)和Cl2(g)反应生成PCl3(g)的热化学方程式:___________ 。②写出PCl5(g)分解生成PCl3(g)和Cl2(g)的热化学方程式:_______________________________________________。
+3Cl2(g)===2PCl3(g) ΔH=-612 kJ·ml-1
PCl3(g)+Cl2(g) ΔH=93 kJ·ml-1
14.下表中的数据是破坏1 ml物质中的化学键所消耗的能量:
根据上述数据回答下列问题:(1)下列物质本身具有的能量最低的是 (填字母,下同)。A.H2 B.Cl2 C.Br2 D.I2
破坏1 ml 物质中的化学键所消耗的能量越大,则物质越稳定,所具有的能量越低,则所给的四种物质中,物质本身具有的能量最低的是H2。
(2)下列氢化物中最稳定的是 。A.HCl B.HBr C.HI
所给的三种物质中,最稳定的是HCl。
(3)X2+H2===2HX(X代表Cl、Br、I)的反应是 (填“吸热反应”或“放热反应”)。
以氯元素为例进行计算。断开Cl—Cl键和H—H键需吸收的能量为243 kJ+436 kJ=679 kJ,而形成2 ml HCl放出的能量为2×432 kJ=864 kJ,所以反应Cl2(g)+H2(g)===2HCl(g)放出864 kJ-679 kJ=185 kJ的热量,同理可计算反应Br2(g)+H2(g)===2HBr(g)、I2(g)+H2(g)===2HI(g)分别放出103 kJ、9 kJ的热量。
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。
根据(3)中计算可知,相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出的热量最多的是氯气。
15.已知两个氢气燃烧生成水的热化学方程式:H2(g)+ O2(g)===H2O(g) ΔH=a kJ·ml-12H2(g)+O2(g)===2H2O(l) ΔH=b kJ·ml-1请回答下列问题(|b|表示b的绝对值):(1)若2 ml H2(g)完全燃烧生成水蒸气,则放出的热量 (填“>”“<”或“=”,下同)|b| kJ。
水蒸气转化为液态水是放热的过程,故2 ml H2(g)完全燃烧生成水蒸气,放出的热量小于|b|kJ。
(2)反应热的关系:2a b。
由于a和b均小于0,两个反应的化学计量数相同时,生成液态水放出的热量大于生成气态水放出的热量,故2a>b。
(3)若已知H2(g)+ O2(g)===H2O(g) ΔH=-242 kJ·ml-1,且氧气中1 ml O==O键完全断裂时吸收热量496 kJ,水蒸气中1 ml H—O键形成时放出热量463 kJ,则氢气中1 ml H—H键断裂时吸收的热量为 。
ΔH=断裂旧化学键吸收的总能量-形成新化学键放出的总能量,设断裂1 ml H—H键时吸收的热量为x kJ,即-242=x+496× -463×2,解得x=436。
16.化学反应N2(g)+3H2(g) 2NH3(g)的能量变化如图所示:
已知断裂1 ml N≡N、1 ml N—H分别需要吸收946 kJ、391 kJ的能量,试回答下列问题:(1)该反应为 (填“吸热”或“放热”)反应。
(2)断裂1 ml H2中化学键所需能量为 kJ。
(3)该反应的反应热ΔH= 。
-92 kJ·ml-1
17.(1)图1是1 ml NO2(g)和1 ml CO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:_____________________________________________________。
NO2(g)+CO(g)
===CO2(g)+NO(g) ΔH=-234 kJ·ml-1
该反应的焓变ΔH=E1-E2=134 kJ·ml-1-368 kJ·ml-1=-234 kJ·ml-1,所以热化学方程式为NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ·ml-1。
(2)如表是部分化学键的键能数据:
已知1 ml P4(g)完全燃烧生成P4O10(g)放出的热量为d kJ,P4和P4O10的结构如图2所示,则表中x= (用含有a、b、c、d的代数式表示)。
白磷燃烧的化学方程式为P4+5O2===P4O10,ΔH=反应物总键能-生成物总键能,1 ml白磷完全燃烧需断裂6 ml P—P、5 ml O==O,形成12 ml P—O、4 ml P==O,所以6a+5c-(4x+12b)=-d,可得x= (d+6a+5c-12b)。
化学选择性必修1专题1 化学反应与能量第一单元 化学反应的热效应完整版ppt课件: 这是一份化学选择性必修1专题1 化学反应与能量第一单元 化学反应的热效应完整版ppt课件,共21页。PPT课件主要包含了思考探究·一,习题探究,作业布置等内容,欢迎下载使用。
化学苏教版 (2019)第一单元 化学反应的热效应课堂教学课件ppt: 这是一份化学苏教版 (2019)第一单元 化学反应的热效应课堂教学课件ppt,共25页。PPT课件主要包含了学习目标,二热化学方程式等内容,欢迎下载使用。
高中鲁科版 (2019)第1节 化学反应的热效应一等奖ppt课件: 这是一份高中鲁科版 (2019)第1节 化学反应的热效应一等奖ppt课件,共36页。PPT课件主要包含了学习目标,反应吸热,反应放热,反应前和反应后,实验用品,实验步骤,热化学方程式的书写等内容,欢迎下载使用。













