






苏教版 (2019)选择性必修1第一单元 化学反应的热效应优秀ppt课件
展开一、反应热的计算1.根据热化学方程式计算热化学方程式中反应热数值与各物质的化学计量数成正比。注:Q表示吸收或放出的能量。例如,aA(g)+bB(g)===cC(g)+dD(g) ΔH a b c d |ΔH|n(A) n(B) n(C) n(D) Q
已知由氢气和氧气反应生成4.5 g水蒸气时放出60.45 kJ的热量。(1)写出H2燃烧的热化学方程式。
答案 已知生成4.5 g(0.25 ml)水蒸气放出60.45 kJ的热量,则有2H2(g)+O2(g)===2H2O(g) ΔH2 ml 1 ml 2 ml |ΔH| 0.25 ml 60.45 kJ则 ,|ΔH|=483.6 kJ·ml-1,由于反应放热,所以ΔH=-483.6 kJ·ml-1,故热化学方程式:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·ml-1。
(2)计算该条件下50 g H2燃烧放出的热量。
2.根据反应物、生成物的键能计算ΔH=E(反应物的键能总和)-E(生成物的键能总和)。
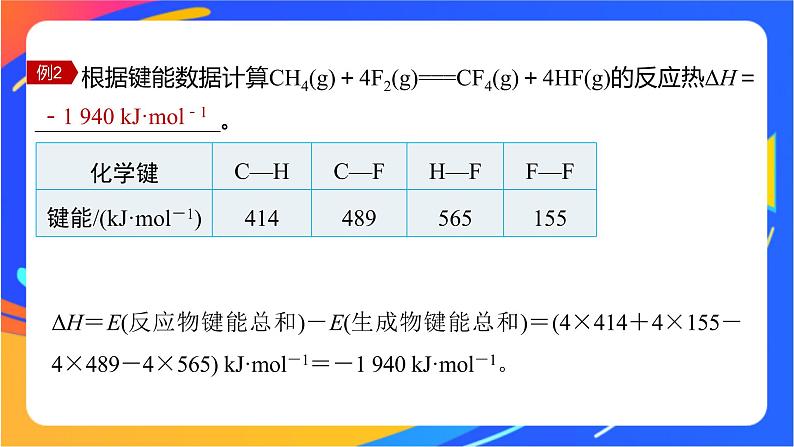
根据键能数据计算CH4(g)+4F2(g)===CF4(g)+4HF(g)的反应热ΔH=________________。
-1 940 kJ·ml-1
ΔH=E(反应物键能总和)-E(生成物键能总和)=(4×414+4×155-4×489-4×565) kJ·ml-1=-1 940 kJ·ml-1。
3.根据物质的标准燃烧热数值计算Q放=n(可燃物)×|ΔH|(标准燃烧热)。
已知丙烷的标准燃烧热ΔH=-2 215 kJ·ml-1,若一定量的丙烷完全燃烧后生成1.8 g水,则放出的热量约为A.55 kJ B.220 kJC.550 kJ D.1 108 kJ5
丙烷分子式是C3H8,标准燃烧热为-2 215 kJ·ml-1,且1 ml丙烷完全燃烧会生成4 ml水,放热2 215 kJ,1.8 g水的物质的量为0.1 ml,则消耗丙烷的物质的量为0.025 ml,所以反应放出的热量为0.025 ml×2 215 kJ·ml-1=55.375 kJ,则放出的热量约为55 kJ。
根据如图写出反应CO(g)+2H2(g)===CH3OH(g)的反应热ΔH=_____________。
由图知:CO(g)+2H2(g)===CH3OH(g)的反应热ΔH=(419-510)kJ·ml-1=-91 kJ·ml-1。
-91 kJ·ml-1
5.根据盖斯定律计算将两个或两个以上的热化学方程式包括其ΔH相加或相减,得到一个新的热化学方程式及其ΔH。
CH4—CO2催化重整反应为CH4(g)+CO2(g)===2CO(g)+2H2(g)。已知:C(s)+2H2(g)===CH4(g) ΔH=-75 kJ·ml-1C(s)+O2(g)===CO2(g) ΔH=-394 kJ·ml-1 C(s)+ O2(g)===CO(g) ΔH=-111 kJ·ml-1该催化重整反应的ΔH=_____kJ·ml-1。
将题给三个反应依次编号为①②③:C(s)+2H2(g)===CH4(g) ΔH=-75 kJ·ml-1①C(s)+O2(g)===CO2(g) ΔH=-394 kJ·ml-1②C(s)+ O2(g)===CO(g) ΔH=-111 kJ·ml-1③根据盖斯定律,由③×2-①-②可得CH4(g)+CO2(g)===2CO(g)+2H2(g) ΔH=247 kJ·ml-1。
1.已知葡萄糖的标准燃烧热ΔH=-2 804 kJ·ml-1,当它氧化生成1 g水时放出的热量是A.26.0 kJ B.51.9 kJC.155.8 kJ D.467.3 kJ
葡萄糖标准燃烧热的热化学方程式:C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l) ΔH=-2 804 kJ·ml-1,由此可知,生成6 ml×18 g·ml-1=108 g水放出2 804 kJ热量,则生成1 g水时放出的热量为 ≈26.0 kJ。
2.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1,CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·ml-1。现有H2与CH4的混合气体112 L(标准状况下),使其完全燃烧生成CO2(g)和H2O(l),若实验测得反应放热3 845.8 kJ,则原混合气体中H2与CH4的物质的量之比是A.1∶1 B.1∶3 C.1∶4 D.2∶3
设混合气体中含有x ml H2,则CH4的物质的量为(5-x) ml,则 x+890×(5-x)=3 845.8,得x=1,C项正确。
3.已知:①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=a kJ·ml-1②2C(s)+O2(g)===2CO(g) ΔH2=-220 kJ·ml-1通常人们把拆开1 ml某化学键所消耗的能量看成该化学键的键能。已知H—H、O==O和O—H键的键能分别为436 kJ·ml-1、496 kJ·ml-1和462 kJ·ml-1,则a为A.-332 B.-118 C.350 D.130
根据盖斯定律和焓变与键能的关系解答。根据题中给出的键能可得出热化学方程式:③2H2(g)+O2(g)===2H2O(g) ΔH3=(2×436+496-4×462)kJ·ml-1=-480 kJ·ml-1,题中②2C(s)+O2(g)===2CO(g) ΔH2=-220 kJ·ml-1,根据盖斯定律(②-③)× 得①C(s)+H2O(g)===CO(g)+H2(g) ΔH1=(ΔH2-ΔH3)× ,即a=(-220+480)× =130,选项D正确。
4.(2022·合肥瑶海区月考)已知反应H2(g)+ O2(g)===H2O(g)的能量变化如图所示,下列说法正确的是A.1 ml氢气与0.5 ml氧气的总能量为E1 kJB.H2(g)+ O2===H2O(g) ΔH=E3 kJ·ml-1C.2H2O(g)===2H2(g)+O2(g) ΔH=2(E2- E1) kJ·ml-1D.2 ml氢气与1 ml氧气完全反应生成2 ml液态水放出的热量小于2(E2 -E1) kJ·ml-1
由图可知,E1表示1 ml H2(g)与0.5 ml O2(g)转化为2 ml H(g)与1 ml O(g)时吸收的总能量,即该反应的活化能,不是1 ml氢气与0.5 ml氧气的总能量,故A错误;
由图可知,反应H2(g)+ O2(g)===H2O(g)是放热反应,焓变ΔH=-E3 kJ·ml-1,故B错误;
由图可知,反应H2(g)+ O2(g)===H2O(g)的ΔH=(E1-E2) kJ·ml-1,则2H2(g)+O2(g)===2H2O(g)的ΔH=2(E1-E2) kJ·ml-1,互逆反应的焓变数值相等、符号相反,所以2H2O(g)===2H2(g)+O2(g) ΔH=-2(E1-E2) kJ·ml-1=2(E2-E1) kJ·ml-1,故C正确;
由选项C可知,2H2(g)+O2(g)===2H2O(g)的ΔH=2(E1-E2) kJ·ml-1,H2O(g)转化为H2O(l)的过程放热,则2 ml氢气与1 ml氧气完全反应生成2 ml液态水放出的热量大于2(E2-E1)kJ,故D错误。
二、ΔH的大小比较1.ΔH大小比较时的注意事项ΔH是有符号的,比较时要带着符号比。(1)吸热反应的ΔH为正值,放热反应的ΔH为负值,所以吸热反应的ΔH一定大于放热反应的ΔH。(2)放热反应的ΔH为“-”,所以放热越多,ΔH越小。
2.常见的几种ΔH大小比较方法(1)如果化学计量数加倍,ΔH的绝对值也要加倍例如,H2(g)+ O2(g)===H2O(l) ΔH1=-a kJ·ml-1;2H2(g)+O2(g)===2H2O(l) ΔH2=-b kJ·ml-1,其中ΔH2<ΔH1<0,且b=2a。
(2)同一反应,反应物或生成物的状态不同,反应热不同在同一反应里,反应物或生成物状态不同时,要考虑A(g) A(l) A(s),或者从三状态自身的能量比较:E(g)>E(l)>E(s),可知反应热大小亦不相同。如S(g)+O2(g)===SO2(g) ΔH1=-a kJ·ml-1S(s)+O2(g)===SO2(g) ΔH2=-b kJ·ml-1
(3)晶体类型不同,产物相同的反应,反应热不同如C(石墨,s)+O2(g)===CO2(g) ΔH1=-a kJ·ml-1C(金刚石,s)+O2(g)===CO2(g) ΔH2=-b kJ·ml-1
(4)根据反应进行的程度比较反应热大小①其他条件相同,燃烧越充分,放出的热量越多,ΔH越小,如C(s)+ O2(g)===CO(g) ΔH1;C(s)+O2(g)===CO2(g) ΔH2,则ΔH1>ΔH2。②对于可逆反应,由于反应物不可能完全转化为生成物,所以实际放出(或吸收)的热量小于相应的热化学方程式中的ΔH的绝对值。如:2SO2(g)+O2(g) 2SO3(g) ΔH=-197 kJ·ml-1,向密闭容器中通入2 ml SO2(g)和1 ml O2(g),发生上述反应,达到平衡后,放出的热量小于197 kJ,但ΔH仍为-197 kJ·ml-1。
(5)中和反应中反应热的大小不同①浓硫酸和氢氧化钠固体反应生成1 ml水时,放出的热量一定大于57.3 kJ(浓硫酸稀释和氢氧化钠固体溶解时都会放出热量)。②醋酸和NaOH溶液反应生成1 ml水时,放出的热量一定小于57.3 kJ(醋酸电离会吸热)。③稀硫酸和Ba(OH)2溶液反应生成1 ml水时,反应放出的热量一定大于57.3 kJ( 和Ba2+反应生成BaSO4沉淀会放热)。
1.下列两组热化学方程式中,有关ΔH的比较正确的是①CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH1CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH2②NaOH(aq)+ H2SO4(aq)=== Na2SO4(aq)+H2O(l) ΔH3NaOH(aq)+CH3COOH(aq)===CH3COONa(aq)+H2O(l) ΔH4A.ΔH1>ΔH2;ΔH3>ΔH4B.ΔH1>ΔH2;ΔH3<ΔH4C.ΔH1=ΔH2;ΔH3<ΔH4D.ΔH1<ΔH2;ΔH3>ΔH4
①中两个反应都是放热反应,后者生成液态水,所以放出的热量大于前者,而放热反应ΔH小于0,放热越多,焓变越小,故ΔH1>ΔH2。②中两个反应的实质是酸碱中和,都是放热反应,两个反应生成水的物质的量都是1 ml,但是CH3COOH是弱电解质,电离过程吸收一部分热量,所以后者放出的热量少,所以ΔH3<ΔH4。
2.强酸与强碱的稀溶液发生中和反应:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1。分别向1 L 0.5 ml·L-1的NaOH溶液中加入:①稀醋酸、②浓H2SO4、③稀硝酸,恰好完全反应的反应热分别为ΔH1、ΔH2、ΔH3,它们的关系正确的是A.ΔH1>ΔH2>ΔH3 B.ΔH2<ΔH1<ΔH3C.ΔH1=ΔH2=ΔH3 D.ΔH1>ΔH3>ΔH2
等物质的量的NaOH与稀CH3COOH、浓H2SO4、稀HNO3恰好反应生成等物质的量的水,若不考虑物质的溶解热和弱电解质电离吸热,应放出相同的热量。但在实际反应中,浓H2SO4稀释放热,CH3COOH是弱电解质,电离要吸热,且放热越多,ΔH越小,则ΔH1>ΔH3>ΔH2。
3.(2022·山东日照高二月考)已知弱酸电离时吸热。下列选项中ΔH2>ΔH1的是A.H2(g)+Cl2(g)===2HCl(g) ΔH1 H2(g)+Cl2(g)===2HCl(l) ΔH2B.H2O(l)===H2(g)+ O2(g) ΔH1 2H2(g)+O2(g)===2H2O(l) ΔH2C.S(s)+O2(g)===SO2(g) ΔH1 S(g)+O2(g)===SO2(g) ΔH2D.HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l) ΔH1 HNO3(aq)+NH3·H2O(aq)===NH4NO3(aq)+H2O(l) ΔH2
气态HCl的能量高于液态HCl,所以生成HCl气体放出的热量少,又因为这两个反应的反应热均为负值,故ΔH1>ΔH2,A项不符合题意;水分解反应的反应热为正值,燃烧反应的反应热为负值,即ΔH1>ΔH2,B项不符合题意;气态硫的能量大于固态硫,这两个反应的产物相同,所以气态硫燃烧放出的热量多,又因为这两个反应的反应热均为负值,故ΔH1>ΔH2,C项不符合题意;
一水合氨是弱碱,电离时吸热,则一水合氨与硝酸反应比氢氧化钠与硝酸反应放出的热量少,又因为两反应的反应热均为负值,故ΔH2>ΔH1,D项符合题意。
苏教版 (2019)选择性必修1第一单元 化学反应的热效应教案配套课件ppt: 这是一份苏教版 (2019)选择性必修1第一单元 化学反应的热效应教案配套课件ppt,共15页。PPT课件主要包含了反应热的计算,根据图像计算等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应作业ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1第一单元 化学反应的热效应作业ppt课件,共21页。
化学选择性必修1第一单元 化学反应的热效应集体备课课件ppt: 这是一份化学选择性必修1第一单元 化学反应的热效应集体备课课件ppt,共26页。PPT课件主要包含了学习目标,二盖斯定律,三反应热的计算等内容,欢迎下载使用。













