
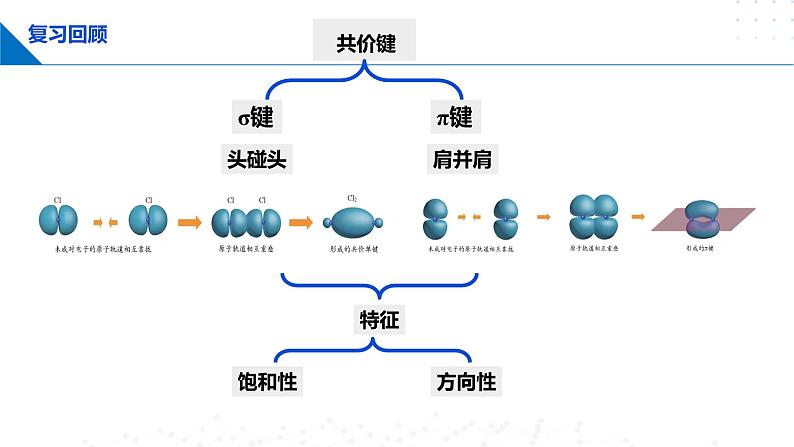


高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构精品课件ppt
展开meiyangyang8602
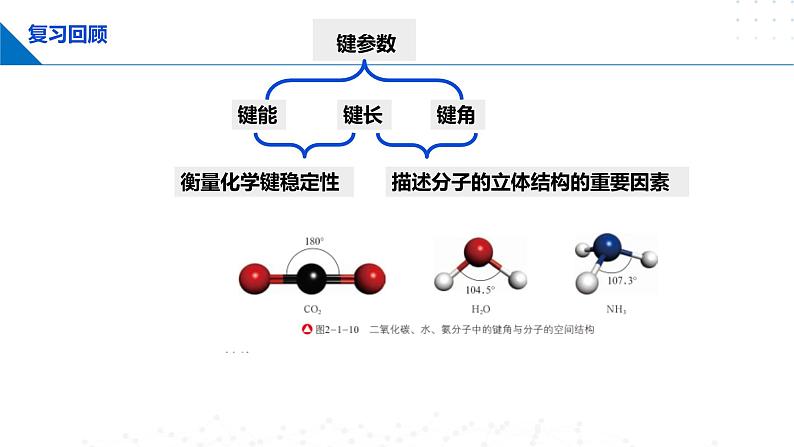
描述分子的立体结构的重要因素
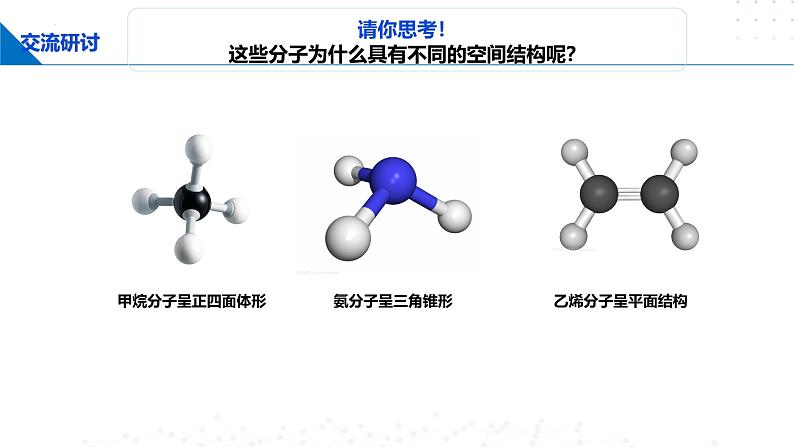
请你思考!这些分子为什么具有不同的空间结构呢?
第二章 微粒间相互作用与物质性质
第 2 节 共价键与分子的空间结构
课时1 分子空间结构的理论分析 杂化轨道理论
通过学习鲍林的杂化轨道理论、价电对互斥理论,学生对分子结构有了深入的认识,既能解释简单分子的空间结构的的成因,也能预测简单分子或离子的空间结构。本节课在此基础上进一步讨论了分子空间结构对分子某些性质的影响。通过对分子空间结构与性质(手性,极性)的讨论,有利于发展学生“结构决定性质”的科学思想,提升化学学科核心素养。。
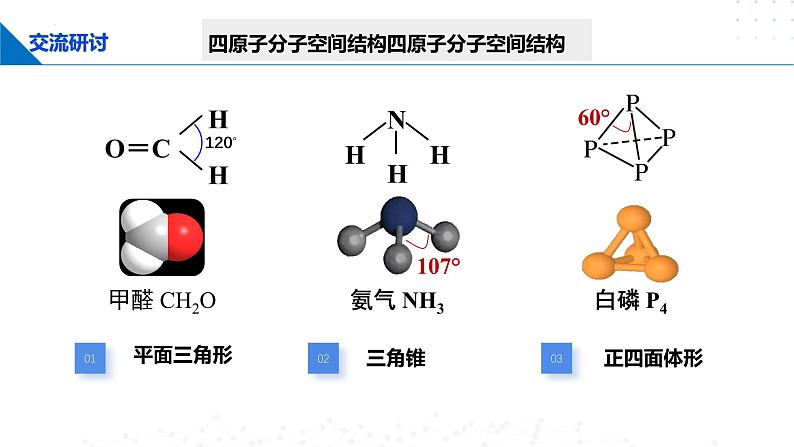
四原子分子空间结构四原子分子空间结构
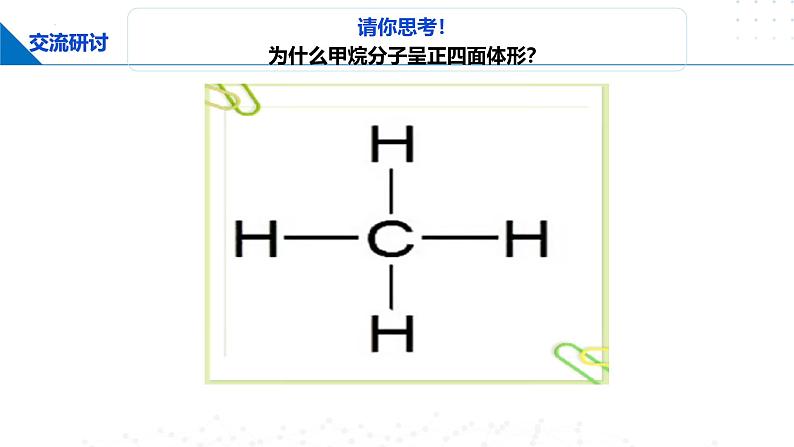
请你思考!为什么甲烷分子呈正四面体形?
请你思考!写出碳原子的价电子轨道表示式,思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
1、根据共价键的饱和性,C应形成几个共价键?
2、形成CH4 C原子应该有几个未成对的电子?怎样才能使C原子具有这个数目的未成对的电子?
3、CH4中的4个C—H键完全相同,碳原子怎样才能有四个完全相同的用于成键的原子轨道?
甲烷分子呈正四面体形,它的4个C—H的键长相同,H—C—H的键角为109°28′。根据价键理论,甲烷的4个C—H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到正四面体形的甲烷分子。
美国化学家鲍林提出的杂化轨道理论很好地解释了甲烷分子的空间结构。
为了解决这一矛盾,1931年由鲍林等人在价键理论的基础上提出杂化轨道理论,它实质上仍属于现代价键理论,但是它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论.
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。我们把这种轨道称之为 sp3杂化轨道。
原子内部能量相近的原子轨道,重新组合形成新的原子轨道的过程。
原子轨道组合杂化后形成的一组新的原子轨道叫做杂化原子轨道,简称杂化轨道。
杂化轨道不仅改变了原有s和p轨道的空间取向,而且使它在与其他原子的原子轨道成键时重叠的程度更大,形成的共价键更牢固。
思维建模一:基态——激发态——杂化
由1个s轨道和3个p轨道的杂化称为sp3杂化,所形成 的四个杂化轨道称为sp3杂化轨道。
每两个sp3杂化轨道的夹角为109°28’。
四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的S-SP3σ键,形成一个正四面体构型的分子。
有几个原子轨道参与杂化,杂化后就生成几个杂化轨道。
sp杂化、sp2杂化、sp3杂化
原子形成分子时,同一个原子中能量相近的一个 ns 轨道与三个 np 轨道进行混合组成四个新的原子轨道称为 sp3 杂化轨道。
sp3杂化轨道特点:四个sp3轨道在空间均匀分布,轨道间夹角109.5°
请你思考! BF3是平面三角形构型, 分子中键角均为120;试用杂化轨道理论加以说明。
在形成BF3分子的过程中,B原子的2s轨道上的1个电子被激发到2p空轨道,价层电子排布为2s12px12py1 ,1个2s轨道和2个2p轨道进行sp2杂化,形成夹角均为1200的3个完全等同的sp2杂化轨道。
同一个原子的一个 ns 轨道与两个 np 轨道进行杂化组合为 sp2 杂化轨道。sp2 杂化轨道间的夹角是120°,分子的几何构型为平面正三角形。
请你思考! 气态BeCl2是直线型分子构型,分子中键角为180 。试用杂化轨道理论加以说明。
在形成BeCl2 分子的过程中,Be原子的1个2s电子被激发到2p空轨道,价层电子排布变为为2s1 2px1 。这2个含有单电子的2s轨道和2px轨道进行sp杂化,组成夹角为1800 的2个能量相同的sp杂化轨道。
同一原子中 ns-np 杂化成新轨道:一个 s 轨道和一个 p 轨道杂化组合成两个新的 sp 杂化轨道。2个sp杂化轨道在一条直线上,轨道间夹角180°
用杂化理论分析分子的形成
请你试试!试用杂化轨道理论分析乙烯和乙炔分子的成键情况
由1个s轨道和2个p轨道混杂并重新组合成3个能量与形状完全相同的轨道。
C原子在形成乙烯分子时,碳原子的2s轨道与2个2p轨道发生杂化,形成3个sp2杂化轨道,伸向平面正三角形的三个顶点。每个C原子的2个sp2杂化轨道分别与2个H原子的1s轨道形成2个相同的σ键,各自剩余的1个sp2杂化轨道相互形成一个σ键,各自没有杂化的l个2p轨道则垂直于杂化轨道所在的平面,彼此肩并肩重叠形成π键。所以,在乙烯分子中双键由一个σ键和一个π键构成。
由1个s轨道和1个p轨道混杂并重新组合成2个能量与形状完全相同的轨道。
两个碳原子的sp杂化轨道沿各自对称轴形成sp-sp 键,另两个sp杂化轨道分别与两个氢原子的1s轨道重叠形成两个sp-s键,每个原子的两个p轨道分别从侧面相互重叠,形成两个相互垂直的P-P键,形成乙炔分子。
请你想想!苯分子中究竟存在怎样的化学键呢?
苯为什么不能使酸性KMnO4溶液或溴的四氯化碳溶液褪色呢?
请你试试!试用杂化轨道理论分析苯分子的成键情况
1、苯中C: sp2杂化 120°
2、六个C 的未参与杂化的p轨道形成大π键
C-C (sp2-sp2 ) σ键6个; C-H (sp2-s ) σ键6个,分子中6个碳原子 未杂 化的2p轨道上 的未成对电子重叠结果形成了一个闭合的、环状的大π键
6个碳原子和6个氢原子在同一平面内,整个分子呈平面正六边形,键角皆为120°。
NH3中N的价电子排布:2s22p3
氮原子的价电子排布为2s22p3,三个2p轨道中各有一个未成对电子,可分别与一个氢原子的1s电子形成一个σ键。如果真是如此,那么三个2p轨道相互垂直,所形成的氨分子中N-H键的键角应约为90°。
而测得氨分子中N—H键的键角为107.3º,与90°矛盾!
请你试试!试解释其键角不是90°的原因,并与同学们交流讨论。
用杂化轨道理论解释氨分子的结构
(2)N-H (sp3-s ) σ键3个
孤对电子对其他电子的排斥能力较强,偏离109.50,而成为107.30。
测得水中O—H键的键角为104.5°。
1、H2O 中Osp3杂化
2、两对孤对电子对对成键电子对的排斥更大,使得键角更小,变成104.5°
1.下列分子中的中心原子杂化轨道的类型相同的是( )A.CO2与SO2 B.CH4与NH3C.BeCl2与BF3 D.C2H2与C2H4
2.下列分子的空间结构可用sp2杂化轨道来解释的是( )①BF3 ②CH2==CH2 ③ ④CH≡CH ⑤NH3 ⑥CH4A.①②③ B.①⑤⑥C.②③④ D.③⑤⑥
3.下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成π键的是( )A.CH≡CH D.BF3
4.下列有关甲醛(HCHO)分子的说法正确的是( )①C原子采取sp杂化 ②甲醛分子为三角锥形结构③C原子采取sp2杂化 ④甲醛分子为平面三角形结构A.①② B.②③ C.③④ D.①④
请你思考!请从轨道重叠的角度解释氮分子中的共价三键是如何形成的。
氮气的电子式和结构式分别如下:
氮气分子中p轨道的成键情况
氮分子的 N≡N 中有一个 σ 键、两个 π 键,如图 2-1-4 所示
判断σ键、π键的一般规律
共价单键为____键;
共价双键中有一个____键、一个____键;
共价三键由一个_____键和两个______键组成。
请你判断一下氧分子原子轨道成键类型?
根据价键理论,氧分子的结构是 O=O,这样的氧分子中的电子已经完全配对,氧分子应当是逆磁性分子。
但事实上,将液态氧倒入配有磁铁的仪器中时,氧分子被磁场吸引而悬浮在磁场中(图2-1-5)。这说明氧分子是顺磁性分子,即分子中存在着未成对电子。
利用分子轨道理论能够很好地解释氧分子是顺磁性分子这一事实。
分子轨道理论认为,分子中的每个电子都是在整个分子中运动的,分子中的单电子运动状态可以用分子轨道来描述。
图2-1-6(a)给出了氧分子的分子轨道能级和电子排布示意图(仅画出12个外层电子的占据轨道),按照核外电子排布的三个原则,最高能量的两个电子根据洪特规则以自旋方向相同的方式分占能量相同的两个π*2p分子轨道,这样氧分子存在未成对电子,所以具有顺磁性。
H2和HCl都是原子通过共用电子对形成的,为什么HCl中H显+1价、Cl显-1价,而H2中的原子却不显电性?
共用电子对偏移(偏向Cl而偏离H)
2. 极性键和非极性键
定义: 构成分子的是同种元素的两个原子,它们吸引电子的能力相同,所以共用的电子不偏向其中任何一个原子,参与成键的原子都不显电性,这种共价键叫作非极性共价键,简称非极性键。
特征: 共用的电子不偏向其中任何一个原子,参与成键的原子都不显电性
形成条件: 同种元素的原子之间,成键原子电负性相同
定义: 构成分子的两个原子是不同元素的原子时,由于两个原子吸引电子的能力不同,共用的电子必然偏向吸引电子能力大的原子一方,这个原子因附近电子出现的概率较大而带部分负电荷,而另一原子则带部分正电荷,这种共价键叫作极性共价键,简称极性键。
特征: 共用的电子偏向吸引电子能力大的原子一方,成键原子显电性
形成条件: 非同种元素的原子之间,成键原子电负性不相同
分子中共价键的极性强弱会影响物质的性质,由此键的极性成为解释和预测物质性质、判断反应活性部位和反应产物的常用工具。例如,乙醇与乙酸的酯化反应中,断键和成键发生在极性强的部位
请你思考!原子形成的分子为什么会有不同的空间结构?
球棍模型可以形象的展示出分子的空间结构和成键情况
两个成键原子的原子核间的距离(简称核间距)
一般而言,化学键的键长愈短,化学键就愈强,键就愈牢固。
影响分子空间结构的因素之一
在多原子分子中,两个化学键的夹角
用于描述多原子分子的空间结构
NH3 H2O CO2 CH4
107°18' 104.5° 180° 104°28'
键长,键角决定分子空间构型
HCl、HBr和HI中的化学键均为共价键,其稳定性存在一定的差异,那么,如何进行比较呢?
键长越短,共价键越稳定
在 101.3 kPa、298 K 条件下,断开1ml AB(g)分子中的化学键,使其分别生成气态A原子和气态B原子所吸收的能量称为A—B键的键能。
表示方法:EA—B 单位:kJ·ml-1
应用:定量地表示化学键的强弱
键能愈大,断开时需要的能量就愈多,化学键就愈牢固;键能愈小,断开时需要的能量就愈少,化学键就愈不牢固。
键长越短,键能越大,分子越稳定
请同学们观察下表,并找出键能数据中存在的规律?(从成键个数,成键原子的半径分析)
形成共价键的原子的原子半径越大,键能越小
成键原子相同,单键的键能<双键的键能<三键的键能
紫外光为什么会对人体有害
定义:分子从一种能级改变到另一种能级时吸收或发射的光谱。
影响因素:分子内部的运动;分子中键长、键角、电荷分布等
应用:测定和鉴别分子结构、测定物质浓度
分类:远红外光谱或微波谱 红外光谱 紫外—可见光谱
分子中电子在不同能级的分子轨道间跃迁
3,气态原子生成+1价气态阳离子所需要的能量称为第一电离能。元素的第一电离能是衡量元素金属性强弱的一种尺度。下列有关说法不正确的是( )A.一般来说,元素的第一电离能越大,其金属性越弱B.元素N的第一电离能大于元素O的第一电离能C.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关D.金属单质跟酸反应的难易,除跟该金属元素的第一电离能有关外,还与该单质中固态金属原子以及该金属原子失去电子后在水溶液里形成水合离子的变化有关
基态锂原子的电子排布式为 1s22s1
基态铍原子的电子排布式为 1s22s2
对于Li和Be,当1s能级填满之后,电子优先填入能量较低的2s能级,直至填满。
对于B至Ne元素,在1s、2s能级填满后,电子填入 2p能级,直至2p能级填满。
电子排布式是表示原子核外电子排布的一种方式。在ns、np、nd等符号的右上角用数字表示出电子的数目。
1s22s22p63s23p5
需要强调的是,原子中的核外电子是不可区分的,实际上人们并不能确定哪个电子排布在哪个原子轨道上。给出核外电子排入各原子轨道的顺序及探讨基态原子的核外电子排布,仅仅是为了给学习和研究提供方便。
对于B,在1s、2s能级填满后,电子填入 2p能级,直至2p能级填满。
有 种空间运动状态,有 种运动状态不同的电子。
由于三个p轨道的能量完全一样,那么,你认为p轨道上的两个电子应当采取以下排布方式中的哪种方式呢?
根据能量最低原理和泡利不相容原理,可以推断基态碳原子的核外电子排布式为 1s²2s²2p²。
基态原子的核外电子排布规律
洪特(F.Hund)在研究了大量原子光谱后总结出一个规律:对于基态原子,核外电子在能量相同的原子轨道上排布时,将尽可能分占不同的原子轨道并且自旋状态相同。这就是原子核外电子在原子轨道上排布所遵循的第三个原则——洪特规则(Hund’s rule)。
使体系的总能量达到最低。
请你思考!19 ~36号元素基态原子的核外电子排布
当4s能级填满后,下一个电子应该填充在哪个能级?
Ca:1s22s22p63s23p64s2
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
基态原子核外电子在原子轨道上的排布顺序如图 1-2-4 所示,它表示随着原子序数的递增,基态原子的“外层电子”按照箭头的方向依次排布在各原子轨道上:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p、6s……这一规律称为构造原理。
值得指出的是,图 1-2-4 只是给出了基态原子外层电子在原子轨道上排布的规律,即只有原子最外层电子在原子轨道上填充时才出现先填 ns 轨道再填 (n-1) d 轨道。但这一顺序并不代表电子填充后在原子中各原子轨道的能级高低顺序。例如,对于ns和(n-1)d 轨道都填有电子的原子,在许多情况下 (n-1)d 轨道的电子能量更低。
请你总结!19 ~36号元素基态原子的核外电子排布
K:1s22s22p63s23p64s1、 Ca:1s22s22p63s23p64s2、 Sc:1s22s22p63s23p63d14s2、 Ti:1s22s22p63s23p63d24s2、V:1s22s22p63s23p63d34s2、 Cr:1s22s22p63s23p63d54s1、 Mn:1s22s22p63s23p63d54s2、 Fe:1s22s22p63s23p63d64s2、C:1s22s22p63s23p63d74s2、 Ni:1s22s22p63s23p63d84s2、 Cu:1s22s22p63s23p63d104s1、 Zn:1s22s22p63s23p63d104s2、Ga:1s22s22p63s23p63d104s24p1、 Ge:1s22s22p63s23p63d104s24p2、As:1s22s22p63s23p63d104s24p3Se:1s22s22p63s23p63d104s24p4、Br:1s22s22p63s23p63d104s24p5、 Kr:1s22s22p63s23p63d104s24p6。
Cr:1s22s22p63s23p63d44s2、
Cu:1s22s22p63s23p63d94s2、
核外电子总是尽可能先排布在能量最低的电子层上
然后由内向外依次排布在能量较高的电子层上
每层最多容纳2n2个电子
最外层不能超过8个电子(第一层为最外层时不超过2个)
次外层不能超过18个电子
后来经过英国物理学家狄拉克的发展,该理论成为一门相对完整的、即量子力学。
量子力学是目前解决低能量的微观粒子问题的最佳理论。近代量子力学不仅揭示了原子结构、放射性、化学键以及原子光谱的实质,而且与其他理论(如相对论)相结合,成功地解释了核结构与核反应、固体的电性与热性、超导性、物质的基本粒子的产生与湮灭、反物质的存在、某些坍塌恒星的稳定性等问题。该理论的产生同时促进了包括电子显微镜、顺磁共振仪、激光器、晶体管和扫描隧道显微镜在内的许多先进仪器及相应实用技术的快速发展。
量子力学对原子核外电子运动状态的描述
薛定谔方程与四个量子数
①主量子数n: 描述电子离核的远近. n取值为正整数1,2,3,4,5,6… 对应符号为 K,L,M,N,O,P… 习惯上,将 n 所描述的电子运动状态称为电子层
n越大,电子离核的平均距离越远,电子具有能量越高
②角量子数l :描述(电子云)原子轨道的形状. l 取值为 0,1,2,3… (n-1).共n个数值. 符号为 s, p(3个:px、py、pz),d(5个),f(7个)等.若电子的能层n、 能级l 的相同,则电子的能量相同.在一个电子层中,l 的取值有多少个,表示电子层有多少个不同的能级.
规律: 每层的能级数值=电子层数
(3)同一能级又可能包含几个空间取向不同的原子轨道,s能级中有1个原子轨道、p能级中有3个能量相同的原子轨道,分别记作“npx、npy、npz”,d能级中有5个能量相同的原子轨道。
2. 原子轨道的图形描述
原子中单个电子的空间运动状态用原子轨道来描述,而原子轨道在量子力学中用波函数来表示,并可以将其以图形的方式在直角坐标系中呈现出来。
p 轨道在三维空间分布的图形与 s 轨道明显不同,它的空间分布特点是分别相对于 x、y、z 轴对称,也就是说,p 轨道在空间分别沿 x、y、z 轴的方向分布。
d 轨道(l = 2, m = +2, +1, 0, -1, -2) m 五种取值, 空间五种取向, 五条等价(简并) d 轨道.
f 轨道 ( l = 3, m = +3, +2, +1, 0, -1, -2, -3 ) m 七种取值, 空间七种取向, 七条等价(简并) f 轨道.
请你思考!原子轨道可以用波函数来表示,那么,又该如何理解波函数?怎样形象地描述电子在空间中的运动与分布呢?
3. 电子在核外的空间分布
与对宏观物体运动的描述不同,对于质量非常小、运行速度极快且运动空间极小的微观粒子而言,人们不可能同时准确地测定它的位置和速度,但能通过对波函数进行数学处理计算出电子在什么地方出现的概率大、在什么地方出现的概率小。
3.电子在核外的空间分布
这种形象地描述电子在核外空间某处单位体积内的概率分布的图形称为电子云图。
(1)点密集的地方,表示电子在此处单位体积内出现的概率大;(2)点稀疏的地方,表示电子在此处单位体积内出现的概率小
电子云图很难绘制,使用不方便
把电子出现概率90%空间圈出来
氢原子核外电子的电子云呈球形对称
化学选修3 物质结构与性质第二章 分子结构与性质第二节 分子的立体构型优秀课件ppt: 这是一份化学选修3 物质结构与性质<a href="/hx/tb_c22148_t3/?tag_id=26" target="_blank">第二章 分子结构与性质第二节 分子的立体构型优秀课件ppt</a>,共26页。PPT课件主要包含了杂化轨道理论,第2课时,新问题1,新问题2,C2s22p2,杂化理论简介,杂化轨道分类,CH4原子轨道杂化,H2O原子轨道杂化,杂化类型判断等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构优秀ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002447_t3/?tag_id=26" target="_blank">第二节 分子的空间结构优秀ppt课件</a>,文件包含人教版2019高中化学必修二222《杂化轨道理论简介》课件pptx、杂化轨道形成过程动画mp4、课后拓展mp4等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
高中鲁科版 (2019)第2节 共价键与分子的空间结构背景图课件ppt: 这是一份高中鲁科版 (2019)<a href="/hx/tb_c4002602_t3/?tag_id=26" target="_blank">第2节 共价键与分子的空间结构背景图课件ppt</a>,共60页。PPT课件主要包含了教材分析,杂化轨道理论,谢谢观看,键参数,量子力学的诞生,纺锤形,本章小结,第一部分,课堂导入等内容,欢迎下载使用。













