
2021学年第2章 微粒间相互作用与物质性质第2节 共价键与分子的空间结构学案及答案
展开一、分子中的原子排布与对称性
1.对称分子
(1)概念
依据对称轴的旋转或借助对称面的反映能够复原的分子。
(2)性质
具有对称性。
(3)与分子性质的关系
分子的许多性质如极性、旋光性等都与分子的对称性有关。
(1)什么是对称轴?举例说明?
提示:以甲烷分子为例,以通过碳原子和氢原子的连线为轴旋转120°或240°时,分子完全恢复原状,我们称这条连线为对称轴。
(2)什么是对称面?举例说明。
提示:以甲烷分子为例,通过碳原子和其中两个氢原子所构成的平面,分子被分割成相同的两部分,我们称这个平面为对称面。
2.手性分子
(1)所有的分子都有一定的对称性。( )
(2)对称分子都具有旋光性。( )
(3)对称分子与物质化学性质有关。( )
[答案] (1)× (2)× (3)×
二、分子中的电荷分布与极性
1.分子极性的实验探究
2.极性分子和非极性分子
3.分子极性的判断
(1)
(2)
NH3、CH4、H2O、CO2四种分子正、负电荷重心重合的是哪些?正、负电荷重心不重合的是哪些?
提示:NH3、CH4、H2O、CO2四种分子正、负电荷重心重合的是CH4和CO2,正、负电荷重心不重合的是NH3、H2O。
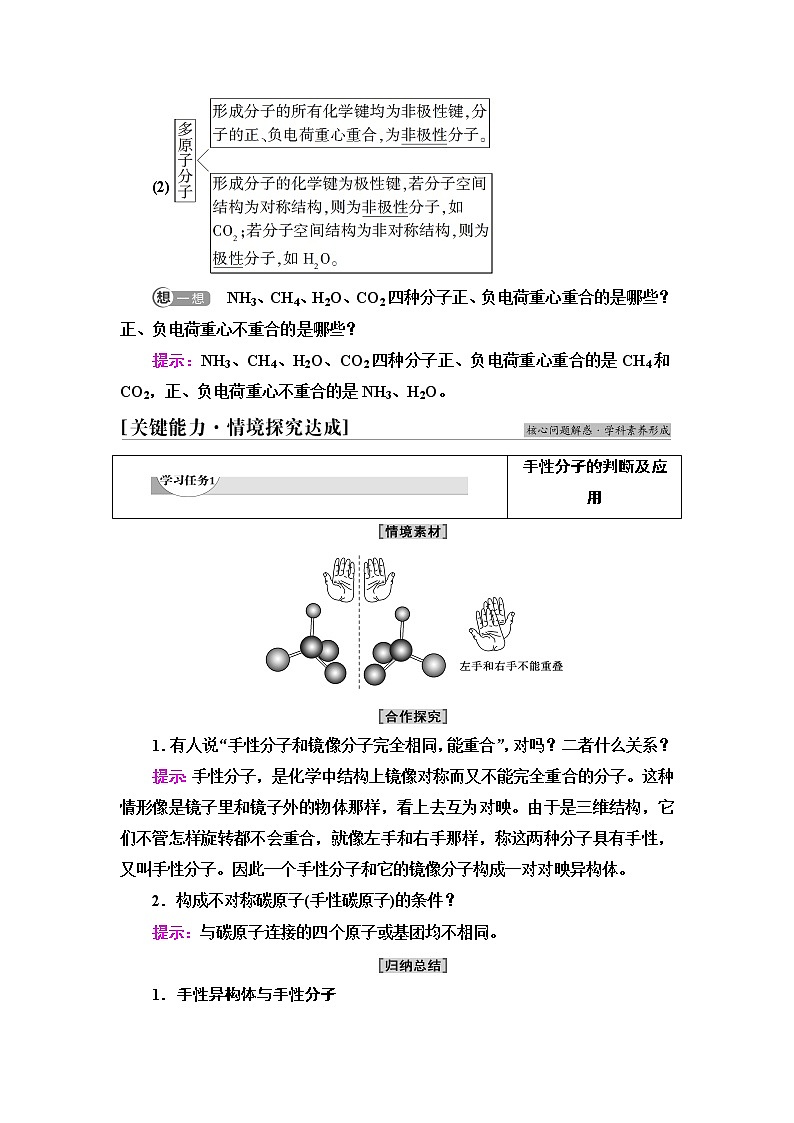
1.有人说“手性分子和镜像分子完全相同,能重合”,对吗?二者什么关系?
提示:手性分子,是化学中结构上镜像对称而又不能完全重合的分子。这种情形像是镜子里和镜子外的物体那样,看上去互为对映。由于是三维结构,它们不管怎样旋转都不会重合,就像左手和右手那样,称这两种分子具有手性,又叫手性分子。因此一个手性分子和它的镜像分子构成一对对映异构体。
2.构成不对称碳原子(手性碳原子)的条件?
提示:与碳原子连接的四个原子或基团均不相同。
1.手性异构体与手性分子
具有完全相同的组成和原子排列的一对分子,如同左手与右手一样互为镜像,却在三维空间里不能重叠,互称为手性异构体。有手性异构体的分子叫做手性分子。
2.手性分子的成因
当四个不同的原子或基团连接在同一个碳原子上时,这个碳原子是不对称碳原子。这种分子和它“在镜中的像”就不能重叠,因而表现为“手性”。手性分子中的不对称碳原子称为手性碳原子。例如,CHBrClF是一个简单的手性分子,如图1所示的两个分子互为镜像。又如,丙氨酸分子(手性碳原子上连接—H、—CH3、—NH2、—COOH)的手性如图2所示。
3.手性合成
生产手性药物必须把手性异构体分离开,因为手性异构体药物分子中往往是一种能治病、没有毒副作用,而另一种却有毒副作用。按照获得2001年诺贝尔化学奖的三位科学家的合成方法,可以只得到一种或者主要只得到一种手性分子,不得到或者基本上不得到它的手性异构体,这种独特的合成方法称为手性合成。手性催化剂只催化或者主要催化一种手性分子的合成。手性分子在生命科学和生产手性药物方面有广泛的应用。手性合成是当代化学的热点之一,是21世纪化学研究的重要领域。
分子是否表现手性的判断
分子表现手性,是因为其含有手性碳原子。如果一个碳原子所连接的四个原子或基团各不相同,那么该碳原子称为手性碳原子,用*C来表示。例如,R1、R2、R3、R4是互不相同的原子或基团。所以,判断一种有机物分子是否具有手性,就看其含有的碳原子是否连有四个不同的原子或基团。
1.下列物质的分子不具有对称性的是( )
A.CH3Cl B.CH2Cl2 C.CH2ClBr D.CH3CH(Cl)Br
D [当一个碳原子所连接的四个原子或基团都不相同时,这个碳原子为手性碳原子,具有手性碳原子的分子既没有对称轴,也没有对称面,是不对称分子,没有对称性。D项中物质分子的结构可表示为,没有对称性。]
2.某研究性学习小组对手性分子提出了以下四个观点:
①互为手性异构体的分子互为镜像
②利用手性催化剂合成可得到一种或主要得到一种手性分子
③互为手性异构体的分子组成相同
④手性异构体的性质相同
你认为正确的是( )
A.①②③ B.①②④ C.②③④ D.全部
A [互为手性异构体的分子结构不同,性质不同,故④错误,①②③均正确。]
PH3又称磷化氢,在常温下是一种无色、有大蒜气味的气体,电石气的杂质中常含有它。它的结构与NH3分子结构相似。如果遇到痕量其他磷的氢化物如乙磷化氢,会引起自燃。磷化氢按照高毒性且自燃的气体处理。吸入磷化氢会对心脏、呼吸系统、肾、肠胃、神经系统和肝脏造成影响。
PH3分子及其空间结构
1.PH3分子的中心磷原子的杂化类型是什么?空间结构是什么?
提示:根据杂化轨道的判断方法可知,PH3分子的中心磷原子的杂化类型为sp3杂化;根据价电子对互斥理论,由于磷原子有1对孤电子对,所以其空间结构是三角锥形。
2.PH3分子中的P—H键是何种共价键?该分子是极性分子还是非极性分子?
提示:PH3分子中的P—H键是极性键,PH3是极性分子。
1.根据分子的对称性判断
分子结构对称,正电荷重心和负电荷重心重合,则为非极性分子,正、负电荷重心不重合,则为极性分子。
2.根据键的极性判断
3.判断ABn型分子极性的经验规律
(1)化合价法:若中心原子A的化合价的绝对值等于该元素所在的主族序数,则为非极性分子,否则为极性分子。
(2)孤电子对法:若中心原子有孤电子对则为极性分子,否则为非极性分子。如BF3、CO2等为非极性分子,NH3、H2O、SO2等为极性分子。
4.常见分子极性与非极性的判断
1.(2021·贵州普定一中期中考试)已知BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,则BeCl2属于( )
A.由极性键构成的极性分子
B.由极性键构成的非极性分子
C.由非极性键构成的极性分子
D.由非极性键构成的非极性分子
B [BeCl2中Be—Cl键是不同元素形成的共价键,为极性键,两个Be—Cl键间的夹角为180°,说明分子是对称的,正电荷重心与负电荷重心重合,BeCl2属于非极性分子,故BeCl2是由极性键构成的非极性分子,B项正确。 ]
2.相似相溶规律:一般来说,由极性分子组成的溶质易溶于极性分子组成的溶剂,非极性分子组成的溶质易溶于非极性分子组成的溶剂。以下事实不能用相似相溶规律解释的是( )
A.HCl易溶于水 B.I2易溶于CCl4
C.Cl2可溶于水 D.NH3难溶于苯
C [Cl2为非极性分子,H2O为极性分子,Cl2可溶于水不能用相似相溶规律解释。]
1.下图中两分子的关系是( )
A.互为同分异构体 B.是同一种物质
C.是手性分子 D.互为同系物
B [本题很容易看成为镜面对称结构而选择手性分子,但根据手性分子的判断方法,根本找不到手性碳原子,所以不是手性分子;分子相同,结构相同,是同一种物质。]
2.下列分子含有手性碳原子,属于手性分子的是( )
C [抓住“手性”的含义,碳原子上连接有四个不同的原子或原子团,即为手性碳原子。]
3.下列说法正确的是( )
A.由极性键构成的分子都是极性分子
B.含非极性键的分子一定是非极性分子
C.极性分子一定含有极性键,非极性分子一定含有非极性键
D.以极性键结合的双原子分子一定是极性分子
D [由极性键构成的分子若空间结构均匀对称,则分子是非极性分子,A项说法错误;含非极性键的分子也可能含有极性键,分子也可能是极性分子,如CH3CH2OH等,B项说法错误;CO2是由极性键形成的非极性分子,C项说法错误;以极性键结合的双原子分子都是极性分子,D项说法正确。]
4.用一带静电的有机玻璃棒分别靠近A、B两种纯液体流,现象如图所示,下列关于A、B两种液体分子的极性判断正确的是( )
A.A是极性分子,B是非极性分子
B.A是非极性分子,B是极性分子
C.A、B都是极性分子
D.A、B都是非极性分子
B [有机玻璃棒带电,靠近纯液体流后B液体流发生偏移,说明液体B的分子有极性,故A是非极性分子,B是极性分子。]
5.在HF、H2O、NH3、CS2、CH4、N2分子中:
(1)以非极性键结合的非极性分子是________。
(2)以极性键结合的具有直线形结构的非极性分子是________________。
(3)以极性键结合的具有正四面体形结构的非极性分子是________________。
(4)以极性键结合的具有三角锥形结构的极性分子是____________________。
(5)以极性键结合的具有sp3杂化轨道结构的分子是__________________。
[解析] HF是含有极性键的双原子分子,为极性分子;H2O中氧原子采取sp3杂化方式,与氢原子形成极性键,为极性分子;NH3中有极性键,氮原子采取sp3杂化,三角锥形结构;CS2与CO2相似,以极性键结合的直线形非极性分子;CH4中碳原子采取sp3杂化方式与氢原子形成极性键,正四面体结构,非极性分子;N2是由非极性键结合的非极性分子。
[答案] (1)N2 (2)CS2 (3)CH4 (4)NH3 (5)NH3、H2O、CH4
学习任务
1.知道分子可以分为极性分子和非极性分子,知道分子极性与分子中键的极性、分子的空间结构密切相关。 2.结合实例初步认识分子的手性对其性质的影响。培养宏观辨识与微观探析的核心素养。
旋光性
在光通过某些化合物时,光波振动的方向会旋转一定的角度,这种性质称为旋光性
手性
具有旋光性的分子本身和它们在镜中的像,就如同人的左手和右手,相似但不能重叠,因而称这类分子表现出手性
手性分子
具有手性的分子叫作手性分子
不对称
碳原子
对于仅通过单键连接其他原子的碳原子,当其所连接的四个原子或基团均不相同时,这个碳原子称为不对称碳原子
应用
①手性分子缩合制蛋白质和核酸。
②分析药物有效成分异构体的生物活性和毒副作用。
③药物的不对称合成。
实验
操作
在酸式滴定管中加入四氯化碳,打开活塞让四氯化碳缓缓流下,将用毛皮摩擦过的橡胶棒靠近四氯化碳液流
再向另一酸式滴定管中加入蒸馏水,打开活塞让四氯化碳缓缓流下,并将用毛皮摩擦过的橡胶棒靠近四氯化碳液流
现象
四氯化碳液流方向不变
水流方向发生改变
结论
四氯化碳液流与橡胶棒之间无电性作用
水流与橡胶棒之间有电性作用
解释
四氯化碳分子中无正极和负极之分
水分子中存在正、负两极
类别
极性分子
非极性分子
概念
分子内存在正、负两极的分子
分子内不存在正、负两极的分子
双原子
分子
分子内含极性键
分子内含非极性键
多原子
分子
分子内含极性键,分子空间结构不对称
分子内只含非极性键或分子空间结构对称
手性分子的判断及应用
判断分子极性的方法
分子类型
键的极性
分子对
分子极性
代表物
双原子分子
A2
非极性键
直线形
(对称)
非极性
H2、O2、
Cl2、N2等
AB
极性键
直线形
(不对称)
极性
HF、HCl、
CO、NO等
三原子分子
A2B(或
AB2)
极性键
直线形
(对称)
非极性
CO2、CS2等
(键角180°)
极性键
角形
(不对称)
极性
H2O(键角
104.5°)、
SO2(键角
119.5°)等
四原子分子
AB3
极性键
平面三角形
(对称)
非极性
BF3、
BCl3等
极性键
三角锥形
(不对称)
极性
NH3(键角
107.3°)等
五原子分子
AB4
极性键
正四面体形
(对称)
非极性
CH4、CCl4
(键角
109°28′)等
ABnC4-n
(n<4且
为整数)
极性键
四面体形
(不对称)
极性
CHCl3、
CH2Cl2等
鲁科版 (2019)选择性必修2第2章 微粒间相互作用与物质性质第2节 共价键与分子的空间结构第3课时导学案: 这是一份鲁科版 (2019)选择性必修2第2章 微粒间相互作用与物质性质第2节 共价键与分子的空间结构第3课时导学案,共7页。
高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构第2课时学案设计: 这是一份高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构第2课时学案设计,共13页。
高中化学第2节 共价键与分子的空间结构第1课时导学案: 这是一份高中化学第2节 共价键与分子的空间结构第1课时导学案,共16页。学案主要包含了选择题,非选择题等内容,欢迎下载使用。













