

化学选修3 物质结构与性质第二章 分子结构与性质第二节 分子的立体构型优秀课件ppt
展开第二节 分子的立体结构
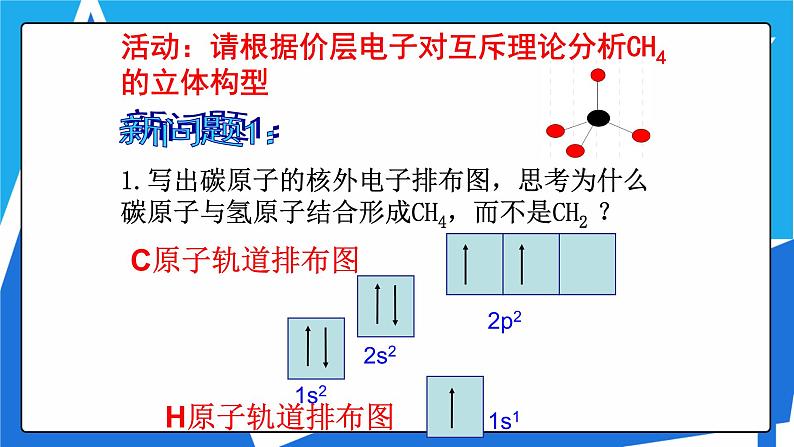
活动:请根据价层电子对互斥理论分析CH4的立体构型
1.写出碳原子的核外电子排布图,思考为什么碳原子与氢原子结合形成CH4,而不是CH2 ?
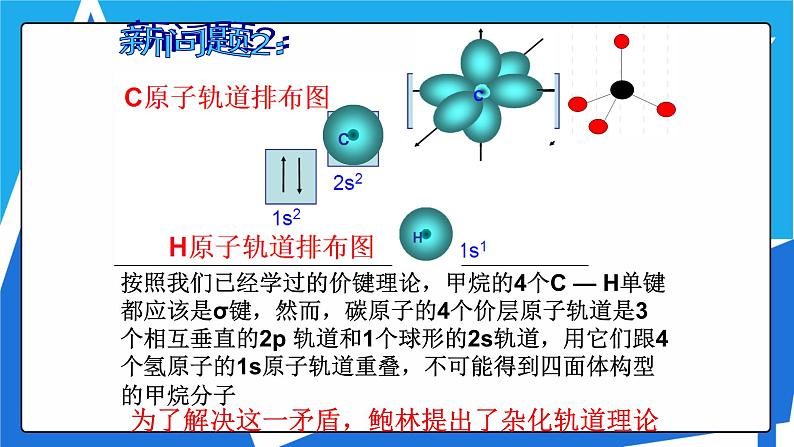
按照我们已经学过的价键理论,甲烷的4个C — H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p 轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子
为了解决这一矛盾,鲍林提出了杂化轨道理论
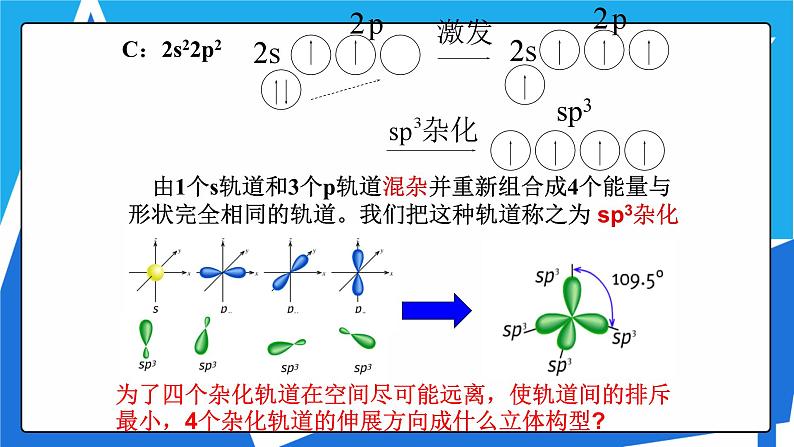
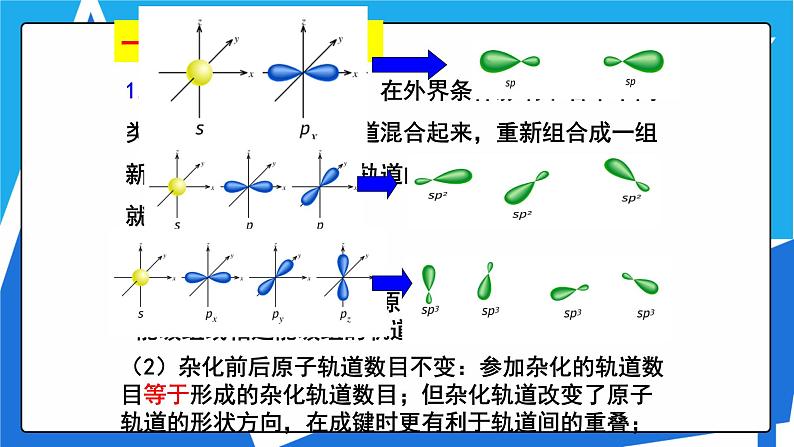
由1个s轨道和3个p轨道混杂并重新组合成4个能量与形状完全相同的轨道。我们把这种轨道称之为 sp3杂化轨道。
为了四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,4个杂化轨道的伸展方向成什么立体构型?
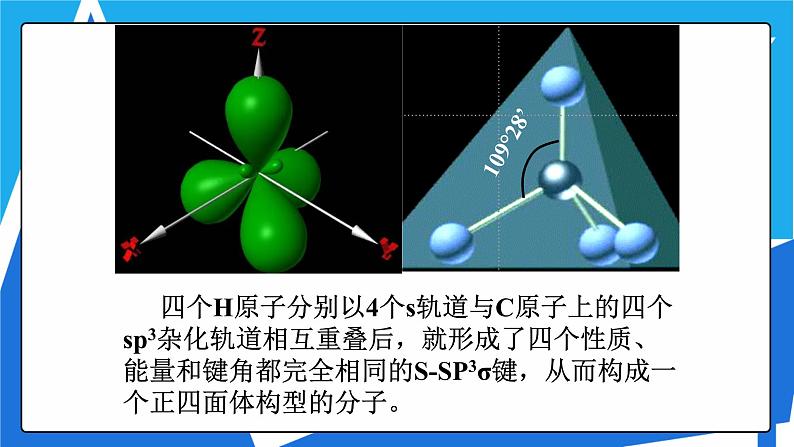
四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,就形成了四个性质、能量和键角都完全相同的S-SP3σ键,从而构成一个正四面体构型的分子。
1.概念:在形成分子时,在外界条件影响下若干不同类型能量相近的原子轨道混合起来,重新组合成一组新轨道的过程叫做原子轨道的杂化,所形成的新轨道就称为杂化轨道。
(1)参与参加杂化的各原子轨道能量要相近(同一能级组或相近能级组的轨道);
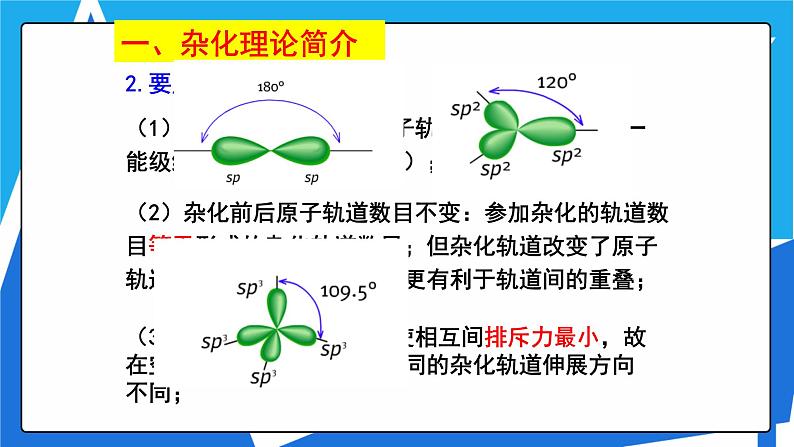
(2)杂化前后原子轨道数目不变:参加杂化的轨道数目等于形成的杂化轨道数目;但杂化轨道改变了原子轨道的形状方向,在成键时更有利于轨道间的重叠;
(3)杂化前后原子轨道为使相互间排斥力最小,故在空间取最大夹角分布,不同的杂化轨道伸展方向不同;
sp杂化轨道的形成过程
每个sp杂化轨道的形状为一头大,一头小,含有1/2 s 轨道和1/2 p 轨道的成分两个轨道间的夹角为180°,呈直线型
sp 杂化:1个s 轨道与1个p 轨道进行的杂化, 形成2个sp杂化轨道。
例如: Sp 杂化 —— BeCl2分子的形成
Be原子:1s22s2 没有单个电子,
sp2杂化轨道的形成过程
每个sp2杂化轨道的形状也为一头大,一头小,含有 1/3 s 轨道和 2/3 p 轨道的成分。 每两个轨道间的夹角为120°,呈平面三角形。
sp2杂化:1个s 轨道与2个p 轨道进行的杂化, 形成3个sp2 杂化轨道。
例如: Sp2 杂化 —— BF3分子的形成
B: 1s22s22p1没有3个成单电子
sp3杂化轨道的形成过程
sp3杂化:1个s 轨道与3个p 轨道进行的杂化,形成4个sp3 杂化轨道。
每个sp3杂化轨道的形状也为一头大,一头小, 含有 1/4 s 轨道和 3/4 p 轨道的成分 每两个轨道间的夹角为109.5°, 空间构型为正四面体型
例如: Sp3 杂化 —— CH4分子的形成
等性杂化:参与杂化的各原子轨道进行成分的均匀混合。 杂化轨道 每个轨道的成分 轨道间夹角( 键角) sp 1/2 s,1/2 p 180° sp2 1/3 s,2/3 p 120° sp3 1/4 s,3/4p 109°28′
O原子:2s22p4 有2个单电子,可形成2个共价键,键角应当是90°,Why?
不等性杂化:参与杂化的各原子轨道进行成分上的 不均匀混合。某个杂化轨道有孤电子对
排斥力:孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对
因为杂化轨道只能用于形成σ键或用来容纳孤电子对,故有
杂化类型的判断方法:先确定分子或离子的VSEPR模型,然后就可以比较方便地确定中心原子的杂化轨道类型。
=中心原子孤对电子对数+中心原子结合的原子数
杂化轨道数=中心原子价层电子对数
对于ABm型分子或离子,其中心原子A的杂化轨道数恰好与A的价电子对数相等。
正四面体三角锥形或V形
例1:计算下列分子或离子中的价电子对数,并根据已学填写下表
例2:对SO2与CO2说法正确的是( )A.都是直线形结构B.中心原子都采取sp杂化轨道C. S原子和C原子上都没有孤对电子D. SO2为V形结构, CO2为直线形结构
试用杂化轨道理论分析乙烯和乙炔分子的成键情况
C原子在形成乙烯分子时,碳原子的2s轨道与2个2p轨道发生杂化,形成3个sp2杂化轨道,伸向平面正三角形的三个顶点。每个C原子的2个sp2杂化轨道分别与2个H原子的1s轨道形成2个相同的σ键,各自剩余的1个sp2杂化轨道相互形成一个σ键,各自没有杂化的l个2p轨道则垂直于杂化轨道所在的平面,彼此肩并肩重叠形成π键。所以,在乙烯分子中双键由一个σ键和一个π键构成。
C原子在形成乙炔分子时发生sp杂化,两个碳原子以sp杂化轨道与氢原子的1s轨道结合形成σ键。各自剩余的1个sp杂化轨道相互形成1个σ键,两个碳原子的未杂化2p轨道分别在Y轴和Z轴方向重叠形成π键。所以乙炔分子中碳原子间以叁键相结合。
大π 键 C6H6
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构优秀ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002447_t3/?tag_id=26" target="_blank">第二节 分子的空间结构优秀ppt课件</a>,文件包含人教版2019高中化学必修二222《杂化轨道理论简介》课件pptx、杂化轨道形成过程动画mp4、课后拓展mp4等3份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构评课ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2<a href="/hx/tb_c4002602_t3/?tag_id=26" target="_blank">第2节 共价键与分子的空间结构评课ppt课件</a>,共20页。PPT课件主要包含了饱和性,方向性,头碰头,肩并肩,复习回顾,共价键,鲍林杂化轨道理论,交流研讨,杂化轨道理论,基态碳原子等内容,欢迎下载使用。
高中第二节 分子的空间结构集体备课课件ppt: 这是一份高中第二节 分子的空间结构集体备课课件ppt,共18页。PPT课件主要包含了课前导入,CH4的形成,杂化轨道理论简介,杂化轨道类型,杂化类型判断方法等内容,欢迎下载使用。














