



鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构优质课件ppt
展开meiyangyang8602
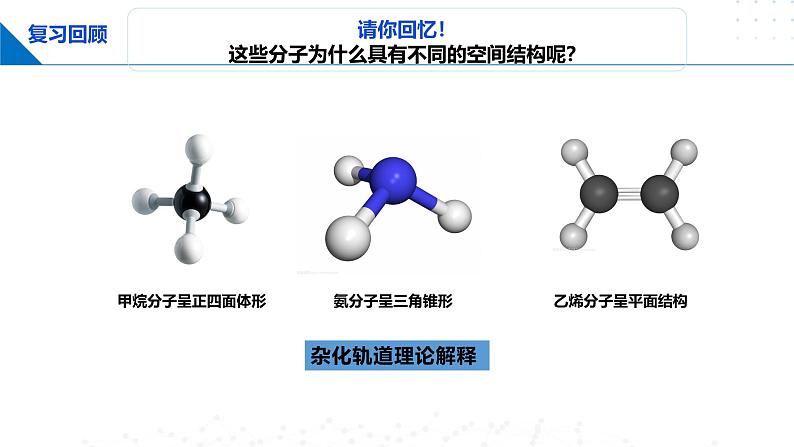
请你回忆!这些分子为什么具有不同的空间结构呢?
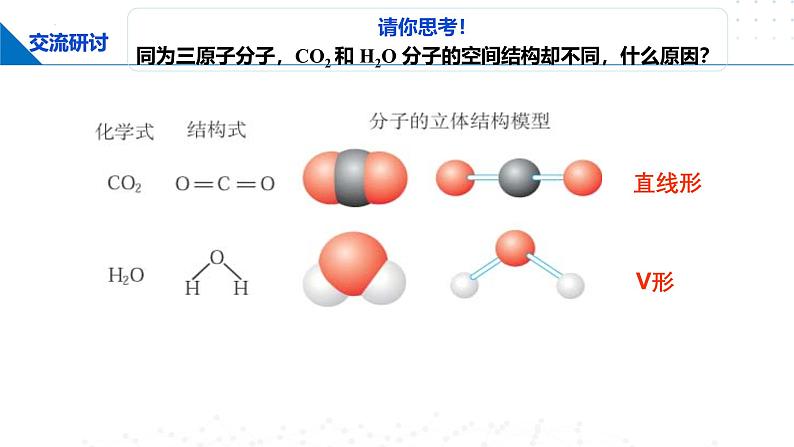
请你思考!同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
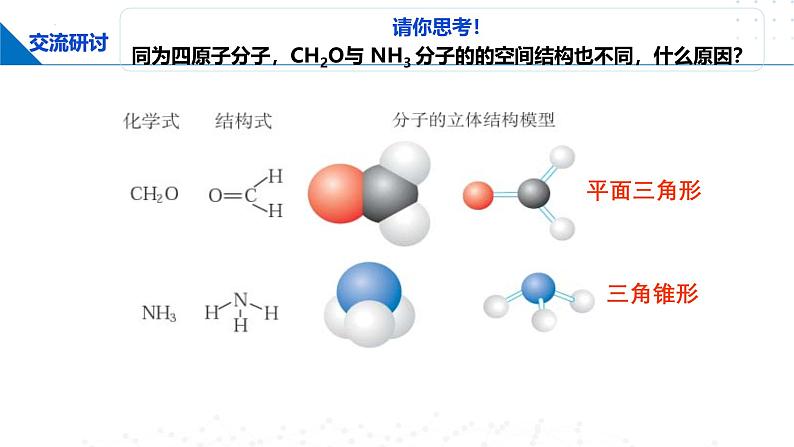
请你思考!同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
第二章 微粒间相互作用与物质性质
第 2 节 共价键与分子的空间结构
课时2 分子空间结构的理论分析价电子对互斥理论
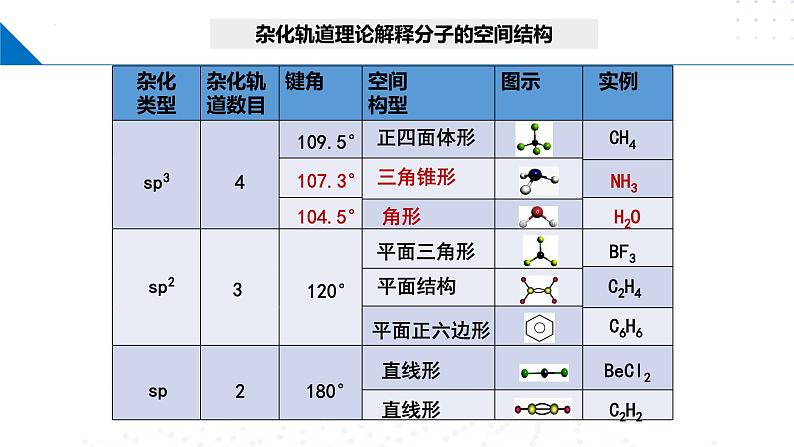
杂化轨道理论可以解释分子的空间结构
但对未知分子的空间结构如何预测性?
请你思考! 写出CO2、H2O、NH3、CH2O、CH4等分子的电子式、结构式及分子的空间构型
预测未知分子的空间结构
分析CO2 , H2O,NH3 ,CH2O,CH4电子式的中心原子价电子层电子的成键情况。
n(价电子对数)=成键电子对数+孤电子对数
分子中的中心原子的价电子对——成键电子对(bp)和孤电子对(Ip)由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
一种比较简单的理论,可用来预测分子或离子的空间结构
对ABn型的分子或离子,分子中的中心原子的价电子对——成键电子对(bp)和孤电子对(Ip)由于相互排斥作用,处于不同的空间取向且尽可能趋向于彼此远离。
推测分子的空间结构方法
先分析分子中的中心原子的价电子对存在几个空间取向,再让这几个空间取向尽量彼此远离。
(1)两个原子间的成键电子不论是单键还是多重键,都看作一个空间取向;
(2)一对孤电子对可看作一个空间取向。
不同价电子对数的空间取向
直线形 面三角形 正四面体形 三角双锥形 正八面体形
σ键电子对可从分子式来确定(ABn型)
A——中心原子,B——与A结合的原子n——与A结合的原子数
例如:H2O中O的σ键电子对数是______; NH3 中的σ键电子对数是________。
1、CO2中O的σ键电子对数是______;2、SO3中O的σ键电子对数是______;3、H3O+中O的σ键电子对数是______;4、NH4+ 中的σ键电子对数是________。
中心原子孤电子对数的确定方法
中心原子上的孤电子对数,可以通过写出该分子或离子的电子式来确定
中心原子上的孤电子对数
中心原子上的孤电子对数,也可以利用如下公式来计算:
例如,H2O的中心原子为O原子,其价电子数为6,H原子的未成对电子数为1,可知:
中心原子的价电子数=主族序数
中心原子上的孤电子对数
(4-2×2)÷2=0
(5-3×1)÷2=1
(6-3×2)÷2=0
其他原子的未成对电子数之和
成键电子对和孤对电子对会影响分子的空间构型.
请你思考! 请用价电子对互斥理论预测甲烷的空间结构
根据VSEPR模型 预测 分子结构
含孤电子对VSEPR模型
(4-4×1)÷2=0
水分子中氧原子价电子对数=2+2=4
(5-3×1)÷2=1
(6-3×2)÷2=0
(6-2×2)÷2=1
平面三角形 BF3
4 0 AB4
3 1 AB3
2 2 AB2
对于乙醇和乙酸这样看似更加复杂的分子,同样可以用“价电子对相互排斥而尽量远离”的原则快捷地判断它们的分子结构
在乙酸分子中,羧基上的碳原子的价电子对均为成键电子对,C=O 上的成键电子对仅有一个空间取向,因此碳原子的价电子对共有三个空间取向,相互排斥而远离,因此 C—C—O 部分呈三角形。
在乙醇分子中,羟基上的氧原子有两对成键电子对和两对孤电子对,价电子对共有四个空间取向;氧原子价电子对相互排斥而远离,呈四面体形,因此 C—O—H 呈角形。
请你思考!实验测得NH3的键角为107°,H2O的键角为105°,为什么NH3和H2O的键角均小于109°28′?
CH4分子中的C原子没有孤电子对,NH3分子中N原子上有1对孤电子对,H2O分子中O原子上有2对孤电子对,对成键电子对的排斥作用增大,故键角减小。
当价电子对包含孤电子对且成键电子对中也有多重键时,由于它们之间的斥力不同,会对分子的空间结构产生影响。通常,多重键、成键电子对与孤电子对的斥力大小顺序可定性地表示为:三键一三键>三键-双键>双键-双键>双键-单键>单键一单键Ip-Ip> > lp-bp> bp-bp
孤电子对-孤电子对>孤电子对-成键电子对>成键电子对-成键电子对。随着孤电子对数目的增多,成键电子对与成键电子对之间的斥力减小,键角也减小。
所以,CH4、NH3、H2O这三种分子的价电子对数为4,因此应该按四面体方向排布价电子对,但由于孤电子对排斥力大,使得氨分子中的键角为107. 3°,水分子中的键角为104. 5°。
俗称光气的二氯甲醛分子(COCI2)的价电子对数为3,分子为平面三角形
但由于存在碳氧双键,使得单键一双键的键角为124. 1°、单键一单键的键角为111. 8°.
值得注意的是,价电子对互斥理论一般不适用于推测过渡金属化合物分子的空间结构。
1.下列物质中,分子的空间结构与氨分子相似的是( )A.CO2 B.H2S C.PCl3 D.SiCl4
2.下列微粒中,中心原子含有孤电子对的是( )A.SiH4 D. NH4+
3.若ABn型分子的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥模型,判断下列说法中正确的是( )A.若n=2,则分子的空间结构为V形B.若n=3,则分子的空间结构为三角锥形C.若n=4,则分子的空间结构为正四面体形D.以上说法都不正确
4.有X、Y两种活性反应中间体微粒,均含有1个碳原子和3个氢原子,其球棍模型如图所示: , 。下列说法错误的是( )A.X的组成为CH3+ B.Y的组成为CH3-C.X的价层电子对数为4 D.Y中键角小于120°
化学鲁科版 (2019)第3节 离子键、配位键与金属键示范课课件ppt: 这是一份化学鲁科版 (2019)<a href="/hx/tb_c4002603_t3/?tag_id=26" target="_blank">第3节 离子键、配位键与金属键示范课课件ppt</a>,共43页。PPT课件主要包含了直线形,三角锥形,平面三角形,价电子对互斥理论,a–xb,CO2,NH3,SO3,nC4,四面体形等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构优质ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002447_t3/?tag_id=26" target="_blank">第二节 分子的空间结构优质ppt课件</a>,共17页。PPT课件主要包含了三原子分子,四原子分子,CO2,H2O,NH3,直线形,三角锥形,CH2O,平面三角形,价层电子对等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构评课ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2<a href="/hx/tb_c4002602_t3/?tag_id=26" target="_blank">第2节 共价键与分子的空间结构评课ppt课件</a>,共20页。PPT课件主要包含了饱和性,方向性,头碰头,肩并肩,复习回顾,共价键,鲍林杂化轨道理论,交流研讨,杂化轨道理论,基态碳原子等内容,欢迎下载使用。













