





高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第4节 离子反应优秀课件ppt
展开物质含量的测定(定量)
解释生产生活中的某些现象
二、离子反应的应用——离子浓度的定量测定
探讨:测定原理 实验仪器 操作步骤 数据记录与处理 误差分析
【应用1】现有已知浓度的NaOH溶液,如何测定盐酸中H+浓度呢?
1、酸碱中和滴定的定义: 用已知物质的量浓度的酸或碱(标准溶液)来测定未知物质的量浓度的碱或酸(待测溶液或未知溶液)的方法叫做酸碱中和滴定。
已知浓度的溶液——标准液未知浓度的溶液——待测液
2、酸碱中和滴定的原理: 以酸碱中和反应为基础 ( H++ OH- = H2O) , 在滴定达到终点 (即酸碱恰好反应)时,有 n(H+) =n(OH-) 即:C酸(H+)•V酸= C碱(H+)•V碱
量取一定体积的待测液,用已知浓度的标准液来滴定,并记录所消耗标准液的体积,就可以计算出待测液的浓度。
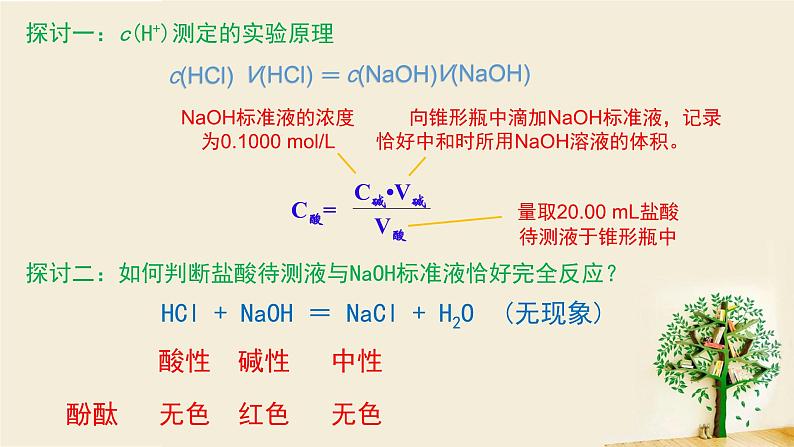
探讨一:c(H+)测定的实验原理
量取20.00 mL盐酸 待测液于锥形瓶中
NaOH标准液的浓度为0.1000 ml/L
向锥形瓶中滴加NaOH标准液,记录恰好中和时所用NaOH溶液的体积。
探讨二:如何判断盐酸待测液与NaOH标准液恰好完全反应?
HCl + NaOH = NaCl + H2O (无现象)
酸性 碱性 中性
酚酞 无色 红色 无色
探讨三:酸碱中和滴定的关键:
⑴准确量取(测定)参加反应的酸溶液和碱溶液的体积。⑵ 准确判断中和反应的恰好进行(判断滴定终点)。
使用酸碱指示剂来确定滴定终点。
酸碱指示剂:酚酞、甲基橙、石蕊等。
使用酸式和碱式滴定管量取溶液体积。(或使用移液管)
——— 3.1 ——— 4.4 ———
酸性 中间色 碱性
红色 橙色
——— 5.0 ——— 8.0 ———
——— 8.2 ——— 10.0 ———
红色 紫色 蓝色
常用指示剂的变色范围
强酸强碱相互滴定,可选择酚酞作指示剂。
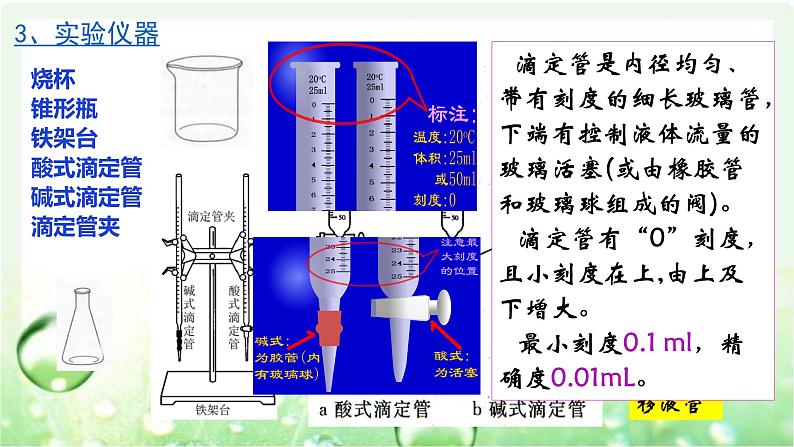
烧杯锥形瓶铁架台酸式滴定管碱式滴定管滴定管夹
滴定管主要用来精确地量取(转移)一定体积的液体。 移液管是用来准确转移固定体积的液体。
滴定管是内径均匀、带有刻度的细长玻璃管,下端有控制液体流量的玻璃活塞(或由橡胶管和玻璃球组成的阀)。 滴定管有“0”刻度,且小刻度在上,由上及下增大。 最小刻度0.1 ml,精确度0.01mL。
① 查漏:活塞处是否漏水。② 洗涤:先用蒸馏水洗,再用待盛溶液润洗2~3次。③ 装液:注入待盛溶液,使液面位于“0”刻度线以上2~ 3 cm处,再把滴定管固定在滴定管夹上。④排气:在滴定管下方放一个烧杯,调节活塞使滴定管的尖嘴部分充满溶液,不留气泡。⑤调零:调节液面处在“0”或“0”以下某刻度处。⑥读数:记下液面准确读数 a.视线与凹液面最低处保持水平 b.估读到小数点后第二位
左手控制滴定管活塞,右手振荡锥形瓶(向同一方向做圆周运动);眼睛注视锥形瓶内溶液的颜色变化,至指示剂变色半分钟不褪色即为终点。
滴加速度先快后慢,直至指示剂颜色突变。
等到滴入最后一滴标准液,指示剂变色,且在半分钟内不恢复原来的颜色,视为滴定终点并记录标准液的体积。
按上述中和滴定操作重复二至三次,记录每次氢氧化钠标准液的消耗体积,取平均值,代入下列公式进行计算。
若上述酸碱中和滴定的实验数据如下表所示,试通过计算确定盐酸的物质的量浓度。
= 0.0940 ml/L
指示剂的变色范围和接近滴定终点时的PH突变范围的关系
用NaOH溶液滴定HCl溶液
误差的大小要根据计算式分析。一般来说,实验中造成的误差对c待测的影响,均可以转化为:c标准、V待测均为定值,实验中最终所使用的V标准的数值的大小。V标准多,c待测偏大,V标准少,c待测偏小
例题:用标准盐酸滴定未知浓度的氢氧化钠溶液(氢氧化钠放于锥形瓶中)下列操作(其它操作均正确),对氢氧化钠溶液浓度有什么影响?
⑴未用标准液(HCl)润洗酸式滴定管⑵滴定管内壁不干净,滴定后,酸式滴定管内壁挂水珠 ⑶滴定管尖嘴处有气泡,滴定后气泡消失⑷滴定操作时,有少量盐酸滴于锥形瓶外⑸锥形瓶内用蒸馏水洗涤后,再用待测氢氧化钠润洗2-3次,将润洗液倒掉,再装NaOH溶液⑹锥形瓶用蒸馏水洗后未倒尽即装NaOH溶液
酸碱中和滴定方法的拓展应用
利用离子反应的定比关系,用已知准确浓度的溶液,来滴定未知浓度的溶液。
1.准确量取24.90 mL高锰酸钾溶液,可选用的仪器是( )A.50 mL量筒 B.10 mL量筒C.50 mL酸式滴定管D.50 mL碱式滴定管2.下列有关叙述正确的是( )A.下端连有橡胶管的滴定管为酸式滴定管B.在进行滴定时,左手操作锥形瓶,右手操作滴定管C.滴定前应排除滴定管尖嘴部分的气泡D.滴定过程中两眼应注意滴定管内液面的变化
3.准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 ml·L-1NaOH溶液滴定,下列说法正确的是( )A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小
4.用1.0 ml·L-1 NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积V关系如图所示。原硫酸溶液的物质的量浓度和反应后溶液的总体积是( ) A.1 ml·L-1 60 mL B.0.5 ml·L-1 80 mL C.0.5 ml·L-1 60 mL D.1 ml·L-1 80 mL
5.当用酸滴定碱时,下列操作中会使测定结果(碱的浓度)偏低的是( )A.酸式滴定管滴至终点后,俯视读数B.碱液移入锥形瓶后,加了10 mL蒸馏水再滴定C.酸式滴定管用蒸馏水润洗后,未用标准液润洗D.酸式滴定管注入酸液后,尖嘴留有气泡即开始滴定,滴定终点时气泡消失
鲁科版 (2019)选择性必修1第4节 离子反应完整版课件ppt: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002590_t3/?tag_id=26" target="_blank">第4节 离子反应完整版课件ppt</a>,文件包含34离子反应第3课时离子反应的应用2-2022-2023学年高二化学同步精品课堂鲁科版2019选择性必修1pptx、Ag+与Cl-Br-I-反应mp4、离子反应的应用离子的检验mp4等3份课件配套教学资源,其中PPT共17页, 欢迎下载使用。
高中化学鲁科版 (2019)选择性必修1第4节 离子反应完美版课件ppt: 这是一份高中化学鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002590_t3/?tag_id=26" target="_blank">第4节 离子反应完美版课件ppt</a>,共19页。PPT课件主要包含了学以致用,课堂练习等内容,欢迎下载使用。
鲁科版 (2019)选择性必修1第4节 离子反应教案配套课件ppt: 这是一份鲁科版 (2019)选择性必修1<a href="/hx/tb_c4002590_t3/?tag_id=26" target="_blank">第4节 离子反应教案配套课件ppt</a>,共25页。PPT课件主要包含了离子反应的应用,离子的检验,Cl-Br-I-,实验目的,实验原理,酸碱指示剂,实验用品,实验仪器,终点判断,物质制备与纯化等内容,欢迎下载使用。














