






高中化学鲁科版 (2019)选择性必修1第3章 物质在水溶液中的行为第3节 沉淀溶解平衡一等奖课件ppt
展开一、沉淀溶解平衡与溶度积
1、难溶电解质存在沉淀溶解平衡
Ksp=c平m(An+)·c平n(Bm -)
2、平衡受到外界条件的影响会发生移动,如:温度、浓度等,移动方向可以通过溶度积Ksp和浓度商Q关系来判断。
Q = cm(An+)•cn(Bm -)(任意时刻浓度)
Q = Ksp平衡状态
Q < Ksp平衡向右(溶解)方向移动
Q > Ksp 平衡向左(沉淀)方向移动
控制离子浓度的大小,可以使反应向所需要的方向移动(生成、溶解和转化。
二、沉淀溶解平衡的应用
⑴沉淀的溶解(Q < Ksp )
①通过调节pH,使弱碱阳离子生成沉淀;
⑵沉淀的生成(Q > Ksp)
②加沉淀剂,使某些离子生成难溶物质而沉淀;
③ 分步沉淀,根据不同难溶物的溶解能力加入沉淀剂使之逐一沉淀而分离。
为什么医学上常用BaSO4作为内服造影剂“钡餐”,而不用BaCO3作为内服造影剂“钡餐”?
所以,不能用BaCO3作为内服造影剂“钡餐”。
平衡向右移动,Q < Ksp,BaCO3溶解,Ba2+浓度增大
SO42-是强酸的酸根离子,很难与H+结合生成硫酸,胃酸中的H+对BaSO4的溶解平衡基本没有影响,Ba2+浓度保持在安全浓度标准内,所以用BaSO4 作为内服造影剂“钡餐”。
如果误将可溶性钡盐当做食盐或纯碱食用,会造成钡中毒。中毒者应尽快用5.0%的Na2SO4溶液给患者洗胃,随后用导泻剂使钡盐尽快排除。为什么?
解释:误服可溶性钡盐后,服用5.0%的Na2SO4溶液,由于Q > Ksp(BaSO4),。SO42-和Ba2+结合生成BaSO4沉淀,使Ba2+浓度降低而解除毒性。
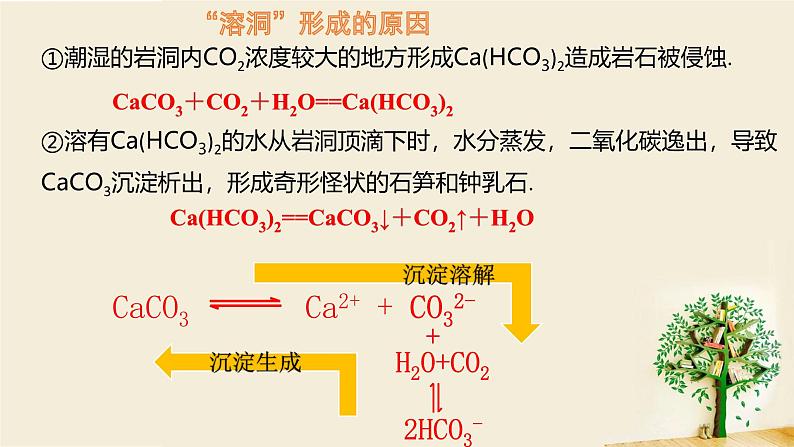
1.溶洞里美丽的石笋、钟乳石和石柱是大自然创造的奇迹。石灰岩里不溶性的碳酸钙与水及二氧化碳反应能转化为微溶性的碳酸氢钙。溶有碳酸氢钙的水从溶洞顶向下滴落时,水分蒸发、二氧化碳压强减小及温度的变化都会使二氧化碳溶解量减小,致使碳酸钙沉淀析出。这些沉淀经过千百万年的积聚,渐渐形成了钟乳石、石笋等。请写出上述过程所涉及反应的化学方程式,并从沉淀溶解平衡的角度进行解释。
①潮湿的岩洞内CO2浓度较大的地方形成Ca(HCO3)2造成岩石被侵蚀.②溶有Ca(HCO3)2的水从岩洞顶滴下时,水分蒸发,二氧化碳逸出,导致CaCO3沉淀析出,形成奇形怪状的石笋和钟乳石.
CaCO3+CO2+H2O==Ca(HCO3)2
CaCO3 Ca2+ + CO32-
Ca(HCO3)2==CaCO3↓+CO2↑+H2O
2.珊瑚虫是海洋中的一种腔肠动物,它们可以从周围的海水中获取 CO2 和HCO3-,经反应形成珊瑚∶ Ca2++2HCO3-= CaCO3+CO2+H2O 珊瑚周围藻类植物的生长会促进碳酸钙的产生,对珊瑚的形成贡献很大。人口增长、人类大规模砍伐森林、燃烧煤和其他化石燃料等因素,都会干扰珊瑚的形成,甚至造成珊瑚虫死亡。请分析这些因素影响珊瑚生长的原因。
珊瑚是珊瑚虫从周围海水中获取Ca2+和HCO3-生成CaCO3而不断生长。CaCO3存在溶解平衡,人类活动使空气中的CO2浓度增大,海水水中溶解的CO2增多,与更多的CO32-反应生成HCO3-,使Q < Ksp(CaCO3),CaCO3的沉淀溶解平衡向右移动,CaCO3不断溶解而造成的珊瑚减少,珊瑚虫死亡。
Ca2++2HCO3- CaCO3+CO2+H2O
CO2浓度增大,平衡左移
生成白色沉淀,向沉淀中加入CuSO4溶液后白色沉淀变为黑色
白色ZnS沉淀转化为黑色CuS沉淀
Ksp=1.6×10-24ml·L-1
Ksp=1.3×10-36ml·L-1
ZnS(S) Zn2+(aq)+S2- (aq)
CuS(S) Cu2+(aq)+S2- (aq)
ZnS(S) Zn2+(aq) + S2- (aq)
ZnS(S) +Cu2+(aq)=CuS(S)+ Zn2+(aq)
①通常,溶解度( 或Ksp )小的沉淀可向溶解度 (或Ksp)更小的沉淀转化;
②溶解度差别越大,转化越容易;若相差不大,则可相互转化。
存在沉淀A的溶解平衡,加入B的离子,对于B,Q > Ksp(B),生成沉淀B; 对于A,Q
(1)沉淀转化的实质:
在工业废水处理过程中为何可用FeS等作为沉淀剂除去 废水中的Cu2+、Hg2+、Pb2+等重金属离子。
写出FeS(s)与废水中的Cu2+、Hg2+、Pb2+的反应离子方程式。
FeS(s) + Cu2+(aq) = CuS(s) + Fe2+(aq)
FeS(s) + Pb2+(aq) = PbS(s) + Fe2+(aq)
FeS(s) + Hg2+(aq)= HgS(s) + Fe2+(aq)
Ksp(FeS)=6.3×10-18ml2•L-2 Ksp(CuS)=1.3×10-36ml2•L-2 Ksp(HgS)=6.4×10-53ml2•L-2 Ksp(PbS)=3.4×10-28ml2•L-2
硬水:是含有较多Ca2+、Mg2+、HCO3-、Cl-和SO42-的水.
水垢成分CaCO3 Mg(OH)2CaSO4
Ca(HCO3)2Mg(HCO3)2MgSO4 CaSO4 MgCl2CaCl2
水垢成分CaCO3 MgCO3CaSO4
为什么在水垢中镁主要以Mg(OH)2沉淀形式存在,而不是MgCO3沉淀的形式存在?比较它们饱和时[Mg2+]的大小。
1.已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24。下列说法正确的是( )A.同温度下,CuS的溶解度大于ZnS的溶解度B.将足量CuSO4溶解在0.1 ml·L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 ml·L-1C.因为H2SO4是强酸,故 CuSO4+H2S = CuS↓+H2SO4 不能发生D.除去工业废水中的Cu2+,可以选用FeS作沉淀剂
2.已知相同温度下,Fe(OH)3的溶解度小于Mg(OH)2的溶解度,且随pH的升高,Fe(OH)3首先析出。为除去MgCl2酸性溶液中的Fe3+,可以在加热搅拌的条件下,加入一种试剂,过滤后再加入适量盐酸,这种试剂不可以是( )A.NH3·H2O B.MgO C.Mg(OH)2D.MgCO33.T ℃时,Ksp[Cu(OH)2]=2.2×10-20 ml3·L-3,Ksp[Fe(OH)3]=1.1×10-38 ml4·L-4。此温度下要除去CuCl2溶液中的少量FeCl3,可以边搅拌边加入一种试剂,这种试剂是( )A.CuO B.NaOH溶液 C.氨水D.CuSO4溶液
4、试利用平衡移动原理解释下列事实:(1)FeS不溶于水,但能溶于稀盐酸中(2)分别用等体积的蒸馏水和0.010ml/L硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4 的损失量大于用稀硫酸洗涤的损失量。
S2-与H+作用生成的H2S气体会逸出反应体系,使FeS的沉淀溶解平衡向溶解方向移动。
硫酸溶液中的SO42-对BaSO4的沉淀溶解平衡有促进平衡向生成沉淀的方向移动的作用。
5、在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5ml·L-1)时,溶液中c(Ag+)为____________ml·L-1,此时溶液中c(CrO42-)等于__________ml·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
高中化学第3节 沉淀溶解平衡完美版课件ppt: 这是一份高中化学<a href="/hx/tb_c4002589_t3/?tag_id=26" target="_blank">第3节 沉淀溶解平衡完美版课件ppt</a>,文件包含33沉淀溶解平衡第1课时沉淀溶解平衡与溶度积2019鲁科版选修1化学反应原理pptx、PbI2固体的沉淀溶解平衡mp4等2份课件配套教学资源,其中PPT共15页, 欢迎下载使用。
人教版 (2019)选择性必修1第四节 沉淀溶解平衡完整版ppt课件: 这是一份人教版 (2019)选择性必修1<a href="/hx/tb_c4002429_t3/?tag_id=26" target="_blank">第四节 沉淀溶解平衡完整版ppt课件</a>,共20页。PPT课件主要包含了学习目标,素养目标,情境引入,教学过程,沉淀的转化,硫酸钙除去方案,分析原因,AgIs,+I-aq,Ag2Ss等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第四节 沉淀溶解平衡获奖ppt课件: 这是一份高中化学人教版 (2019)选择性必修1<a href="/hx/tb_c4002429_t3/?tag_id=26" target="_blank">第四节 沉淀溶解平衡获奖ppt课件</a>,共17页。PPT课件主要包含了学习目标,素养目标,情境引入,教学过程,沉淀的生成,沉淀的溶解,HCO3-aq,实验探究,沉淀不溶解,沉淀溶解等内容,欢迎下载使用。













